Способ получения четвертичных солей простых эфиров 6,11- дигидродибензо @ тиепин-11- @ -алкилнорскопина
Иллюстрации
Показать всеРеферат
СОЮЗ СОЭЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИИ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ПАТЕНТУ
7 ." -,, @й,"„ :;-,;, "" -:- Л,,.
E (21) 3566494/23 — 04; 3579505/23-04 (22) 22.03.83 (3 l} P 321 l.185.1 (32) 26.03.82
Ъ (33} ФРГ. (46} 07.03,85. Бюл. У 9 (72) Рольф Бангольцер ирудольф Бауер (ФРГ) (11) Берингер Интельгейм КГ (ФРГ) (53) 547.891.1.07 (088.8) (56) l. Вейганд-Хильгетаг. Методы эксперимента в органической химии. M., "Химия", 1968, с. 333.
2. С. А., 82:103152У, 1975.
3, Nerner G., Schmidt К. Н. Die Darstel-j
1ung von Scopin ens Scopo1eminz.-".Tetrehed— гоп Letters", 1967, 14, 1283-1284. (54) (57) СПОСОБ ПОЛУЧЕНИЯ ЧЕТВЕРТИЧНЫХ СОЛЕИ ПРОСТЫХ ЭФИРОВ 6,1!-ДИГИД-
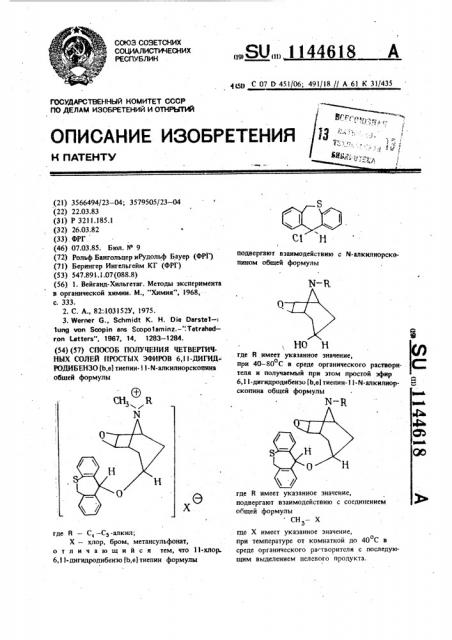
РОПИБЕНЗО 1Ь,в) тиепин- l l й-алкилнорскопина общей формулы где R — С, — Сз-алкин;
Х вЂ” хлор, бром, метансульфонат, отличающийся тем, что ll-хлор. б, l l»дигидродибензо fb,е) тиепин формулы
„„SU„„1144618 А. 15Р С 07 D 451/06; 491/18 // А 61 К 31/435 подвергают взаимодействию с N-алкилнорскопином общей формулы
НО Н . где R имеет укаэанное значение, а при 40 — 80 С в среде органического раствори. С,. теля и получаемый при этом простой эфир
6,11-дигндродибензо(Ь,в) mewn-11-1ч-алкилнор- 2 скопина общей формулы
N — Н, аа где R имеет указанное значение, подвергают взаимодействию с соединением общей формулы
СН— где Х имеет указанное значение, при температуре от комнатной до 40 С в о среде органического растворителя с последующим выделением целевого продукта.
1!44618
N-- т) Ч!! — С вЂ” !.} ! !(l
Изобретение относится к получению четвсртичпых солей простых эфиров 6,11-дигидродибензо (b,e) тиепин-1 !-М-алкилнорскопина общеи формулы (}
1 -цг P С .. С .алкин 20
Х вЂ” хлор, бром, метансульфоиат, облацаннцнх спазмолнтической активносгью.
3)эвс стно получение простых эфиров взаимодействием спиртов и галогенсо!сержантик соединений (1) .
Иэве тно также получение четвертнчиых солей различных М-содержащих г етероцикли. ческих соединений взанмггцействнем соответстocH0B3HHH с алкищ.ало!.спицами (2), Целью изобретения является разработка на, основе известного метода, способа получения новых соединении, обладающих ценными фармацевтическими свойствами !!(оставленная цель постигается способом получения четвертичных солей простых эфиров
6,11-дигидродибензо (b е) тнепин-11-й-алкилнор35 скопина общей формулы (1 ), заключающимся в том. что 11-хлор-6,11- дигицроцибенэо (b,e) тиепин формулы
I(l Н
45 подвергают взаимодействию с М-алкилнорскопином общей формулы где 8 имее1 указанное значение, при 40-- 80 С в среде органического растворио
2 теля и получаемый при этом простой эфир
6, 1-цигидроцибензо (b,е)тиепин- 11-Й-алкилнорскопина общей формулы, це R имеет укаэанное значение. подвергают взаимодействию с соединением общей формулы
СН, -- Х гце Х имеет указанное значение, о г ри температуре от комнатной цо 40 С в среде органического растворителя
Целевой продукт выделяют известными приемами.
Исходное соединение формулы II I} можно получать известными способами, например следующщч образом:
Соединение общей формулы
Соединения общих формул I 1) и E.!Ч) в дибенэотиепиновом радикале имеют асимметричный атом утлерода, поэтому их л лучают в
1144618
3 виде рацемической смеси двух оптически активных энантиомеров.
Пример 1.
a) Простой эфир 6,11-дигидродибензо (Ь,е) тиепин- 11- скопина.
195,5 r (1,26 моль) скопина растворяют в 600 мл абсолютного хлористого мегилена и к получаемому раствору при 40 С в течение о
3 ч прибавляют по каплям раствор 156,5 г (0,63 моль) l l -хлор-б, l l-дигидродибензо (Ь,е) тиепина в 200 мл абсолютного хлористого метилена. По истечении 3 дней при 40 С реакцию прекрашают, осадившиеся кристаллы (110 г гидрохлорида скопина) отсасывают и промывают хлори=тым метиленом. Объединенные растворы хлористого метилена экстрагируют сначала водой, а затем 600 мл)
1 N соляной кислоты, фазу хлористого метилена промывают водой до нейтральной реакции и объединенные водные фазы подшелачивают водным раствором карбоната натрия (66 r карбоната натрия в 200 мл воды ) и экстрагируют хлорйстым метиленом. Объе диненные Шелочные фазы хлористого метилена сушат над сульфатом натрия и хлористый метилен отгоняют при пониженном давлении.
Получают 189 г белых кристаллов, которые перекристаллиэовывают из а™етонитрила (над активным утлем) .
Выход )59,8 г (69,4% теоретического выхо30 о да) белых кристаллов с т. пл !74 — 175 С.
Найдено,%: С 71,92; Н 6,44; N 4,13;
$8,89
С Н а М0 $
Вычислено,%: С 72,30; Н 6,34; N 3,83;
S 8,77. б) Метилбромид простого эфира 6,11-дигидробензо (Ь,е) -тиепин- l l-скопина.
2,0 г (0,0055 моль) полученного согласно 40 примеру 1 а простого эфира 6,)l-дигидродибензо (Ь,е) тиепин-11-скопина подвергают взаимодействию с 2,6 r (0,0275 моль) метил1 бромида в среде 35 мл абсолютного ацетонитрила при комнатнои температуре. Через 24 ч 45 процесс квартернирования прекрашают. Затем ацетонитрил отгоняют, осадок поглошают в . апетонитриле и перенасышают простым эфиром.
После неоднократного повторения этой операции получаемый твердый продукт растворяют 50 в воде, очишают активным утлем и получаемый прозрачный раствор сушат вымораживанием.
Выход 1,2 г (47,4% теоретического выхода)55
Получаемое белое вещество плавится, при темпера гуре от 140 С (при разо мягчении) 4
Найдено,%: С 57,94; Н 6,70: N 2,99;
S 662 (С Н ь ИОт$) Вг - Н О
Вычислено,%: С 57,74; 11 5,90; N 2,93
S 6,70
Пример 2. Метилметансульфонат простого эфира 6,) l-дигилродибензо(Ь,е)-тиепин- 1 1- скоп ина.
131,3(036 моль) получаемого согласно примеру l уа простого эфира 6,1)-дигидродибензо (Ь,е) тиепип-11-скопина растворяют в 400 мл абсолютного хлористого метилена, прибавляют 47,4 r (0,43 моль) сложного метилового эфира метансульфокислоты и перемешивал, при 40 С смеси дают прореагироо
I вать. Через 6 ч добавляют еще 19 г (0,17 моль) сложного метилового эфира метансульфокислоты. После общей продолжительности реакции, равной 24 ч, процесс квартернирования прекращают. Осадившиес кристаллы отсасываю и промывают хлористым метиленом. Получают первые 149,6 г продукта в виде сырых белых кристаллов с т. пл..".3(-237 С (разложение). К раствору хлористого метилена добавляют еше 8,5 г (0,08 моль) сложного метилового эфира метансульфокислоты и смеси дают еше раз прореагировазь на протяже о нии 24 ч при 40 С. Для достижения полной конверсии добавляют еше раз 8,5 г (0,08 моль) сложного метилового эфира метансульфокислоты и смесь остаьляют стоять в течение 24 ч. После ппомывки хлористым метиленом получают еще )8.) г в виде сыры белых кристаллов с т. пл. "36 237 С (азложение). Обе фракции сырых кристаллов в среде метанола очигцают HBJI, активным углем и после прибавления апетони ðèëà метанольный раствор подвергают кондея грированию под пониженным давлением ло образования кристаллов.
Выход 137,7 г (80,4% теорс кческого выхода) .
Получаемые белые кристаллы имеют т. пл., 236-237 С (разложение) .
Найдено.%: С 60,50; F) 5,98; N 3,05;
S 13,37. (С ) Н ь МО $) СНт$0
Вычислено,%; С 60,61; Н 6,)5; N 2,95;
S 13 48
Пример 3. а) Простой эфир 6,11- -дигицродибензо (Ь,е) тиепин-11- N- этилнорскопина.
5>5 г (0,032 моль) N-этилнорскопина растворяют в 50 мл абсолютного толуола и к получаемому раствору прибавляют по каплям раствор 4,0 г (0,016 моль) ))-хлор-б,ll-дигиц. родибензо(Ь,е)тиепина в 30 мл абсолютного о толуола при 80 С в теченис !0 мин. По ис!!44618 течении 6 ч при 80 С реакцито прекращают.
Реакционную смесь перерабатывают согласно примеру l.
Выход 5,7 г (93,4% теоретического вьиода).
Получаемые кристаллы (из ацетоннтрила) и имеют т. пл. 128 — 130 С.
Найдено,%: С 72,56; Н 6.68; И 3,68;
S 8,37
С, Нт ИО2$
Вычислено,%: С 72,79; Н 6,64; N 3,69;
S 845
Исходный И- этнлнорскопин получают следующим образом.
35,4 r (0,1 моль) гидрохлорида И-этнлнорскополамииа суспендируют в 350 мл этанола и полу- 15 чаемую суспензию с ннтерваламн времени по 20 мл 20 мни шестью порциями смешивают с 3,78 г о (0,1 моль) борана натрия при 20 С н постоянном перемешиванни.
Затем реакционную смесь оставляют стоять
26 иа 12 ч для завершения реакции. По истечении этого времени процесс гндрогенолиза r; закончен. Затем при температуре от — 5 до
l0 С в атмосфере азота до начала кислой
25 реакции подают хлористоводородныи газ и промывают раствор 1,5 л простого эфира, очищая его от хлористого водорода. Получаемые после сушки кристаллы в мелкорастертом виде сусцеидируют в 2 л хлористого метилена, нагревают до кипения и для обра- 30 зования основания в кипящей хлористый метилен до полной конверсии подают аммиак.
После отделения органических солей хлористый метилен отгоняют при пониженном давлении и 30 С. Получают бесцветные кристал- gg лы (этанол/простой эфир) с r, пл. 139—
141 С. б) Метилбромиц простого эфира б, l l-дигидродибеизо (Ь,e) тиепии-11-N- этилнорскопина.
2,0 г (0,0053 моль) полученного согласно 4п примеру 3 а) простого эфира 6„11-дигидродибензо (b,е) тиепин- 11- N- зтилнорскопина подвергают в.зимодействню с 3,75 r (0,04 моль) метилбромида в среде 14 мл абсолютного ацетонитрила при комнатной температуре.
По истечении 48 ч процесс квартерннроваиия прекращают. Ацетонитрнл отгоняют, остаток поглощают в ацетонитриле и перенасышают простым эфиром. После неоднократного повторения этой операции получаемый твердый продукт растворяют в воде, очищают активным углем и получаемый прозрачный раствор сушат вымораживанием.
Выход 1,5 г (60,0% теоретического выхода).
S5
Получаемое твердое вещество плавится при температуре от 130 С (прн размягчении) Найдено,%: С 59,12; Н 7,26; N 2,95;
S 6,69; Br 16,24. (С 4 Н та И0 $) Вг 1/2 Н аО
Вычислено,%: С 59,62; H 6,05; N 2,90;
S 6,63; Br 16,53.
Аналогично примерам 1 — 3 получают следующие соединения.
Гидрохлорид простого эфира 6,1 1-дигндродибенэо (b, в) тиепин- N- н- пропилнорскопина.
Т.пл.(изопропанол) 183-185 С (разложение).
Найдено%: С 65,75; Н 6,87; И 3,11;
$7,11; Cl 7,89
С (H I ИО а$ ° НС1 ° 1/2 Нг О
Вычислено,%: С 65,66; Н 6,66; N 3,19;
$7,30; Cl 8,07.
Метилбромид простого эфира 6,11-днгидродибензо (Ь,е) тиепин-И-í-пропилнорскопнна, Т. пл. 150 — 160 С {разложение).
Найдено,%: С 56,47; Н 6,06; N 2,76;
S 6, l 6; Вг 15,10 (С!<Н аNO<$)Br 2 1/4 Н О
Вычислено,%: С 56,47; Н 6,57; И 2,65;
S 6,06; 8r 15,11.
Гидрохлорид простого эфира б, l l-дигидроднбензо (Ь,e) -тиепин-И-нзопуопилнорскопина.
Т.нл. (этанол) 150 — 151 С (разложенне) .
Найдено,%: С 65,81; Н 7,29; И 2,97;
C l 7,54
С„Н„NO,S НС! - 3/4 С,Н,ОН
Вычислено,%: С 65,93; Н 7,05; И 3,02;
С! 7,63
Метилхлорид простого эфира б, l l -дигидродибензо (Ь,e) тиепнн- И- изопропилнорскопина, Точка размягчения 148оС (не кристаллизуется).
Найдено%: С 62,97; Н 7,11; N 2,90;
С l 6,81 оИ02S) Cl 2HrzO
Вычислено,%: С 62,55; Н 7,14; И 2,92;
Сl 738
Соединения общей формулы (I) обладают спазмолитической активностью.
Наиболее близким структурным аналогом соединений (I) является метилбромид простого эфира 6,11-дигидродибензо (b,е) тиепин-11-N-пропилнортропин (2), обладающий также спазмолитической активностью, Пример 4. Спазмолиз на изолированном органе (кншечннк морской свинки, в пробирке).
Часть прямой кишки умерщвленной ударом в затылок морской свннки длиной 2 см суспенднруют в ванне для органов, содержащей раствор Локе-Рингера. Температура ванны
35 С, Вызываемые спазмогеном — ацетнло холином (опыт а) или гнстамином (опыт б) сокращения продольной мускулатуры регистриl144618
Соединение сравнению с бенадри,лом с атропином
По приме10 ру
Известное
471
186
160
Составитель Т. Мамонтова
Техред З.Палий:
Редактор И. Николайчук
Корректор И. Эрдейи
Тираж 384
ВНИИПИ Государственного комитета СССР
rro делам изобретений и открытий
113035, Москва, Ж-35, Раушская иаб., д. 4/5
Заказ 955/46
Подписное
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4 руются кимографом, Стандартное спазмолитиг ческое средство (атропин в опыте а и бенадрил в опыте б) вводят в ванну эа 90 с до дачи спазмогена (превентивный метод). При этом определяют дозу атропина и бенадрила, при которой достигается 50%-ное торможение действия спазмогена (ЭД ге) . Затем тем же . образом определяют дозу ЭДчо для известного соединения (метилбромида простого эфира 6,11- дигидродибензо (Ь,е) тиепин-11 -М -пропилнортропина) и соединения примера
1 б, которую сравнивают с дозой стандарта, т.е. атропина . и бенадрила, с тем, чтобы определить процент повышения спазмолитической активности.
Результаты опытов даны в таблице.
Процентное повышение слазмолитической активностй по
Токсичность соединения по примеру 1 б и известного соединения составляет 1574 и
15 1550 мг/кг соответственно (орально; крысысамцы) .