Способ консервирования живых клеток или тканей растений
Иллюстрации
Показать всеРеферат
СПОСОБ КОНСЕРВИРОВАНИЯ ЖИВЫХ КЛЕТОК ИЛИ ТКАНЕЙ РАСТЕНИЙ , включающий их культивирование в питательной среде, внесение раствора криопротектора в емкость с клетками или тканями с образованием в ней зоны раствора криопротектора и зоны клеток или тканей , последующее глубокое замораживание с затравкой кристаллизации и хранение в криогенной жидкости, отличающийся тем, что, с целью повышения жизнеспособности клеток или тканей, затравку кристаллизации производят хладагентом, имеющим температуру в 10-13 раз ниже температуры замерзания раствора криопротектора, причем затфавку производят в зоне раствора криопротектора. (Л
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (19) (11) 4(59 А 01 N 1 02
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н АВТОРСКОМУ(СВИДЕТЕЛЬСТВУ
И&ЛИ & ;).;ь,1 пнула
-2 ф б
-2 ф
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3565401/28-13 (22) 10.03.83 (46) 15.03.85. Бюл. № 10 (72) А. С. Попов, Л. А. Волкова и P. Г. Бутенко (71) Институт физиологии растений им. К. А. Тимирязева (53) 664.8.037 (088.8) (56) 1. Jowill Z. Е., Solanum etubегоsum: а model for studying the cryobiology of
shoot-tips in the tuber-bearing Solanum
species. Plant Science Letters, ч. 20, № 4, 1981, р. 315.
2. Попов А. С. и др. Возобновление суспензионной культуры клеток женьшеня
Panax ginseng С. А. Меу после глубокого замораживания. Доклады АН СССР. т. 262, № 3, с. 765, 1982 (прототип). (54) (57) СПОСОБ КОНСЕРВИРОВАНИЯ
ЖИВЫХ КЛЕТОК ИЛИ ТКАНЕЙ РАСТЕНИЛ, включающий их культивирование в питательной среде, внесение раствора криопротектора в емкость с клетками или тканями с образованием в ней зоны раствора криопротектора и зоны клеток или тканей, последующее глубокое замораживание с затравкой кристаллизации и хранение в криогенной жидкости, отличающийся тем, что, с целью повышения жизнеспособности клеток или тканей, затравку кристаллизации производят хладагентом, имеющим температуру в 10 — 13 раз ниже температуры замерзания раствора криопротектора, причем забавку производят в зоне раствора криопротектора.
1144673 неи зоны раствора криопротектора и зоны клеток или тканей, последующее глубокое замораживание с затравкой кристаллизации и хранение в криогенной жидкости (2).
Клетки и ткани, находящиеся в питательной среде осаждают, избыток среды удаляют, а к осадку клеток добавляют криозащитный раствор. Затем их переносят в цилиндрические полиэтиленовые ампулы (наружный диаметр 10 мм, внутренний 8,6 мм, высота до пробок 24 мм, полезный объем
1 мл). Ампулы (до 30 шт. одновременно) помещают в плоскую кассету с перфорированными стенками. Если ампул немного, их помещают вертикально на одном уровне в штатив. Штатив или кассету переносят в камеру программного замораживателя и охлаждают до температуры на 1 — 2 С ниже точки замораживания раствора криопротектора. Очень быстро вынимают кассету или штатив и на 0,5 — 1,5 с погружают в жидкий азот всю кассету или дно ампул в штативе и сразу же возвращают их в камеру. После окончания замораживания ампулы переносят в жидкий азот для хранения.
1
Изобретение относится к криогенным методам консервирования и хранения живых клеток и тканей как непосредственно выделенных из организма растения, так и длительно культивируемых на искусственных питательных средах и составляющих основу биотехнологии производства ряда ценных, в частности лекарственных веществ, природное растительное сырье для получения которых уже исчерпано.
Известны способы сохранения живых 1ц клеток и тканей путем их культивирования или инкубации в природных или искусственных питательных средах, добавления криозащитных веществ, глубокого программного замораживания, хранения в жидком азоте, оттаивания и рекультивирования. В случае особо чувствительных к данной экстремальной процедуре клеток, например клеток растений, наибольшая жизнеспособность достигалась при использовании программ замораживания с затравкой (инициацией кристаллизации криозащитного раствора, в котором находятся живые клетки и ткани). Затравку обеспечивали с помощью внесения в пробирки с клетками и тканями кусочков льда (1).
Недостатками указанного способа являются необходимость стерильных условий в процессе затравки, а также сложность и трудоемкость этого процесса, если работают с большим числом ампул.
Наиболее близким к изобретению по технической сушности и достигаемому результату является способ консервирования живых клеток или тканей растений, включающий их культивирование в питательной среде, внесение раствора криопротектора в емкость с клетками или тканями с образованием в
Таким образом, при осуществлении этого способа затравка может привести к прямому повреждению части клеток слишком низкой температуры (жидкий азот — 196 С) и не получиться в некоторых ампулах, так как при погружении кассеты жидкий азот вскипает, и пузырьки смеси его паров с воздухом могут воспрепятствовать проникновению жидкости в кассету и касанию ею всех ампул без исключения.
Целью изобретения является повышение жизнеспособности клеток или тканей.
Поставленная цель достигается тем, что согласно способу консервирования живых клеток или тканей растений, включающему их культивирование в питательной среде, внесение раствора криопротектора в емкость с клетками или тканями с образованием в ней зоны раствора криопротектора и зоны клеток или тканей, глубокое замораживание с затравкой кристаллизации и хранение в криогенной жидкости, затравку кристаллизации производят,хладагентом, имеющим температуру в 10 — 13 раз ниже темпе.ратуры замерзания раствора криопротектора, причем затравку производят в зону раствора криопротектора.
Дополнительный хладагент имеет ее сверхнизкую температуру, а лишь необходимую и достаточную для затравки. Такая тем пер атура дол жна быть в 10 — 13 раз ниже точки замерзания криозащитного раствора. Этот хладагент действует строго локально, только на самую верхнюю узкую (2 — 3 мм) зону обычных ампул, где расположен мениск раствора, в то время как клетки и ткани оседают на дно ампул и даже самые верхние из них находятся не ближе
12 мм к зоне действия дополнительного хладагента. Обеспечивается это тем, что ампулы находятся в специальном штативе, представляющем собой чашку с плоским дном, причем в дне имеются отверстия, диаметр которых точно соответствует диаметру ампул. Ампулы закрывают эти отверстия плотно, так как пробки и дно штатива располагаются на 2 — 3 мм ниже мениска раствора в ампулах. В отдельных случаях, когда объекты плавают на поверхности раствора криопротектора, а не оседают в нем, ампулы могут быть вставлены в те же отверстия только своей донной частью. В этих условиях уровень мениска дополнительного хладагента, наливаемого в чашку-штатив в момент затравки, на 2 — 3 мм выше дна, и расстояние между ним и клетками сохраняется приблизительно тем же. Дополнительный хладагент представляет собой спирт, охлажденный с помощью сухого льда до рассчитанной температуры в отдельном сосуде.
Способ осуществляют следующим образом.
1144673
Таблица
Жизнеспособность (Ж) клеток диоскореи дельтовидной
Способ затравки До замораживания
После замораживания храненияоттаивания
Среднее значение
Отдельные определения
Погружение дна ампул в жидкий азот на 1,0-1,5 с
22,5
18,6
19,5
76,0
21,0
8,0
22,0
Затравка с помощью дополнительного хладагента
51,0
50,8
56,0
76,0
48,0
50 0
49,0
В данных экспериментах для замораживания использовали длительно культивируемые и ранее хранившиеся в жидком азоте клетки тропической лианы диоскореи дельтовидной. Осаждение клеток, добавление криопротектора (диметилсульфоксид ДМСО, 7%) и перенос в ампулы проводили точно так же, как в способе-прототипе. Количество клеток было таким, что они оседали на дно ампул в виде слоя, высота которого была около 1 мм. Ампулы вставляли в специальный штатив, В центр штатива вставляли контрольную ампулу, в которую вводили термодатчик программного замораживателя
ЗП 00.00.00. Конец термодатчика располагался на уровне дна штатива, горизонтально установленного в камере аппарата. Снижение температуры проводили со скоростью
0,5 С/мин и стабилизировали ее при -6 С.
Тем временем в небольшом сосуде Дьюара охлаждали спирт до -33 -38 С, так как точка замерзания питательной среды с ?%
ДМСО равна -2,82 С. Открывали крышку камеры, вливали в штатив этот спирт и закрывали крышку.
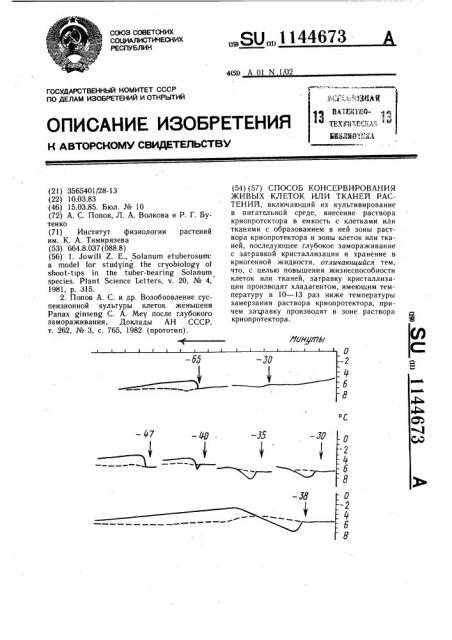
На чертеже представлены термограммы опытов.
Через 15 с температура в зоне мениска контрольной ампулы начинала снижаться (нижняя кривая) .
Пример 1. При температуре около -8 С начиналась кристаллизация в этой зоне и
4 температура в ней начинала подниматься.
Подъем температуры продолжался более
4 мин и достиг приблизительно точки замерзания. Следовательно, начальная кристаллизация проходила очень медленно, что благоприятно сказывается на жизнеспособности
Верхние кривые являются фрагментами термограмм, полученными в опытах, в которых концентрация ДМСО была 10% и точка замерзания — 4,12 С. Моменты затравок показаны стрелками, над которыми указана температура дополнительного хладагента. Только при снижении ее почти в
10 раз или ниже по сравнению с точкой замерзания появлялись типичные пики кристаллизации. При более высокой температуре дополнительный хладагент вызывал лишь кратковременное снижение температуры в зоне мениска раствора с последующим возвращением к температуре камеры (показана пунктиром в те периоды, когда после кристаллизации она не совпадала с температурой ампул).
После окончания программы замораживания ампулы хранили в жидком азоте несколько дней, быстро оттаивали и определяли жизнеспособность клеток по окраске с феносафранином.
В таблице представлена жизнеспособность (%) клеток диоскореи дельтовидной.
1144673
Составитель Е. Новикова
Техред И. Верес Корректор Н. Король
Тираж 743 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж вЂ” 35, Раушская наб., д. 4/5
Филиал ППП «Патент», г. Ужгород, ул. Проектная, 4
Редактор Н. Швыдкая
Заказ 1002/2
Пример 2. Длительно культивируемые клетки наперстянки Digitalis lanata специально подготавливали к глубокому замораживанию, для чего при очередном их пересеве добавляли в питательную среду осмотически активное вещество — маннит в кон5 центрации 3 /о. Для клеток наперстянки такая подготовка обязательна для успеха глубокого замораживания, так как после нее большинство клеток имеет сравнительно небольшие размеры и меньшую вакуолизацию, !О что благоприятствует их выживанию. Клетки осаждали как в способе-прототипе, и добавляли криопротектор: смесь глицерина и сахарозы до конечной концентрации 10о/о каждого из этих веществ. Остальные операции проводили точно так же, как в примере 1, но с учетом другой точки замерзания раствора криопротектора (-3,4 С) и, следовательно, температура дополнительного хладагента должна быть не выше -34 C. На этих клетках был испытан весь диапазон скоростей охлаждения, обеспечиваемый аппаратом ЗП.00.00.00 от 0,5 до 75 С/мин.
Эти результаты показали, что наилучшей для клеток растений является скорость 0,5 С/мин.
Пример 3. Использовали длительно культивируемые клетки женьшеня Panax ginseng.
При этом в случае исходного штамма ИФР
5K 1 можно обойтись без специальной подготовки клеток и применить тот же криопротектор, как и для клеток наперстянки.
В случае же мутантных штаммов ИФР Ж 2 и ИФР Ж 3, которые менее устойчивы к глубокому замораживанию, необходимо специальное предварительное культивирование в течение 3 недель при пониженных темпе- 35 ратурах (первая неделя при 8 — 10 С, затем при 2 С) и при еженедельном увеличении концентрации сахарозы в питательной среде: сначала до 10, потом до 15 и до 205/о.
Затем клетки осаждали как в способе-прототипе и добавляли криопротектор, равный объем 40о/о-ного раствора сахарозы. Конечная концентрация сахарозы составила 30о/р, точка замерзания -2,4 С и температура дополнительного хладагента должна быть не выше -24 С. Для клеток женьшеня, предварительно подготовленных, хорошие результаты дает и другой криопротектор: смесь диметилсульфоксида и сахарозы, конечные концентрации которых 10 и 30% соответственно. Точка замерзания -5,9 С и температура дополнительного хладагента должна быть около -60 С. Остальные операции проводят, как в примере 1.
Таким образом возможные отличия в проведении предлагаемого способа зависят от конкретных живых клеток или тканей, подлежащих криосохранению, и не касаются способа проведения затравки кристаллизации в процессе охлаждения.
Согласно полученным данным, предлагаемый способ позволяет увеличить уровень жизнеспособности клеток по сравнению со способом-прототипом, а также гарантирует затравку всех ампул и ликвидирует возможность повреждения клеток и тканей в момент затравки сверхнизкой температурой хладагента и быстрорастущими кристаллами льда. Предлагаемым способом облегчается работа на программном замораживателе, не способ можно использовать и без этого аппарата: в таких случаях применяют поэтапное замораживание с помощью нескольких холодовых шкафов или смесей, имеющих различные отрицательные температуры и обеспечивающих охлаждение до — (40-70) С с непостоянной скоростью. Такое охлаждение дает худшие результаты, но позволяет обойтись простыми приспособлениями.