Способ получения 1- @ -3- @ -5-нитропиразоло @ 3,4- @ пиридинов
Иллюстрации
Показать всеРеферат
1. СПОСОБ ПОЛУЧЕНИЯ 1-R-3-R-5-НИТРрПИРАЗОЛО ГЗ,4-ЬЗпИРИДИНОВ формулы R .,.N02 а)R R-H; где б)R - Н, R-CHji в)R - Н, R-CgHy, г)R - CHj, R - Н; R - Hi д) R CfcHy , R Rе ) CH CH ж)R , Rз )R CfcHf, отличающийся тем, что, c .целью увеличения вькода и расширения ассортимента целевых продуктов , соответствукнцие аминопиразолы подвергают взаимодействию с натриевой солью нитромалонового альдегида в воде или в апротонном органическом растворителе при 20-100 С. 2, Способ по п. 1, о т л и ч а /) щ и и с я тем, что в качестве апротонного органического растворителя используют диметилсульфоксид или ди- ir метилформамид.
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУбЛИН (19) ((() w(st> С 07 D 471104
ГОСУДАРСТ8ЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОбРЕТЕНИЙ И ОТНРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ABTOPCHOMY СВИДЕТЕЛЬСТВУ г;, д (21) Зб05бЗЗ/23-04 (22) 13.0б.83 (4б) 30.03.85. Бюл. У 12 (72) А.Ю. Петров, В.Л. Русинов и О.Н. Чупахин (71) Уральский ордена Трудового
Красного Знамени политехнический институт им. С.N.Êèðîâà (53) 547.779.1.07(088.8) (5б) 1. Кост А.Н., Сагитуллин P.Ñ.
Данагулян Г.Г. Изомеризация пиразо" ло (1,2-а)пиримидинов. Химия гетероциклических соединений, 1977, 4, с. 558-559 (прототип). (54)(57) 1. СПОСОБ ПОЛУЧЕНИЯ 1-К-3-R -5-НИТРОПИРАЗОЛО ГЗ, 4-Ъ)ПИРРЩИНОВ формулы Я, 4о, н.
N н
I где а) R = R -Н, 6) R - Н, R -СН, в) R — H, R -С,й,, СН3 д) К - С Н, к - Н е) R= R — СН ж) R — C Í, R — СН з) R = R - С Н5, отличающийся тем, что, с целью увеличения выхода и расширения ассортимента целевых продуктов, соответствующие аминопиразолы подвергают взаимодействию с натриевой солью нитромалонового альдегида в воде или в апротонном органическом растворителе при 20-100 С.
2. Способ.по п. 1, о т л и ч а юшийся тем, что в качестве апротонного органического растворителя используют диметилсульфоксид или ди° метилформамид.
1147712 динов формулы
1О
Изобретение относится к усовершенствованному способу получения химических соединений, а именно
1-R-3-R -5-нитропиразоло(3,4-Ъ)пиригде, 1а R=,R =Н, 1б R=H, R =CH>, fs R=H, R =С Н, Ir R=CH>, R =Н;
1д R=CgHg, R =Н; fe R=CH, R =СН; 15
1ж К=С Н, R =СН3,. 1з R=R =CIH, которые могут найти примененйе каК полупродукты органического синтеза и биологически активные вещества.
Известен способ получения 5-нитро-2О
-1Н-пиразоло(3,4-Ь) -пиридина. Синтез его осуществлен рециклизацией 6-нитропиразоло(1,5-а)пиримидина (11), которая осуществляется при кипяченйи соединения 11 в 15Х-ном водно- 25 спиртовом, растворе KOH в течение
4 ч с выходом 37Х $1).
Недостатками известного способа являются невысокий выход целевого продукта, ограниченная применимость 3О способа, так как он не позволяет йолучить 1-замещенные 5-нитропиразоло(3,4-Ъ)-йиридины.
Цель изобретения — повышение выхода и расширение ассортимента це- 35 левых продуктов.
Поставленная цель достигается тем, что согласно. способу получения
1-R-3-R -5-нитропиразоло (3,4-Ь)пиридинов, соответствующие 1-R-3-R - 5-аминопиразолы подвергают взаимодействию с натриевой солью нитромалонового альдегида в воде или в апротонном органическом растворителе при 20-100 С. Выход целевых продук- я5 тов составляет 60-80 .
В качестве апротонного органического растворителя используют, например, диметилсульфоксид или диметилформамид.
При уменьшении температуры реакции ниже 20 С уменьшается выход соединений (1а-з). Увеличение температуры реакции до 120-130 С приводит к осмолению реакционной массы, что тоже снижает выход получаемых соединений.
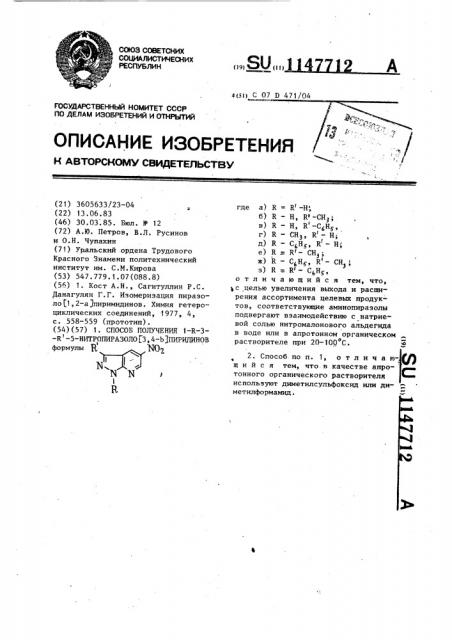
В табл. 1 показаны спектральные характеристики 1-R-3-R -5-нитропиразоло(3,4-Ъ)пиридинов.
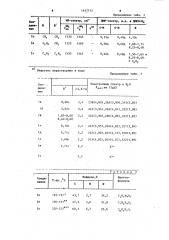
В табл. 2 приведена характеристика полученных соединений.
В ИК спектрах соединений (1 а-з) имеются характеристичные полосы поглощения, соответствующие колебаниям нитрогруппы в области 1530-1535 и
l340-1350 см "(табл. 1) и NH-группы (1 а-в) при 3100-3200 см . В IIMP спектрах наблюдаются характерные дублеты мета-расположенных пиридиновых протонов с константой 2,2 Гц, спектр соединения (f а) соответствует описанному в литературе (прототип). Сравнение электронных спектров полученных соединений (1 а-в) с (1 г,д) подтверждает существование первых в iH-форме (табл. 1).
Пример 1. 1-R-3-R -5-нитро-, пиразоло(3,4-Ь1пиридины (T r-з).
Растворяют O,OI моль 1-R-3-R -5I
-аминопиразола в 30-40 мл воды и при," ливают при перемешивании раствор
1,6 r (0,01 моль) натриевой соли
iнитромалонового альдегида в 10 мл воды. Нагревают при 90-100 С 5 мин, охлаждают, подкисляют уксусной кислотой и отфильтровывают выпавший осадок. Кристаллизуют из подходящего растворителя (табл. 2).
Пример 2. 1-Метил-5-нитропиразоло(3,4-Ь1пиридин (f г).Растворяют 0,95 r (0,01 моль) 1-метил-5-аминопиразола в 30 мл воды и при перемешивании добавляют раствор
1,6 г (0,01 моль) натриевой соли итрьмалонового альдегида в 10 мл воды и перемешивают при 20 С в тече" ние суток. Подкисляют 2 н соляной кислотой и отфильтровывают образовавшийся осадок. Выход: 1, 1 г (60X).
Т.пл. 133-135 С (из этанола). Вещество идентично получаемому по паимеру
Пример 3. 1-Фенил-3-метил-5-нитропиразоло (3,4-Ь)пир щин (f ж), растворяют 1, 73 r (0,01 моль) 1-фенил-3-метил-5-аминониразола в 10мл ДМФА (ДМСО) и добавляют 1,6 г (0,01моль) натриевой соли нитромалонового альдегида. Перемешивают при комнатной температуре в течение суток, прибавляют 1 мл уксусной кислоты и смесь вносят в,100 мл воды. Образовавшийся осадок отфильтровывают и кристаллиТаблица 1
ИК-спектр, см
СоединеI ние
НО МО аз
4-Н
6-Н
ia Н
Тб Н
Ia Н
Н 1540 1350 3240 940
9, 65д
9,45д
9,40д
Снз 1540 1346 3180 9, 34д
С Н 1545 1350 3100 9,30д
3 д С Н» H
1530 1350 — 9,40д 9. 51д 4, 15с
1350 — 9, 34д 9,46д 7,60-7,75
8,10-8,30
15 5
3 11477 эуют из этанола. Выход 2,0 г (807) .
Вещество идентично полученному по методу 1 (пример 1).
Пример 4. 1.3-Дифенил-5-нитропиразоло 3;4-Ь3пиридин (1 з).
Смесь 2,35 г (0,01 моль) 1,3-дифенил-5-аминопираэола и 1,6 г
1 (0,01 моль) натриевой соли нитромалонового альдегида нагревают 5 мин при 80-90 С в 20 мл ДИФА (ДИСО), выливают в холодную воду (1ЬО мл) и подкисляют разбавленной соляной кислотой до рН 1-2. Выпавший осадок перекристаллизовывают из уксусной кислоты. Выход 2,5 г (807). Вещество идентично полученному по примеру
Пример 5. З-К вЂ” 5-нитропиразоло (3,4-Ъ)пиридин (1 а-в) . Смесь
t,6 г (0,01 моль) натриевой соли нитромалонового альдегида и 0,01 моль
3-амино-5-R -пиразола в 40 мл воды кипятят 5 мин, охлаждают, подкисля т уксусной кислотой и образовавшийся осадок отфильтровывают. Кристалли- 25 зуют из подходящего растворителя (табл. 2).
Пример 6. 3-R -5-нитропираэоло(3,4-Ъ)пиридины (1 а, б).
Смесь 1,6 r (0,01 моль) натриевой соли нитромалонового альдегида и
0,01 моль 3-R-5-аминопиразола в
40 мл воды перемешивают при комнатной температуре 24 ч, подкисляют разбавленной соляной кислотой и отфильтровывают осадок. Выход (T а)
60X, (I б) — 70%.
Пример 7. 3-Фенил-5-нитропиразоло (4,3-Ь)пиридин (I в). Смесь
1,6 г (0,01 моль) натриевой соли
12 4 нитромалонового альдегида и 1,58 г (0,01 моль) 3-амино-5-фенил-пираэола в 20 мл ДИФА (ДИСО) нагревают при
80-100 С 20 мин,охлаждают, подкисляют уксусной кислотой и выпивают в 100 мл холодной воды. Образовавшийся осадок отфильтровают, Выход 1,8 r {757). Т. пл. 220-222 С (из смеси ДИФА-вода 1: 1).
Пример 8. 1-Иетил-5-нитропиразоло 3,4-Ь1пиридин (1 г). Растворяют 0,95 r (0,01 моль) 1-метил-5-аминопираэола в 20 мл ДИФА и при перемешивании охлаждают до 5-10 С
I приливают охлажденный до этой температуры раствор 1,6 г (0,01 моль) натриевой соли нитромалонового альдегида в 10 мл воды. Выдерживают при 5-10 С 8 ч, разбавляют реакционную массу 100 мл ледяной воды, подкисляют разбавленной НС1 и отфильтровывают выпавший осадок 1-метил-5-нитропираэоло(3,4-Ь)пиридина (1 г). Выход: 0,7 r (40Х). Т.пл.
133-135 С.
Пример 9. 1-Фенил-3-ме ил-5-нитропираэоло 3,4-b) пиридин (1ж), Растворяют 1, 73 г (О, 01 моль) 1-,фенил-3-метил-5-аминопираэола в 20 мл
ДИСО, нагревают до 120 C и приливают раствор 1,6 r (0,01 моль) натриевой соли нитромалонового альдегида в воде. Перемешивают при
120-130 С 6 ч и выливают в 100 мл холодной воды. Выпадает смола, которую отделяют и затирают со спиртом. Выход 1-фенил-3-метил-5-нитропираэоло-(3,4-ЬЗпиридина (f ж)
0,8 r (317). Т.пл. 181-183 С (иэ этанола).
ПИР-спектр, м.д. в ДИСО-D<
1147712
Продолжение табл. 1
F Ю
4 а R
ИК-спектр сми ПИР-спектр, м.д. в ДМСО-Р
6-Н
СН> 1530 1345 — 9,35д
9, 49д 4, 10с
СН 1525 1340
9,50д
С,Н
9,60д 7,60-7 75
8,25-8,40.
CeHs CeHs
1530 1345
9,49д 7,50-7,65 и
8,25-8,40, 2 С К
9, 32д н)
Вещество нерастворимо в воде
Продолжение табл. 1
Электронный спектр в Н2 0
3„„,» нм (1 Я)
34,6 Гц
Сое- .. динение
2, 4 238 (4, 00), 263 (3, 99), 313 (3, 83)
2,4 243(3,94),265(4,01),322(3,86)
2,4 242(3,90),266(4,09),322(3,85) ю
lа
8,60с
2,62с
7,85-8,00
8,40-8,60
2, 2 243 (3, 95),264(4,02), 321 (3,84) 1г
2, 2 242 (4,00), 265 (4, 10), 320(3; 80) 1д
lе
2,2 243(4,02),265(4,07),322(3,89) х)—
2,2 х)—
2,2
Таблица 2
Найдено,Ж
Бруттоформула
Соед - Т ФС венке
N.М»
195 — 19? 43, 7 2, 7
190-193 47 3 3,6
2?0-2?2 60,1 3,7
34,2
31,8
23,6
)в
8, 10с
8,77с
2,60с
2,71с
С,Н„Х,О, 7 4 4 2.
С Н,И,,И) 114771 2
Продолжение табл. 2
Найдено,Ж
1 1
Бруттоформула
Т. IlJI., С
Соединение
С Н И
2г
133-135 + 47, О
2,8
31,3
175-177
23,0
60i 2
3,1
4,0
29,5
2е
5;0 22,1
40 179
2з Продолжение табл.2
Вычислено,X
Выход
Соед нени т г J 7.
43,9
2,4
34,1
1,05
1а
47,2
1,30
3,4
31,4
lб
1,45
3,3
23,3
60,0
1в
1,20
31,5
47,2
3,3
3,3
1,80
23,3
60,0
1д
1,35
29,2
4,2
50 0
1е
1,90
22,0
61,4
4,7
1ж
1з
68,4
2,60
17,7
3,8. 3ф ф из водьЦя из этанола; из смеси ДЕФА-вода 1:1; из уксусной кислоты
Корректор В. Бутяга
Подписное
137-139 " 50, 1
181-183" 61, 6
223-225 .68,5
Составитель Т. Мамонтова
Редактор Л. Авраменко Техред Л.Мартяшова
Заказ 1492/23 Тираж 384
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4
С Н И Ог
С Н,Н,Ог
С, Нэ М40г
С Н,Р,О,,СНБО