Производные 2-(3-метил-2-бутенил)-циклопентанона в качестве полупродуктов в синтезе простагландинов
Иллюстрации
Показать всеРеферат
Производные 2-
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК (193 (11) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ASTOPCKOMV СВИДЕТЕЛЬСТВУ
Я 3
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3655328/23-04 (22) 09.09.83 (46) 28.02.87. Бюл. В 8 (71) Институт биоорганической химии
АН БССР и Белорусский государственный университет им. В.И.Ленина (72) А.А.Ахрем, Ф.А.Лахэич, Л.Г.Лис, Т.В.Янкова, О.Г.Кулинкович, И.Г.Тищенко и Н.В.Иасалов (53} 547.514.71(088.8) (56) А.Barco, S.Benetti, С.Pollini, P.Baraldi u.a. Elaboration of the
И-chain of П-deoxyprostanoid derivatives throunf. isoxazole intermediates — I. Огр. Chem., ч. 46, 1981, р. 4518-4524.
L.Novak, С;Ваап, I.Narosfalvi, Cs. Szantay, Application of. carbonyl umpolung to prostaglandin sinthesis. III. Synthesis of 11-deoxyргозйа81апйхп synthons — Chem. Her.
v. 113, р. 2939-2949, 1980.
А.Khusid, G.Krystal, U.Kucheiov, L.Yanovskaya. А simple syntesis
of. gem-dichlorocycloprcpyl — and
cyclopropylmethanol. Sinthesis, 1977, р. 428-430.
С.Hurd, М.Pollack, The rearrangement of vinyl allyl ethers.
I. Amer. СЬев, Soc., 60, 1938, р. 1905-1911. (59 4 С 0 7 С l 7 7 / 00 э 49 / 39 5 э 7 9 / 36 (54) ПРОИЗВОДНЫЕ 2- (3-ИЕТИЛ-2-БУ1ТЕНИЛ) -ЦИКЛОПЕНТАНОНА В КАЧЕСТВЕ ПОЛУПРОДУКТОВ В СИНТЕЗЕ ПРОСТАГЛАНДИН0В (57) Производные 2-(3-метил-2-бутенил)-циклопентанона обвей дормулы где R< и R образуют двойную связь или К,-Н, К -СН НО, в качестве полупродуктов в синтезе простагландинов, 1154896
OR, с- "4
° °
О
Г 1 >s>os - о о 4 с — — - .. ф 5 и
60 76 3 Щв,У1 еР
ОН
Оз О, Юа ЮО н
70%
96%
ОН со,н
СН3
СО Н
ОН
/Х
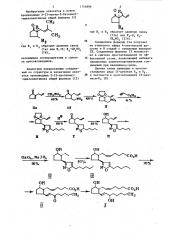
Изобретение относится к новым производным 2-(3-метил-2-бутенил)-циклопентанона общей формулы (I) I ° где R и К образуют двоиную связь (1а) или К,-Н," К -СН 120 (? б), являющимся полупродуктами в синтезе.простагландинов.
Аналогами предлагаемых соедине ний по структуре и назначению являются производные 2-(2-пропенил)-циклопентанона общей формулы (Т1) и R образуют двойную связь (IIa) или R>-H; К вЂ”
СНБО, (II6).
Соединение формулы. IIa получают из этилового эфира 4-пентеновой ки-, слоты в 8 стадий с суммарным выходом
2Х. Соединения формулы II использу.ют в синтезе простагландинов по эффективной сх ме, позволяющей избежать применение элементоорганических соединений при введении Q-цепи.
Данная схема приводит к простагландинам ряда II-дезокси Р и Р .
20 в частности к простагландину II-дезoKcH F g (X) 1154896
О СК О СН, СН Суйп
Мбг МЪ
О СЯ
ОК
НЗ
СН мдв.
НЗ
СН ONa сн
3 90%
7Г%
Е АЗБ СН
СН3 69 %
СН3
Н3
Использование аналогов как полупродуктов в описанной схеме приводит к недостаточно высоким выходам на стадиях присоединения нитраметана (60Х) и присоединения гептина (41X) что снижает выход целевого продукта.
Целью изобретения является изыскание новых полупродуктов, позволяюСхема приводит к попучению 5g-ок- 30 си-2Р-(5-пентилизоксазолил-3)-циклопентан-1М-ацетальдегида (VII), переход от которого к целевому простагландину известен. Предлагаемое соединение формулы la позволяет повысить выход на. стадии присоединения ннтрометана до 88Х и на стадии присоединения гептина к окиси нитрила, генерируемой из соединения I6, до 70Х. 40
Способ получения соединения формулы Za заключается в том, что хлорангидрид гем-дихлорциклопропанкарбоновой кислоты (XIII) обрабатывают . 4 юих повысить выход целевого простагландина.
Предлагаются новые производные
2-(3-метил-2-бутенил)-циклопентанона общей формулы 1 в качестве полупродуктов в синтезе простагландинов.
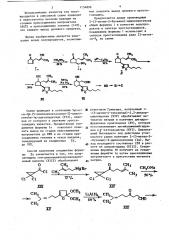
Соединения формулы 1 используют в синтезе простагландина ряда II-дезокси-F по схеме и реактивом Гриньяра, полученный !-(5-метил-4-гексеноил)-2,2-дихлорциклопропан (XIV) обрабатывают метилатом натрия и получают дигидрофурановое производное (XV), которое восстанавливают литийалюминийгидридом в g -кетоальдегид (XVI). Циклизацией последнего под действием углекислого калия получают 2-(3-метил-2-
-бутенил)-2-циклопентенон (Ia). Выход последнего составляет 25Х в расчете на хлорангидрид (XIII). Соединение формулы f6 получают из соединения формулы 1а путем присоединения ннтрометан-а в присутствии метилата натрия.
1154896
СН,Ю0, 3
88%
СН2 2
Исходный хлорангидрид reM-дихлор циклопропанкарбоновой кислоты получают из диаллилацеталя уксусного альдегида в 4 стадии с выходом 61Х.
Диаллипацеталь уксусного альдегида, в свою очередь, получают из аллило- вого спирта в одну стадию с выходом
68Х. Таким образом, переход от аллилового спирта к соединению 1а осуществляется в 9 стадий с суммарным выходом llX.
Пример 1. Получение 2-(3-метил-2-бутенип)-2-циклопентенона (Ia)
К охлажденному до -80 С раствору о реактива Гриньяра, полученному из
3,12 г (0,13 г-атом) М8 и 19,56 г (0,122 моль) 5-бром-2-метилпентена-2 в 170 мл абсолютного тетрагидрофурана, добавляют по каплям при перемешивании раствор 17,35 r (0,1 моль) хлорангидрида гем-дихлорциклопропанкарбоновой кислоты (XIII) в 30 мл абсолютного тетрагидрофурана с такой скоростью, чтобы температура не поднималась выше -75 С. После перемешивания при этой температуре в течение
30 мин реакционную смесь оставляют нагреваться до комнатной температуры, затем добавляют 100 мл насыщенного раствора хлористого аммония.
Тетрагидрофуран упаривают в вакууме, остаток зкстрагируют эфиром (3"50 мп) эфирные экстракты промывают раствором сьды и сушат сульфатом натрия.
После удаления растворителя остаток перегоняют. Получают 15,91 r (72X)
1-(5-метил-4-гексеноил)-2,2-дихлорциклопропана (XIV) т.кип. 104105 С/2 мм рт.ст, n>=1,4925.
Найдено, X: С 54,54, Н 6,14 1
С Н,С1
Вычислено, Х: С 54,29, Н 6,33.
К охлажденному до 10 С раствору метилата натрия в метаноле, полученному при растворении 5,06 r (0,22 гатом) Na в 150 мл метанола, добавляют по каплям при перемешивании раствор 22,1 г (0,1 моль) 1-(5. -метил-4-гексеноил)-2,2-дихлорциклопропана (XIV) в 50 мл метанола с такой скоростью, чтобы температура раствора была 10-15 С, Реакционную массу перемешивают при комнатной
15 температуре в течение 15 мин, разбавляют 200 мл воды и экстрагируют гексаном (3 100 мл). Экстракты сушат сульфатом натрия, растворитель удаляют в вакууме и остаток перего20 няют, Получают 19,08 г (90X) 5-(4-метил-З-пентенил)-2,2-диметокси-2,3-дигидрофурана (XV), т.кип. 9597 С/2 мч рт.ст., n =1,4617, 25 Найдено, Х: С 67,75; Н 10,07, С НО, Вычислено, Х: С 67„92, Н 9,91.
К суспензии 0,95 .r (0,025 моль) литийалюминийгидрида в 40 мл абсоЗ0 лютного диоксана добавляют раствор
10,6 r (0,05 моль) 5-(4-метил-3-пен тенип)-2,2-диметокси-2,3-дигидрофурана (XV) в 10 мл абсолютного диоксана. Смесь кипятят при перемешивании в течение 15 мин, затем охлаждают, добавляют по каплям раствор 6 мл ацетона в 50 мл абсолютного эфира.
Реакционную массу разлагают добавлением 50 мл 10Х-ной НС1 .с перемешива40 нием при комнатной температуре в течение 30 мин. Органический слой отделяют, водный слой экстрагируют эфиром (3 . 50 мл). Объединенные органические экстракты сушат сульфатом нат45 рия, растворитель удаляют в вакууме, остаток перегоняют. Получают 5,8 r (69Х) 8-метил-7-нонен-4-он-1-аля (ХЧт), т.кип. 97-100 С/3 мм рт.ст. и =1,4647.
Найдено, Х: С 71,65 Н 9,39
С, Н, О
Вычислено, Х: С 71,43, Н 9 52.
Раствор 5,04 г (0,03 моль) 8-метил-7-нонен-4-он-I-аля в 60 мл метанола добавляют IIo KBIIJIIIM TlpH перемешивании к кипяшей смеси 60 мл
5Х-ной К СО> и 120 ил метанола в течение l ч. Реакционную смесь кипятят
1,5 ч, охлаждают, прибавляют к ней
1154896 разбавленную НС1 до кислой среды и экстрагируют эфиром. Растворитель удаляют в вакууме, остаток разбавляют эфиром, оставшуюся воду отделяют и дополнительно экстрагируют эфиром.
Объединенные эфирные экстракты сушат сульфатом натрия, растворитель удаляют в вакууме, остаток перегоняют. Получают 2,57 r (57X) 2-(3-метил-2-бутенил)-2-ииклопентенона f0 (la), т.кип. 78-80 С/2 мм рт.ст., и",=1,4895.
Найдено, Ж: С 80,23, Н 9,45, С„,Н„О .Вычислено, Ж: С 80 00 Н 9,33.
Пример.2. Получение 2-(3-метил-2-бутенил)-3-нитрометилциклопентанона (?б).
К раствору 1,05 г (0,007 моль)
2-(3-метил-2-бутенил)-2-циклопента- 20 нона (Та) в 10 мл абсолютного метанола добавляют по каплям при перемешивании раствор метилата натрия, полученного из 0,22 г (0,0096 г-атом)
Иа в 20 мл метанола, Затем добавляют раствор 0,61 r (0,1 моль) нит- рометана в 10 мп абсолютного метанола. Реакционную смесь перемешивают в течение 3 ч, добавляют 3 r cyхого хлористого аммония, осадок от- 30 фильтровывают. Растворитель удаляют в вакууме, остаток хроматографируют на колонке с 30 г силикагеля (Chemapol 40/100). Элюирование про-. водят смесью эфир-гексан переменно- 35 го состава. Получают 1,3 r (88X)
2-(3-метил-2-бутенил)-3-нитрометилциклопентанона (Тб). ИК-спектр, см (пленка): 1550, 1735.
С„Н NO>. Вычислено: мол.вес., 40
211, 26.
Масс-спектр: N =211.
ПМР-спектр (СЭС1, ): 1,61 (СН, с, ЗН); 1,69 (СН, с, 3Н);
4,52 (СНБИО, м, 2Н); 5,0 (СН=(, м, 1Н). 45
Далее из соединения формулы lб пЬлучают соединение VII которое по .спектральным характеристикам идентично соединению VII, получаемому на основе аналогов.
Пример 3. Получение 5Ж-окси-2Р-(5-пентилизоксазолил-3)-циклопентан-1Ы,-ацетальдегида (VII).
К смеси 0,633 r (О ° 003 моль)
2-(3-метил-2-бутенил)-3-нитрометилциклопентанона; 0,864 г (0,009моль) гептина-1 (Хб) и 1,071 r (0,009 моль) фенилизоцианата в
20 мл абсолютного бензола добавляют 5 капель триэтиламина (до помутнения раствора). Реакционную смесь перемешивают 2 сут, осадок отфильтровывают, растворитель упаривают.
Остаток хроматографируют последовательно на колонке с Alz0> (Reanal) элюэнт .— смесь эфир-гексан переменного состава, затем хроматографируют на колонке с силикагелем (Chemaро1 40/100), элюент — смесь эфиргексан переменного состава. Получают 0,605 г (69X}.2-(3-метил-2-бутеннл) -3-(5-пентилизоксазолил-3)-циклопентанона (XI).
ИК-спектр, 4., см (пленка): 1540.
1600, 1745.
C H N0 . Вычислено: мол.вес.
289,43.
Масс-спектр: М =289.
ПМР-спектр (CDClq Р ): 0,86 (СН„ м, ЗН); 1,50 (СН „ с, ЗН); ,1,57 (СН, с, ЗН); 4,92 (СНС(, м, lH) 5,81 (СН=С (, с, 1H) . К суспензии 0,82 (0,00322 моль) LiAlH (О-t-Bu) 3 в 15 мл тетрагидрофурао на при 0 С прибавляют по каплям при перемешивании раствор 0,467 г (0,00161 моль) 2-.(3-метил-2-бутенил)-3-(5-пентилизоксаэолил-3)-циклопентанона (XI) в 5 мл тетрагидрофурана.
Перемешивание продолжают при 0 С в течение 1 ч, реакционную смесь выпивают в 50 мп воды, подкисляют !
ОХ-ной соляной кислотой до рН 2, экстрагируют эфиром. Экстракты сушат над сульфатом магния, растворитель упаривают в вакууме, остаток хроматографируют в колонке с силикагелем (Chemapol 40/100). Элюент - смесь эфир-гексан переменного состава.. Получают 0,444 г (94X) 2-(3-метил-2-бутенил)-3-(5-пентилизоксазолил-3)-циклопентанола. ИК-спектр, 1 см (пленка): 1595, 3400.
С,ВН NO . Вычислено: мол..вес.
291,43.
Масс-спектр: М+=291.
ПМР-спектр (CDC1>, 3 ): 0,86 (СНз, .т, ЗН); 1,56 (СНз, с, 3H);
1Н); 5,86 (CH, с, 1Н) .
К раствору 0,233 г (0,0008 моль)
2-(3-метил-2-бутенип)-3-(5-.пентилизоксазолил-3)-циклопентанола (XII) в
l0,4 мл диоксана и 3,36 мп воды добавляют маленький кристалл Os04, 1154896
IlMP-спектр (CDClg 5 ): 0,9 (CHy т, ЗН); 5,8 (СН= (, с, 1H) 9,76 (СНО, т, 1Н) .
Редактор З.Бородкина Техред Л.Олейник Корректор В.Бутяга
Заказ 404/3
Тираж 372 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений н открытий
113035, Москва, Ж-35, Раушская наб., д..4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
Реакционную смесь перемешивают в токе аргона до образования коричневой окраски, затем добавляют 0,442 r (0,00197 моль) метаперйодата натрия.
Перемешивают в течение ночи, осадок отфильтровывают,. растворитель удаляют в вакууме, остаток экстрагируют эфиром, пропускают через небольшой слой селикагеля (Chemapol 40/100), растворитель удаляют в вакууме. Получают 0,180 г (85X) 5 -i-окси-2 3-(5-йентилизоксазолил-3)-циюлопентан-1е .-ацетальдегида (VII).
ИК-спектр, 1, см (пленка): 1595, 1720, 3400.
5 Преиущество предлагае соединений заключается в том, что их использование в синтезе простагландина ряда 11-дезокси-F< (Х) позволяет повысить выход на стадии присоединения нитрометана до 887 и на стадии присоединения гептина до 70Х. Выходы на указанных стадиях при использовании соединений-аналогов составляют 60 и
41 соответственно.