Способ получения производных 4-прегнена или смеси их стереоизомеров или 22-эпимеров
Иллюстрации
Показать всеРеферат
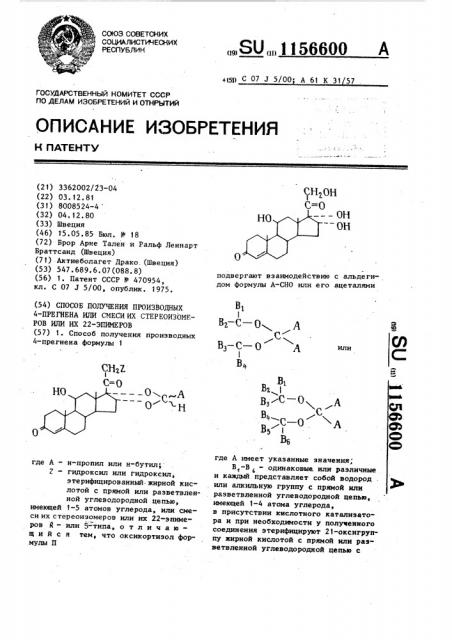
1. Способ получения производных 4-прегнена формулы 1 подвергают взаимодействию с альдегидом формулы А-СНО или его ацеталями Вг-С-Ох. А , О) БЗ-С-О А или В B.J Вз/С-0. А CFI R Од А О) где А - н-пропил или н-бутил; Z - гидроксил или гидроксил, этерифицированныйжирной кислотой с прямой или разветвленной углеводородной цепью, имеющей 1-5 атомов углерода, или смеси их с тереоизомеров или их 22-эпимеров а. - или 5-типа, отличающийся тем, что оксикортизол формулы И где А имеет указанные значения; - одинаковые или различные и каждый представляет собой водород или алкильную группу с прямой или разветвленной углеводородной цепью, имеющей 1-4 атома углерода, в присутствии кислотного катализатора и при необходимости у полученного соединения этерифицируют 21-оксигруппу жирной кислотой с прямой или разветвленной углеводородной цепью с
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ (:,H>OH
С=Π— — ОН
ОН
0 или
СНгХ
С=0
0 SCCA
0" -я
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3362002/23-04 (22) 03. 12. 81 (31) 8008524-4 (32) 04. 12,80 (33) Швеция (46) 1 5.05.85 Бюл. У 18 (72) Брор Арне Талек и Ральф Леннарт
Браттсанд (Швеция) (71) Актиеболагет Драко.(Швеция) (53) 547.689.6.07(088.8) (56) 1. Патент СССР Р 470954, кл. С 07 J 5/00, опублик. 1975. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
4-ПРЕГНЕНА ИЛИ СМЕСИ ИХ СТЕРЕОИЗОИЕРОВ ИЛИ ИХ 22-ЭПИМЕРОВ (57) 1. Способ получения производных
4-прегнена формулы 1 где А " н-пропил или н-бутил;
Z - гидроксил или гидроксил, этерифицированный-жирной кислотой с прямой или разветвленной углеводородной цепью, имеющей 1-5 атомов углерода, или смеси их стереоизомеров или нх 22-эпимеров Я вЂ” или 5-типа, о т л и ч а юшийся тем, что оксикортиэол формулы 11
„„SU ÄÄ 1156600 А
+(51) С 07 1 5/00; А 61 К 31 57 подвергают взаимодействию с альдеги дом формулы А-СНО или его ацеталями
Â1
Вгc — О Я с
 — С вЂ” 0 Л
1 в„ где А имеет указанные значения;
В„-В < — одинаковые нли различные и каждый представляет собой водород . или алкильную группу с прямой или разветвленной углеводородной цепью, имеющей 1-4 атома углерода, в присутствии кислотного катализатора и при необходимости у полученного соединения этерифицируют 21-оксигруп у жирной кислотой с прямой или разветвленной углеводородной цепью с
1-5 атомами углерода, а при необходимости целевые соединения подвергают до или после этерифицирования хроматографии на поперечно связанном декстрановом геле с использованием органического растворителя в качестве элюента.
2. Способ по п. 1, о т л и ч а юшийся тем, что в качестве поперечно связанного декстранового геля используют оксипропилированный декстра— новый гель в форме шариков,в котором декстрановые цепи связаны поперечно и создают трехмерный полисахаридный каркас, а в качестве органического растворителя — смесь н-гептана, хлороформа и этанола в соотношении 0,5:(50-100):
: (10-1) .
Z — - свободная или этерифицированная гидроксильная группа;
R — алкил С2-С, обладающие местным противовоспалительным действием Pt).
Соединения общей формулы 1а получают путем взаимодействия соответствующего 1бй, 17 -диола с альдегидом формулы О=С,„, где R имеет указанные значения, в присутствии кисло го катализатора, например хлорной кислоты в среде диоксана, образовавшееся ацетальное производное формулы
1а подвергают очистке путем гель-, фильтрации на поперечно связанных декстрановых гелях, например оксипропилированных f 1).
Цель изобретения — получение новых стероидных соединений, обладающих улучшенными фрамакологическими свойствами.
Цель достигается согласно способу получения производных 4-прегнена общей формулы $ или смеси их стереоиэомеров или их 22-эпимеров, основанному на известном методе l13 и заключающемуся в том, что оксикортизол формулы П
Изобретение относится к способу получения новых производных 4-прегнеиа формулы 1 снz
С=О с""
О где А — н-пропил или н-бутил; гидроксил или гидроксил, этерифицированный жирной кислотой с прямой или разветвленной углеводородной цепью, имеющей 1-5 атомов углерода, или смеси их стереоизомеров или их 22-эпнмеров g — или S-типа, обладающих ценными фармакологическими свойствами — высокой местной противовоспалительной активностью и одновременно низким глюкокортикоидным системным действием.
Известны глюкокортикоиды общей формулы 1 (-NOH =о — — ОН
0Н
9 О где Х - атом водорода или. фтора в случае, когда У-атом водорода, и Х вЂ” атом фтора в подвергают взаимодействию с альдегиЮ случае. когда У вЂ” фтор; дом формулы А — СНО или его ацеталями
1156600 вг
В1
Цз С О
С
84 С вЂ” O Я, вг!
В6
15 где А имеет укаэанные значения;
В„- — одинаковые или различные, и каждый представляет собой водород илн алкильную группу с прямой или разветвленной углеводородной цепью, имеющей
1-4 атома углерода, в присутствии кислотного катализатора и при необходимости у полученного соединения этерифицируют 2 1-оксигруппу жирной кислотой с прямой или раз-. ветвленной углеводородной цепью с З0
1-5 атомами углерода, а при необходимости целевые соединения подвергают до или после этерифицирования хроматографии на поперечном связанном декстрановом геле с использовани-З5 ем органического растворителя в качестве элюента.
В качестве поперечно связанного декстранового геля предпочтительно используют оксипропилированный ; 40 декстрановый гель в форме шариков, в котором декстрановые цепи связаны поперечно и создают трехмерный полисахаридный каркас, а в качестве органического растворителя — смесь н-геп-45 тана, хлороформа и этанола в соотношении 0,5:(50-100):(10-1).
Реакция между 16 О -оксикортизолом и альдегидом или ацеталем желательно осуществляется путем добавления 50 стероида к раствору альдегида или . ацеталя вместе с кислотным катализатором, например хлорной, п-толуолсульфокислотной, соляной и другими, в диоксане или эквивалентных раствори- 55 телях, причем реакционная смесь затем нейтрализуется метиленхлоридом, Полученное неочищенное стероид-ацетальное производное, которое состоит из смеси 22R- и 225-эпимеров, после выделения очищают путем хроматографии на подходящем материале, например поперечно связанных декстрановых гелях смолы типа Сефадекс !Н с подходящими растворителями в качестве элюен- тов, например галоидированными углеводородами, простыми эфирами, сложными эфирами, такими как этилацетат или ацетонитрил.
Пример 1. 16о4 171-(22R 2Процилметилендиокси-4-прегнен-11р, 21-диол-3,20-дион.
К раствору 125 мг свежеперегнанного н-бутаналя и 0,1 мл 72Х-ной хлорной кислоты в 20 мл тщательно очищенного и высушенного диоксана добавляют порциями 500 мг 16а-оксикортизола в течение 15 мин при перемешивании. Реакционной смеси затем дают отстояться 5 ч при перемешивании при комнаткой температуре, Затем смесь разбавляют 100 мл метиленхлорида. Раствор промывают 10Х-ным раствором карбоната калия и водой, затем сушат и упаривают в вакууме. Остаток хроматографируют на колонке с внутренним диаметром 77 6,3 см, заполненной Сефадексом LH-20, используя хлороформ в качестве элюента. Фракцию
1995-2235 мл собирают и упаривают.
Остаток растворяют в метиленхлориде и осаждают петролейным эфиром. Получено 446 мг (89X) 16с, 170, (22 R5)пропилметилендиокси-4-прегнен-1 1р, 21-диол-3,20-диона, HP LC-анализ показал 99,2Х-ную чистоту и соотношение между 22S- и 22Р-эпимерами—
47:53. Продукт имеет точку плавления 175-203 C,(î =+138,0 (c=0,198;
CHzC1z); молекулярный вес 432 (вычисленный 432,6).
Пример 2. 16с, 17о -)22R5)Про пилме тиле ндиок си-4-пре гне н-1 1р, 21-диод-3, 20-дион.
К раствору 118 мг н-бутанал 6-диэтилацеталя и 0,1 мл 72Х-ной хлорной кислоты в 25 мл тщательно очищенного и высушенного диоксана добавляют
200 мг 16Ы-оксикортиэола порциями в течение 15 мин. Реакционной смеси дают отстояться при комнатной температуре в 5 ч. .Аналогично примеру 1. получают 2 14 мг неочищенного продукта. Продукт хроматографируют в колонке с внутренним диаметром &3-2,5 см, заполненной Сефадексом LH-20, с иснол (20:20:1). Собирают и упаривают фракции 1530-1680 мл и 1681-1860 мл.
Оба продукта осаждают из смеси метиленхлофида и петролейного эфира.
Проддукт из первой фракции (16,5 мг) идентифицируют при помощи "Н flMP u масс-спектрометрии как 22R-эпимер, а продукт из последующей фракции (13 мг) таким же образом — как 22Rэпимер. Эпимер s имеет точку плавления 176-179 С; о =+107,3 (c=0,262, СН2СI ); молекулярный вес 474 (вычислейный 474,6). Эпимер 8 -точку плавления 112-117 С; (с j =+132,2 (с=0,152; СН СI ); молекулярный вес
474 (вычисленный 474,6). Чистота эпимеров определена, как 99,7 -ная для
5-элимера и 95,0 -ная для R-, эпимера, 4Х примесей и -эпимера составляет эпи,мер
Пример 5. 164, I?d-(22S R5
Пропилметилендиокси-1 1 -окси- 21-бутирилок си-4-пре гиен-З, 20-дион.
К раствору 100 мг 16о, 17Ы-(22Юj
Пропилметилендиокси-4-пре гнея-1 1Р <
21-диол-3,20-диона в 5 мл пиридина по каплям добавляют 70 мг бутирилхлорида в 3 мл диоксана. Реакцию и выделение неочищенного продукта проводят аналогично примеру 2. Сырой продукт хроматографируют на колонке с внутренним диаметром 80.2,5 см, заполненной Сефадексом !.Н-20, с использованием хлороформа, как элюента.
Фракцию 200-250 мл собирают, упаривают и осаждают из смеси метиленхлорида и петролейного эфира, Получают
70 мг (60 .) I6pt, 17Ы-(22 RSJ-пропилметилендиокси-116-окси-2 1-бутирилокси-4-прегнен-3,20-диона. HPLC-анализ показал 99,7 -ную чистоту и соотношение 22S и 22R-эпимеров 44:56. Продукт имеет точку плавления 64-75 С; (с ) =+121,0 (с=0,218, СН СI ); молекулярный вес 502 (вычисленный 502,6).
П р и и е р 6. 16Ы,1?М- j22RS)Пропилметилендиокси-Itp-oêñè-21-пивалилокси-4-прегнен-3,20-дион.
К раствору 100 мг 16а, 1?с -(22RS3Пропилметилендиокси-4-пре гиен-11 р, 21-диол-3,20-диона в 5 мл пиридина по каплям добавляют раствор 65 мг триметилацетилхлорида в 3 мл диокеана. Реакцию и выделение сырого продукта проводят аналогично примеру 2.
Сырой продукт хроматографируют на колонке с внутренним диаметром 73 «
«6,3 см, заполненной Сефадексом Н-20, 5 »56600 пользованием хлороформа в качестве элюента. Фракцию 365-356 мл собирают и упаривают. Остаток далее очищают с помощью хроматографии на колонке
Сефадекс L,H-20 (85 2,5 см) с использованием в качестве элюента смеси н-гептан-хлороформ-этанола (20:20:1)
Собирают и упаривают фракцию 8551010 мл. Остаток растворяют в мети1О ленхлориде и осаждают петролейным эфиром. Получают 152 мг (67 ) !бсср
1?с -(22 RS3-пропилметилендиокси-4прегнен-!Ip 21-диол-3,20-диона, НР1С-анализ показал 98;2Х-ную чистоту и соотношение 43:57 между 228- и
229-эпимерами. Молекулярный вес 432 (вычисленный 432,6).
Пример 3, 1бс, 1?с -(22 RSjПропилметилендиокси-1 t P -окси-21аце ток си-4-пре гиен-3, 20-дион.
K раствору 918 мг 1бо, 1?а-{22RS3пропилметилендиок-4-пре гиен-11pi, 2t-диол-3,2О-диона в 60 мл пиридина по каплям при перемешивании добавляют раствор 460 мг ацетилхлорида в
30 мл диоксана. Реакционной смеси дают отстояться в течение ночи при комнатной температуре, а затем разбавляют 500 мл метиленхлорида, промывают 5Х Hûè водным раствором карбона- 0 та натрия, водой и сушат, После упаривания в вакууме остаток хроматографируют на колонке .с внутренним диаметром 72 6,3 см, заполненной Сафадексом Н-20, с использованием хлоро-35 форма в качестве элюента. Фракцию
1275-1695 мл собирают, упаривают и осаждают смесью метиленхлорида и петролейного эфира, Получают 671 мг (67X) 16Ы, I?oL-$22RSJ-пропилметилен- 40 диокси-11р-окси-21-ацетокси-4-прегнен-3,20-диона, НР С-анализ показал
99Х-ную чистоту и соотношение между
225- и 22R-эпимерами 53:47. Продукт имеет точку плавления 118-137 С; 45
3 3 =+125,0 (с=0,200, СН1С! ); молекулярный вес 474 (вычислено 4?4,6).
Пример 4. 16cL, 1?Ы-(22SJ- и
16Ы, 17d- t 22R3-Пропилметилендиокси11р-окси-21-ацетокси-4-прегнен-3, 20- 50 дион, 16 а, I?d-(22 RS)- Пропилметилендиокси- I I p-окси-21-ацетокси-4-; прегнен3«20-дион (40 мг) хроматографируют на колонке с внутренним диаметром 55
75 6,3 см, заполненной Сефадексом
LH-2О, с использованием в качестве элюента смеси н-гептан-хлороформ-эта.1156600
10 с использованием хлороформа в качестве элюента.
Фракцию 1245- 1485 мл собирают, упаривают и осаждают из смеси метиленхлорида и петролейного эфира. Получают 74 мг (617) 164, 17с -(22 R-Ëпро пилме тилендиок си-1 1р-ок си-2 1-пив алилок си-4-пре гиен-3, 20-диона . Анализ показал чистоту 98,7Х и соотношение между 225- и 22R-эпимерами
46:54. Продукт имеет точку плавления 95-105 C;(03 =+115,5 (с=0,110,, СН С1 ); молекулярный вес 516 (вычиеленный 516,7) .
Пример 7. 16М, 17k-(22RS—
Бутилме т иле ндиок си-4-пре гне н — 1 1 р, 2 1-диол-3,20-дион.
К раствору 170 мг н-пентаналя и
0,3 мл хлорной кислоты (727) в тщательно очищенном и высушенном диоксане добавляют 500 мг 16М-оксикортизола порциями в течение 15 мин. Затем реакционной смеси дают отстояться
5 ч при комнатной температуре. Аналогично примеру 1 получают 1590 мг
25 сырого продукта, который хроматографируют на колонке с внутренним диаметром 73-6,3 см, заполненной Сефадексом LH-20, с использованием хлороформа в качестве элюента. Собирают и упаривают фракцию 1860-2400 мл.
Остаток растворяют в метиленхлориде и осаждают из петролейного эфира. Получают 513 мг (877.) 16, 17oL-С22 Я- 3бутилметилендиокси-4-прегнен-11р, 35
21-диол-3,20-диона. Анализ показывает чистоту 98,9Х и соотношение 50:50 между 225- и 22R-эпимерами. Продукт имеет точку плавления 154-160 С; (Ы@ =+129,6 (с=0,308, СН С1з); моле- 40 кулярный вес 446 (вычисленный 446,6).
Пример 8. 16a(, 174,-f22RS)Бутилметилендиокси-4-пре гиен-11р, 2 1-диол-3 20-дион.
К раствору 53 мг н-пентанал-6-про- 4> пиленацеталя и 0,1 мл 72Х-ной хлорной кислоты в 25 мл тщательно очищенного и высушенного диоксана добавляют
100 мг 161-оксикортизола порциями в течение 15 мин. Реакционной смеси З дают отстояться 5 ч при комнатной температуре и ведут обработку аналогично примеру 1. Сырой продукт хроматографируют на колонке с внутренним диаметром 83-2,5 см, заполненной Се- И фадексом LH-20, с использованием хлороформа в качестве элюента, Собирают и выпаривают фракцию 285-380 мл
Данный продукт далее очищают с помощью хроматографии на Сефадексе 1.Н-20 (колонка с внутренним диаметром
85 2,5 см) с использованием смеси н-гептан-хлороформ-этанол (20:20:1) в качестве элюента. Собирают и упаривают фракцию 735-915 мл, Остаток растворяют в метиленхлориде и осаждают петролейным эфиром. Получают 77 мг (647) 16а, 17с4-(22Ю.1-бутилметилендиокси-4-прегнен-11р, 21-. диол-3,20диона. Анализ показал 96,8Х-ную чистоту и соотношение 22S- и 22R-эпимеров 46:54; молекулярный вес 446 (вычисленныи 446,6).
Пример 9. 16+ 17о -(22 3и 16с1, 17М-Г22 R)-Бутилметилендиокси4-прегнен-11р, 21-диол-3,20-дион.
16с, 174-(22 693-Бутилметнлендиокси-4-пре гиен-1 1 р, 2 1 -диол-3, 20-дион (500 мг) хроматографируют на колонке с внутренним диаметром 76-6,3 см, заполненной Сефадексом .Н-20, с использованием смеси н-гептан-хлороформэтанол (20:20:1) в качестве элюента., Фракции 4050-4395 и 4771-4950 мл собирают, упаривают и осаждают из смеси метиленхлорида и петролейного эфира. Продукты идентифицируют с помощью Н-ЯИР и масс-спектрометрии как
3-эпимер (79 мг) и R-эпимер (127 мг) соответственно. Чистота эпимеров
97,37. (содержание й-эпимера 2,1Х для S -эпимера) и 97,97 (содержание
S-эпимера 0,57 для й-эпимера. Кроме того, эпимер S имеет точку плавления
165-71 C;(cia =+119ю9 (c=Oэ382
СН С1 ); молекулярный вес 446 (вычислейный 446,6), а эпимер и — точку плавления 154-62 С; (о() =+148,3 (с=0,302, СН С1„); молекулярный вес
446 (вычисленный 446,6).
Пример 10. 161, 17 (-(22RS)-Бутилметилендиокси-11р-окси-21-ацетокси-4-прегнен-3,20-дион.
16Ы, 1 7с - (22 Р5 )-Бутилметилендиокси-4-прегнен-118, 21-диол-3,20-дион, (658 мг) и уксусный ангидрид (5 мл) растворяют в 5 мл пиридина и оставляют на ночь при комнатной температуре. Полученную смесь затем выливают в ледяную воду и несколько раз экстрагируют метиленхлоридом. Смешанные экстракты промывают разбавленной 1Х-ной соляной кислотой, карбонатом натрия (5Х в воде), насыщенным раствором хлористого натрия, сушат и упаривают в вакууме. Остаток хрома1Î
9 11566 тографируют на колонке с внутренним диаметром 73.6,3 см„ заполненной Сефадексом 1„H-20, с использованием хлороформа как элента. Фракцию 12151455 мл собирают и упаривают. Оста- 5 ток растворяют в метиленхлориде и осаждают из петролейного эфира. Получают 507 мг (71X) 1бр,174-j22 WS3бутилметилендиокси-11р-ок си-21-ацетокси-4-прегнен-3,20-диона. НР!.С-анализ показал 98,5Х-ную чистоту и соотношение 22R и 22 -эпнмеров 51:49.
Продукт имеет точку плавления 10825 С Я) 1, =+126,5 (c=0,238, CHzC t z); молекулярный вес 488 (вычислейный
488,6).
Пример 11. 16о(, 17а-$22SJи 16о, 17а-(22Rj-Бутилметилендиокси11р-окси-21-ацетокси-4-прегнен-3, 20дион. 20
16, 1 7М вЂ” 2 2Ю - Бу тилме тиле ндиок с и1 t p-окси-21-ацетокси-4-прегнен-Э, 20дион (485 мг) хроматографируют аналогично примеру 3. Фракции 1275-1425 и 1486-1590 мл собирают и упаривают.
Продукты осаждают из смеси метиленхлорида и петролейного эфира и идентифицируют с помощью "Н-ЯИР и массспектрометрии соответственно, как.
S-эпимер (140 мг) и R-эпимер (294 мг) ЗО
Чистота эпимеров по данным НР1,С-анализа 97,5Х для 5-эпимера (при содержании 1,3X R-эпимера) и 97,1Х для
Р-эпимера (c 1,2X S-эпимера). Эпимер
5 имеет точку плавления 152-57 С; 3s (d3> =+104,4 (с0,226, СН С! );молекулярный вес 488 (вычислейный 488,6), . а зпимер к — точку плавления 75-77 С;
Го =140,4 (с=0,228, СН С1 ); молекулярный вес 488 (вычисленный 488,6).40
Пример 12. 164, 172-(2253Бутилме тилендиок си-4-пре гиен-1 1 а, 2t-диол-3,20-дион.
К раствору 16ot, 17o(-(22 5)-бутилметилендиокси-11р-окси-21-ацетокси- 4$
4-прегнен-3,20-диона (53 мг) .в 10 мл метанола добавлялось 1,5 мл карбоната калия (10X в воде). После 10-минутного перемешивания при комнатной температуре s атмосфере азота смесь Ю нейтрализуют уксусной кислотой, разбавляют 25 мл воды и экстрагируют метиленхлоридом. Объединенные экстракты сушат и упаривают в вакууме.
Остаток хроматографируют на колонке 5S с внутренним диаметром 83 2,5 см, заполненной Сефадексом Н-20, с использованием хлороформа в качестве элюента. Собирают и упаривают фрак" цию 285-330 мл. Получают 35 мг (7ЭХ)
164, 174-(22 3-бутилметилендиокси-4прегней-11 р, 21-диол-3,20-диона после осаждения из смеси метиленхлорида и петролейного эфира. Продукт идентифицируют при помощи масс-спектрометрии и его чистота, как показывает анализ НР!.С составляет 98,8 (он содержал 0,8Х Р-эпнмера), точка плавления его 160-67 С;(оЦ =+115,0 (с=
=0,322> СН С1 ); молекулярный вес
446 (вычи .ленйый 446,6) ..
Пример 13. 16о, 17о -(22К)Бутилметилендиок си-4-пре гиен-11Р, 21-диол-3,20-дион.
К раствору 16М, 17е -(22@3-бутилметилендиокси-11р, окси-2 1-ацетокси4-прегнен-3,20-диона (58 мг) в 10 мл метанола добавляют 1,5 мл карбоната калия (10Х в воде). Реакционную смесь обрабатывают по примеру 10. Сырой продукт хроматографируют на колонке с внутренним диаметром 83.2,5 см, заполненной Сефадексом !.Н-20, с использованием хлороформа в качестве элюента. Собирают и упаривают фракцию 305-360 мл. Получают 43 мг (81X)
1 6 Ы, 17о - (2 2 К) -бутилме тиле ндиок си-4прегнен-11р, 2!-диол-3,20-диона, после осаждения из смеси хлористого метилена и петролейного эфира. Продукт идентифицировался с помощью массспектрометрии, и его чистота, как показал НР С-анализ, была 95,4Х (содержал 2,5Х 5 -эпнмера). Точка плавления 152-62 C;(g$ =+149,0 (c=0,312, GH zC t z ); молекулярйый вес 446 (вычисленный 446,6) .
Фармакологические испытания.
Все стероиды, представленные в изобретении, представляют собой физиологически активные соединения, Их глюкокортикоидные свойства сравнивались с таковыми будезонида (общая формула t ), 162, 173-$22RSg-пропилметилендиоксипрегна-1,4-диев-ttp
2t-диол-3,20-дион, так как данное соединение является одним из глюкокортикоидов, которое достигло больше всего в направлении требуемого сочетания местного и системного действия; противовоспалительное действие оценивалось по способности предотвращать отек уха у крыс согласно нижеописанной процедуре.
Ушной отек вызывали у самцов крыс весом около 90 г с помощью 20 мкл на!
1 156600
Из таблицы видно также, что новые соединения в 3-20 раз менее активны, чем будеэонид в проявлении нежелательных системных глюкокортикоидных эффектов. Новые соединения обладают также в 5-10 раз более высокой противовоспалительной активностью, чем ранее известные 16, 17(x-(22R)-метилметилендиокси-4-прегнен-!1р, 2 1-диол3,20-дион, при одинаковой системной клюкокортикоидной активности.
30 Таким образом, новые соединения изобретения удовлетворяют требованию сочетания высокой местной противовоспалительной активности и сравнительно низким системы действием. край уха 5Х-ного этилфенилпропиолата (Альдрих КО), растворенного в ацетоне. Через 2 ч ушной отек измеряли специальным микрометром (Одитест, Н.С.Kroplinl Глюкокортикоиды приме- 5 ияли за 16 ч до. индуцирования отека
20 мкл на край уха в виде растворов в ацетоне (0,08-50 мкг) стероида (мл на 0,0064 мкг на крысу). Для каждой дозы испытывали 6 ушей. Относительную активность испытуемых соединений по предотвращению отека уха вычисляли по данным анализа линейной регрессии по сравнению с контрольным соединением (будезонидом). 15
Активность соединений по обеспечег нию системного глюкокортикоидного действия исследовали путем подкожных иъекций, так как нри уровнях доз, использованных в упомянутом опыте по местному применению, не достигалось никакого системного эффекта.
0,5 мл Стероидного препарата инъецировалось крысам того же веса и пола, как уже описано. По меньшей. мере. 5 доз каждого из исследуемых соединений вводили в интервале до 20-1280 мкг на крысу по 4 животных на каждую дозу. В первые два дня после инъекции регистрировалось увеличение веса тела животных, а по истечении последующих двух дней — вес вилочковой железы, так как эти временные интервалы оптимальны для определения соответс ствующего системного действия. Относительную активность соединений вычисляли по данным анализа линейной регрессии по сравнению с контрольным веществом (будезонидом).
Результаты испытаний глюкокортикоидов изобретения B соответствии с проведенной процедурой показаны в таблице. Известно, что введение двойной связи в позицию 1,2 кортиэола повышает его глюкокортикоидную активность. В таблице показано, что новые соединения (производные 4-прегнена), имеют приблизительно такую же высокую противовоспалительную активность, как и будезонид (проиэводные 1,4-прегнадиена).
14
1156600
Фармакологическое действие испытанных соединений сн z
C 0 — -О- И
О A
10 О
Эпимер S
Зпимер R
Эпнмер
МестCel Св ное противовоспалительтью ное дейст вие
Местное действие
Инволюция
МестТорможение прироста веса ция ви тела лочко вой же-
1 леэы) -СН-СН- СНз(СН,)г ОН
СН СН СН (СН ) ОН
1 1 1
204 1,61 08 1,1
0,19 0,13 0,7 1,0
ОН
-СН -СН—
2 г
-СН -СН— г
Снз(снг)г ОН
012 009 85 113
Снз (СНг) СН зСОО
Сн, (СН ) СН,СОО
R+S О, 68
R 1,15
0,09 4,3 7,6
006 72 192
0,16
0,16
-СН -СН—
-Сн -СНг
0 32 0 27 4 0 4 8
С з(снг)г СН (СН ) СОО
-СН -СН— г z.
R+S 1, 29
Снз (СН г)г
CCH Hз(CCHHг)а
3)з
ОН
-СН -СН—
-СН -CH— г
R+S 1, 00
Н+8 1ю11
0,29
0,07
0 19 3,$5,3
0,05 15,9 22,2
О 14 0 17 5 9 4 8
-СН -СН—
2 2
R+S 0,82
Сн з (СН г)з СН зсОО
"з(СНА
-СН -СН
z г
R: 109 0 12 016 9 1 68
П р и м е ч а н и е: Соотношение между эпимером R и эпимером 5 1:1.
BHJABIH Заказ 3203/57 Тираж 354 Подписное
Филиал ППП "Патент", г.Ужгород, ул.Проектная, 4
СН
C--0 — A
О -н
R+S 1
R 1,70
0,13
R+S 1, 02
Способность вызывать системное глюкокортикоидное действие
Терапевтическое соотношение между местной и системной активнос-. ное действие (ин волю