Способ получения белкового антигена фасциол
Иллюстрации
Показать всеРеферат
СПОСОБ ПОЛУЧЕНИЯ БЕЛКОВОГО АЛТИГЕНА ФАСЦИОЛ, включающий экстрагирование антигенов из гельминтов и их очистку методом аффинной хроматографии с сорбцией белкового антигена на связанном с феншталанином нерастворимом комплексе и отмыванием несорбируемых элементов экстракта, с последующим его элюированием, о тличающийся тем, что,- с ) целью повышения степени очистки И предотвращения потери белкового антигена фасциол, в качестве нерастворимого комплекса используют CNBrактивированную сефарозу 4В, а сорбцию белкового антигена фасциол и отмьгеание несорбируемых элементов экстракта проводят при рН 3,8-3,9, причем связавшийся с сорбентом антиген элюируют при рН 7,0-8,0. СЛ СО СЛ со Л 20X tfO (рракции Фиг.(
(19) (! )) СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН
4(5)) А 61 К 39/ОО
4 ОПИСАНИЕ ИЗОБРЕТЕНИЯ, К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
" г .
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИИ йомра фракций
4)d8.1 (21) 3609919/30-15 (22) 27.04.83 (46) 07.06.85, Бюл. У 21 (72) В.В. Клименко (71) Всесоюзный ордена Трудового
Красного Знамени научно-исследовательский институт гельминтологии им. К.И. Скрябина (53) 576.8.097.2:576.8.895.122.097 (088;8) (56) 1. Антропозоогельминтозы и перспективы их ликвидации.-Тезисы докл. на научи. конф. (СамаркандТайляк, 16-18 апреля 1975), И., 1975, с. 38-41.
2. Патент Великобритании
)) 1359535, кл. С 3 Н-, опублик.
10.07.74.
Ф
Ю ью 4 еФ (54) (57) СПОСОБ ПОЛУЧЕНИЯ БЕЛКОВОГО
АНТИГЕНА ФАСЦИОЛ, включающий экстрагирование антигенов из гельминтов и их очистку методом аффинной хро матографии с сорбцией белкового антигена на связанном с фенилаланином нерастворимом комплексе и отмыванием несорбируемых элементов экстракта. с последующим его элюированием, о т- . л и ч а ю шийся тем, что, — с целью повышения степени очистки и предотвращения потери белкового антигена фасциол, в качестве нерастворимого комплекса используют CNBrактивированную сефарозу 4В, а сорбцию белкового антигена фасциол и отмывание несорбируемых элементов экстракта проводят при рН 3,8-3,9, причем связавшийся с сорбентом антиген элюируют при рН 7 0-8 О
11595
79 том.
55
Изобретение относится к области ветеринарии и медицины, в частности к проблеме получения антигенов из гельминтов, а именно из фасциол, паразитирующих в печени сельскохозяйственных животных и человека.
Известен способ получения одного из антигенных компонентов фасциол— белкового антигена невысокого молекулярного веса (27 500 дальтон-) комби-1О наций методов гель-фильтрации, ионообменной хроматографии и препаративного электр офореза (1) .
Недостатком данного способа является сложность (многоэтапность) 15 процесса выделения и присутствие в препарате, кроме иммунологически активного материала, примесей других белков и полипептидов. Кроме того, такой процесс очистки сопровождает- 2п ся потерей антигенной активности вследствие распределения множественных форм антигена по разным фракциям (антиген оказался не однородным веществом, а гетерогенной груп- 25 пой иммунологически близких, но различающихся по физико-химическим свойствам компонентов). В результате конечный продукт представляет собой одну из фракций, куда попадает лишь часть исходной антигенной активности и он не свободен от сопутствующих примесей.
Наиболее близким к предлагаемому способу является способ получения
35 белкового антигена из гельминтов, в частности шистосом, включающий
I экстракцию антигена, очистку на сефадексе Г-200 и очистку методом аффинной хроматографии на агарозе, к которой в качестве лиганда присоединен фенилаланин, избирательно сорбирующий фермент из гетерогенной смеси веществ ири рН З,в-4, в (2) .
При этом используется то обстоятельство, что белковый антиген шистосом является протеолитическим ферменНедостатком известного способа является проведение десорбции фермента либо снижением рН до 2-3, либо его повышением до 4,5-5,5.Для выделения низкомолекулярного белково» го антигена фасциол, также оказавшийся протеиназой, такие условия десорбции неприемлемы, так как при слишком низких рН появляется опасность денатурации антигена, а рекомендуемые более высокие его значения (рН 4,5-5,5) находятся в области, близкой к изоэлектрической точке антигена (5<рН<6), что также снижает его устойчивость.
Кроме того, рекомендуемые значения рН,не являются оптимальными для проведения иммунологических реакций. Наличие предварительного этапа выделения фермента на сефадексе
Г-200 усложняет процесс очистки.
Цель изобретения — повышение степени очистки и предотвращение потерь белкового антигена фасциол.
Указанная цель достигается тем, что согласно способу получения белкового антигена фасциол, включающему экстрагирование антигенов из гельминтов и их очистку методом аффинной хроматографии с сорбцией белкового антигена на связанном с фе™ нилаланином нерастворимом комплексе и отмыванием несорбируемых элементов экстракта с последующим его элюированием, в качестве нерастворимого комплекса используют CNBrактивированную сефарозу 4В, а сорбцию белкового антигена фасциол и отмывание несорбируемых элементов экстракта проводят при рН 3,83,9, причем связавшийся с сорбентом антиген элюируют при рН 7,0-8,0.
Пример 1. Для получения сорбента со сродством к антигену-протеиназа берут 7 r препарата CNBr-активированной сефарозы 4В, приготовленной в лабораторных условиях из нейтральной сефарозы 4В (лучше использовать коммерческий препарат активированной сефарозы), суспендируют его в 0,001 M HC1 и многократно промывают тем же раствором на стеклянном фильтре из расчета 200 мл/г.
Полученную суспензию геля смешивают с 50 мг фенилаланина, предварительно растворенного в 10 мл 0,1 M
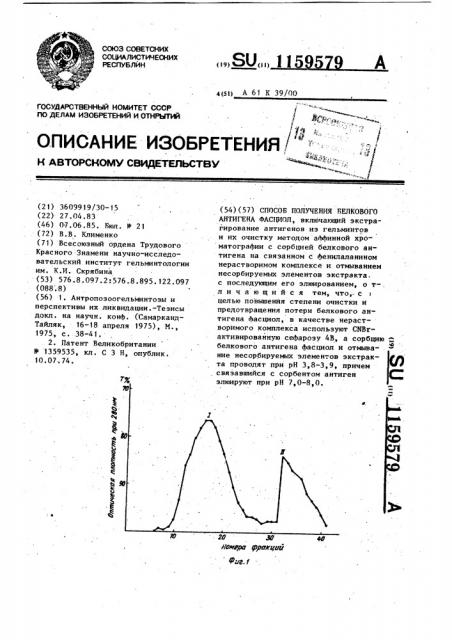
NaHC0 с добавлением 0,5 M NaC1. (можно использовать и другой, не содержащий аминогруппы, щелочной буфер). Смесь инкубируют в течение 2 ч при комнатной температуре и при постоянном помешивании (нельзя использовать магнитную мешалку). За это время заканчивается ковалентное связываемые фенилаланина с нерастворимой матрицей. Контролем окончания реакции является поглощение гелем растворенного фенилаланина, 50 з 1!59579 4 регистрируемое спектрофотометрически их удаления необходимо собрать не по снижению оптической плотности менее 20 фракций элюата объемами по раствора. После этого гель промы†1,5 мп (Фиг. 1, первый пик). Элюцию вают добавлением раствора О, 1 М сорбцировавшегося на геле антигеNaHCO /0,5 М NaC1. Надосадочную 5 на-протеиназы проводят другим бужидкость декантируют и проводят бло- ферным раствором — 0,05 M трис-НС1/ кирование Оставшихся активных групп 0,5 M NaC1 с рН 8,2 (Фиг. 1, второй добавлением 50 мл 0,1 M трис-HCI-бу- пик). Можно использовать буфер фера с рН 8 (можно использовать ра- другой природы с близкими значествор другого вещества, содержа- ниями рН. щего аминогруппы, например, этанол- Фракции, элюируемые в таких амина). Смесь непрерывно перемеши- условиях проявляют антигенную и вают в течение 2 ч, затем гель пе- протеолитическую активность имевФ реносят на стеклянный фильтр и про- шуюся в исходном препарате, в то времывают щелочным (О, 1 М NaHCO>/0,5 М 15 мя, как фракции, соответствующие
NaCl), а затем кислым буфером. В ка- первому пику, такой активностью не честве кислого буфера используют обладают . Она может иметь здес ь мессмесь. 0,1 М лимонной кислоты 0,2 М то лишь в случаях, когда величина
Na>HPO+ и 0,5 M NaC1 (рН 3,8). Мож- хроматографируемого образца превыно использовать ацетатный или 20 шает емкость сорбента, Последнее на другои буфер с блиэким рН. Для качество очистки антигена не отражаполного удаления примеси веществ, ется, а приводит лишь к излишним понековалентно связанных с гелем, терям. Для определения антигенной проводят не менее пяти таких циклов активности элюата в реакции иммупромывания (присутствие в щелочных 25 нодиффузии кислые фракции сооти кислых буферных растворах 0,5 М ветствующие первому пику, нейтралиэоNaC1 обязательно). вали прибавлением к каждой по 1 мл
Полученный продукт (8 мл сорбента . щелочного буфера. Для сравнимосимеющего в качестве лиганда фенил- ти результатов иммунологического анааланин) упаковывают в хроматогра- 30 лиза к щелочным фракциям, соответстфическую колонку (1 см х 20 см) и вующим второму пику, также добавляли промывают рабочим буфером, содер- по 1 мл щелочного буфера. жащим 0,5 М NaC1 (рН 3,8). Результаты количественного иммуВ качестве образца для проведения нологического анализа исходного обаффиннои хроматографии используют З разца и полученных Фракций представчастично очищенный препарат низко- лены на фиг. 2. Фракции предварительмолекулярного белкового антигена, по- но были объединены в два пула (соотлученный из экстракта фасциол гель- ветственно пикам оптической плотфильтрацией на сефадекс Г-100 ности), сконцентрированы до объемов, (фракция с К „ = 0,3-0,ч). Анало- 4О примерно равных объему исходного обгичный препарат можно получить на се- разца и охарактеризованы в реакции фадекс Г-75, Г-150, Г-200, на сефа- иммунодиффузии с помощью иммунной розе 6В или соответствующих гелях сыворотки кролика с экспериментальным других фирм. Антиген переводят либо фасциолезом (4 мес. после заражения). посредством диалиэа, либо на колонке 45 Реакцию проводили в агаровом геле
Э с сефадексом Г-25 з рабочий буфер, используя штамп "семерка", в централь» содержащий 0,5 M NaCl (рН 3,8) . ную лунку которого помещали иммун7 мп обработанного таким способом ную сывороткуф а в периферические антигенного материала с титром антигены в раэчичных титрах (цифры
1:128 (по результатам иммунодиф- 1-32 обозначают кратность разведефузии) вносят в колонку, предва- ния антигена).
1 рительно заполненную сорбентом и
У соР ентомj jи Иммунологический анализ концен-. элюируют рабочим буфером несо биУф Ро несоРби . трированных пулов, раститрованныхруемые гелем примеси и ис тств юр, рисутствую .щелочным буфером, показал, что анщие в препарате (хромопротеид корич- 55 тигенная активность исходного образневого цвета, обуславливающий ца и пула 11 примерно одинакова. окраску препарата и экст акта Причем такая же иммунологическая геполипептидов и др. . r Ля полного терогенность очищенного ан-игена
1! 59579
1О l5
55 (пул 11), как и в исходном образце (2 полосы преципитации) свидетельствует о том, что в результате аффинной хроматографии множестненные формы не.теряются, а оказываются сосредоточенными вместе, тогда как другие (неактивные) компоненты исходного образца удаляются н составе фракций, соответствующих пику
1. Последнее подтверждается следующими данными. Разделение антигенного препарата в результате аффинной хроматографии на две основные фракции, соответствующие двум пикам на графике (фиг. 1), и сосредоточение специфической активности н одной из них свидетельствует об удалении из исходного препарата большого количества примесей (площадь первого пика, соответствующего неактивным примесям, больше площади пика 1, соответствующего актинному материалу). При электрофоретическом анализе исходного препарата антигена и полученных после аффинной хроматографии Фракций (пулов Т и gZ) показано, что пул 1, обладающий антигенной и протеолитической активностью, гораздо менее гетерогенен, чем исходный препарат, и что многие компоненты исходного препарата (хромопротеид, мигрирующий при электро.Форезе н виде одной, а иногда 2-3 коричневых полос, до 5 полипептидов, идентифицированных по их растворимости в трихлоруксусной и сульфосалицилоной кислотах, и некоторые другие) попадают во фракцию I.
Пример 2. Приготовление сор- бента для аффинной хроматографии проводят так же, как в примере 1, но в качестве образца используют не частично очищенный препарат низкомолекулярного белкового антигена, а неочищенный экстракт фасциол, содержащий, кроме антигена-протеинаэы другие паразитарные антигены и массу самых различных примесей.
Лля получения экстракта берут
5 г фасциол, добавляют 2,5 мл 0,2 М цитат-фосфатного (или другого) буфера с рН 3,9, гомогенизируют 5 мин в блендере с режущими лопастями при
0 — 4 С. Гомогенат центрифугируют о
15 мин при 8000 об!мин. Получают около 5 мп экстракта с титром .антигена-,протеиназы 1:256.
Хроматографическую колонку (1 см х 20 см) заполняют 8 мл сорбента, приготовленного и обработанного таким же образом, как и в примере 1 и уравновешенную тем же буфером с рН 3,9 (обязательно содержащим 0,5 М NaC)) и наносят на поверхность геля 4 мл экстракта.
Антиген-протеиназл сорбируется в в геле и остается прочно с ним связанным, тогда как остальные КоМ поненты экстракта, в том числе и высокомолекулярные белковые н небелковые антигены вымываются при пропускании через колонку 50 мл упомянутого буфера (Фиг. 3, пик 1).
Элюцию сорбировавшегося антигенапротеиназы пронодят с помощью щелочного буфера (0,05 М трис-HC 1/0,5 М
NaCl) с рН 8 (Фиг . 3, пик 11), Иммунологический и электрофоретический анализ фракций, соответствующих пику 11, показал такую же степень очистки антигена-протеиназы как и в примере 1.
Таким образом, этап предварительной очистки антигена протеиназы на сеФадексе не является обязательным и такая же эффективная очистка возможна непосредственно из экстракта
Фасциол.
Пример 3. Более упрощенный вариант получения антигена состоит в том, что его очистку приводят не в колонке, а в объеме. Предварительную подготовку сорбента и образца проводят так же, как и в примере 1 и
2. Затем образец выливают в стакан с сорбентом и перемешивают 15 мин. (нельзя использовать магнитную мешал. ку, разрушающую сорбент). Получен ную суспензию переносят на воронку со стеклянным фильтром и промывают для удаления несорбируемых примесей, как обычно, кислым буфером с рН около 4. Промывают до тех пор, пока в Фильтрате не исчезнет белок (пока оптическая плотность Фильтрата при Фотометрировании не приблизится к нулю). Фильтрат отбрасывают, а к гелю на фильтре добавляют щелочной буфер и вытекающий при этом фильтрат, содержащий десорбировавшийся антиген-протеиназу, собирают в подходящую емкость.
Такой способ не требует сложного оборудования„ но сопровождается несколько большим расходом буферов, 1159579
Исхп3ный
Х
Фиг.2 и антиген выходит более разбавленным, чем в колоночном варианте.
Пример 4. Подготовку образца, подлежащего хроматографии, его посадку на предварительно подготовленный сорбент при рН около 4 и удаление несорбируемого материала проводят так же, как и в примере 2 или 1. Однако сорбировавшийся на геле антиген — протеиназу элюируют не щелочным, а нейтральным буфером с рН 7.
Заметной разницы в эффективности десорбции при этих условиях не наблюдается.
Таким образом, предлагаемый способ позволяет получить высокоочищен. ный,препарат низкомолекулярного белкового антигена фасциол, причем не.=мотря на гетерогенность самого антигена, его множественные формы не теряются в процессе очистки, а оказываются сосредоточенными вместе.
Десорбция антигена при нейтральных или слабощелочных значениях рН позволяет не только сохранить его нативность, но и непосредственно использовать его для проведения иммунологических реакций, для которых
l0 такие условия являются наиболее оптимальными.
Предлагаемый способ является более простым по сравнению с из— вестным, так как высокая степень очистки антигена может быть достигнута практически в один этап.
Полученный антиген может быть использован в качестве диагностикума при фасциолозе сельскохозяйственных животных и человека.
1159579
Т% (280им
10 20 нбмера Фракций Риг.Я
Составитель С. Воробьев
Редактор Л. Зайцева Техред Т.Маточка, Корректор Е. Рошко
Заказ 4750 Тираж 722 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4