Способ получения 3 @ ,5-цикло-24 @ -этил-5 @ -холест-22-ен- 6-она
Иллюстрации
Показать всеРеферат
СПОСОБ ПОЛУЧЕНИЯ Зо 5-ЦИКЛО-245-ЭТИЛ-5о ХОЛЕСТ-22-ЕН-6-ОНА формулы . включающий обработку исходного стигMacTepiaia паратолуолсульфохлоридом, обработку полученного тизолата стигмастерина основанием, окислением (Л 3oLt 5-цикло-245-этил-5оС-холест-22-ен-Зр-она хромовой кислотой и выделение целевого продукта, отличающийся тем, что, с делью упрощения процесса и повышения выхода целевого продукта, в качестве основания используют ацетат калия, а окисление проводят непос1 дственно Од в реакционной смеси. 00
СОЮЗ СОВЕТСНИХ
СОЦИАЛ ИСТИЧЕСНИХ
РЕСПУБЛИН
4(51) С 07 J 9/00
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTQPCHOMY СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (2i) 3700450/23-04 (22) 14 ° 02.84 (46) 23.06.85. Бюл. Ф 23 (72) А.А.Ахрем, Ф.А.Лахвич, В.А.Хрипач, В.Н.Жабинский и Н.В.Ковганко (71) Институт биоорганической химии
АН Белорусской CCP (53) 547.689.6.07 (088.8) (56) 1. Mori К., Sakakibara M., Ichikava J., Ueda Н,, Okada К., Umemura Т., Jabuta G., Kuvahara S., Kondo M., Minobe М., Sogabe А.
Synthesis of (22$, 23$)-ЬошоЪгазз1nolide and brassinolide from stigmastего) †"Tetrahedron", 1982, v. 38, Р 14,,р. 2099-2109.
2, Kosher Е.M., Winstein S..
Neighboring carbon and hydrogen XXII
Homoallylic systems. The preparation
and behavior of certain 3,5-cyclostегоids. — J. Am.Chem, Soc, 1956, v. 78, р. 4347.
„„SU„„1162816 А (54) (57) СПОСОБ ПОЛУЧЕНИЯ 3d, S-ЦИКЛО-249-ЭТИЛ-5а1-ХОЛЕСТ-22-ЕН-6-ОНА формулы включающий обработку исходного стигмастерж а паратолуолсульфохлоридом, обработку полученного тизолата стигмастерина основанием, окислением
Зо,5-цикло-245-этил-5а -холест-22-ен-Зр-она хромовой кислотой и stageление целевого продукта, о т л и— ч а ю шийся тем, что, с целью упрощения-процесса и повышения выхода целевого продукта, в качестве ос-. sea& нования используют ацетат калия, а вечеа окисление проводят непосредственно ф в реакционной смеси. М
Об
tws4
1162816
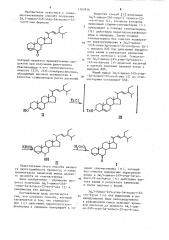
Известен способ 1 получения
Зоl,5-цикло-241-этил-5 -холест-22-ен-6-она (I), согласно которому природный стерни-стигмастерин (« ) превращают в тозилат стигмастерина (1к ) действием паратолуолсульфохлорида в пиридине. Затем тозилат стигмастерина без очистки подвергают перегруппировке в Зс,5-цикло-24 -этил-5а -холест-22-ен-бв-ол (lv ) с выходом 82Х под действием бикарбоната калия в результате кипячения в смеси ацетона с водой. Окислени15 ем Зо 5-цикло-245-этил-5d-холестУ
-22-ен-6 3-ола (V) хромовой кислотой в ацетоне получают целевой кетон с выходом 80Х.
Общий выход ЗсС,5-цикло-245-этил20
-А(-холест-22-ен-6-îíà (I) из стигмастерина составляет 657.
TsO
К2СГ 0 1
3 кнсю
ОН
Недостатками этого способа являются двухстадийность процесса, а также сравнительно невысокий выход целевого продукта из стигмастерина.
Цель изобретения — упрощение процесса получения Зо(,5-цито-245-этил-5Ы-холест-22-ен-6-она (I) и увеличение его выхода.
Поставленная цель достигается
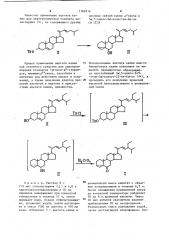
55 тем, что согласно способу, который заключается в том, что стигмастерин (й ) действием паратолуолсульфохлорида в пиридине превращают в тоИзобретение относится к совершенствованному способу получения
ЗЫ,5-цикло-245-этил-5 -холест-22-ен-6-она формулы который является промежуточным продуктом при получении фитогормона брассинолида и его синтетического аналога (2?S, 23S)-гомобрассинолида, обладающих высокой активностью в качестве стимуляторов роста растений зилат стигмастерина (ю ), который без очистки подвергают перегруппировке в ЗЫ,5-цикло-24S-этил-52-холест-22-ен-6р oë (W) действием ацетата калия в результате кипячения в смеси ацетона с водой, Зс(,5-1(икло-245-этил-5 (-холест-22-ен-6д-ол (iv) без выделения в индивидуальном виде непосредственно в реакционной смеси окисляют хромовой кислотой до целевого 34 5-цикло-?45-этил-Ы-холест-22-ен-б-она.
1162816
Ts0
Ts С1
ТяО
НО
H CrOg
ОН
1 л
Известно применение ацетата калия для перегруппировки тозилата холестерина (Ч), не содержащего других
Однако применение ацетата калия 15 как основного средства для перегруппировки тозилатов З э-окси-д -стероидов, имеющиха связь, способную к аа миграции под действием кислот и оснований, а .также окисление спиртов хро- 20 мовой кислотой в ацетоне в присутствии ацетата калия, неизвестна.
Пример. Раствор 8 r (19 мм) стигмастерина (1() и 4,8 г паратолуолсульфохлорида .в 50 мл пирицина выдерживают при комнатной температуре в течение 22 ч, затем выливают воду. Осадок отфильтровывают, промывают водой, затем растворяют в смеси 1500 мл ацетона и 100 мп воды. Добавляют 5 r ацетата калия и двойных связей кроме а связи в
Зс, 5-цикло-M-холестан-6р-ол (И ) Г23
Использование ацетата калия вместо бикарбоната калия позволяет не выделять промежуточно образующий- ся неустойчивый За,5-цикло-249-этил-5о -холест-22-ен-6р-ол (h!), а проводить его окисление хромовой кислотой непосредственно в реакционной смеси реакционную смесь кипятят с обратным холодильником в течение 6,5 ч.
После охлаждения реакционной смеси до комнатной температуры добавляют
50 мл 8 н.хромовой кислоты. Через
20 мин избыток окислителя удаляют прибавлением 20 мл изопропанола.
Реакционную смесь разбавляют водой, затем экстрагируют хлороформом. Хло1162816
Составитель Т. Гусарова
Техред М. Кузьма Корректор С. Черни
Редактор Л.Гратилло
Заказ 4061/22 Тираж 354 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035,. Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4 роформный экстракт упаривают в вакууме, остаток хроматографируют на колонке с силикагелем, элюируют смесью гексана с эфиром (10 :1).
Получают 6,21 r (15 мм, выход 80K)
Зо,5-цикло-24 -этил-холест-22-ен-6-она (I). Т.пл. 100-102 С гексан.
Т. пл. 102-103 С, ИК-спектр (KBr, см- ): 1680 (C=O) . Спектр ПМР (100 мГц, d", м., d ): 0,72 (С, ЗЙ, 18-Ме), 0,99 (С, 3Н, 19-Ме), 4,95.—
5, 16 (м, 2Н, C и С -Н). Массспектр (m/e): 410 (М ).
Таким образом, предлагаемый спо-. соб позволяет объединить в одной синтетической стадии три процесса: получение тозилата стигмастерина, его перегруппировку в 3,5-цикло-249-этил-5d. — холест-22-ен-6/3-ол и последующее его окисление в целевой кетон. Кроме того, 34,5-цикло-24S-этил-Ы-холест-22-ен-6-он получают
10. с высоким выходом (807).
Предлагаемый способ по сравнению с известным позволяет повысить выход целевого продукта на 157 и сократить.процесс его получения на одну стадию.