Способ получения транс-2-замещенных 5-арил-2,3,4,4а,5,9 @ - гексагидро-1 @ -пиридо (4,3- @ ) индолов
Иллюстрации
Показать всеРеферат
1. СПОСОБ ПОЛУЧЕНИЯ ТРАНС-2-ЗАМЕЩЕННЫХ 5-АРШ1-2,3,4,4а, 3,9Ъ-ГЕКСАгадРО-1Н-ПИРИДО
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН (!9) (Ф1) (51) 4
ОПИСАНИЕ ИЗОБРЕТЕ
Н flATEHTY
-(сн) -сн п он (II) х
-(СЩп
1, м. — Н
С"
ОН
ОН с
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
flO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 2865803/23-04 (22) 04.01.80 (3i) 005698 (32) 23.01.79 (33) US (46) 15.0?.85. Бюл. № 26 (72) Виллард Маккован Велч, млад,п)ий (US) (71) Пфайзер Инк (US) (53) 54 7. 859. 3, 07 (088. 8) (56) 1. Заявка ФРГ ¹ P 2822465, кл. С 07 D 471/04, i 978. (54)(57) 1. СПОСОБ ПОЛУЧЕНИЯ ТРАНС-2-ЗАМЕЩЕННЫХ 5-АРИЛ-2,3,4,4а, 5,9Ъ-ГЕКСАГИДРО-1Н-ПИРИДО(4,3-Ь)
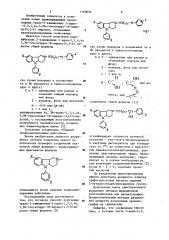
ИНДОЛОВ общей формулы где атомы водорода в положениях 4а и 9Ь находятся в транссоотношении друг к другу;
Х и У вЂ” одинаковые или различные и означают водород или фтор;
Z — водород, фтор или метоксил; и-. 3 или4; или их смесь, или †(—, часть 5-арил-2,3,4,4а,5,9Ь-гексагидро-1Н-пиридо(4,3-Ь) индола является правовращающей, о т л и— ч а ю шийся тем, что, соединение общей формулы этерифицируют оптически активной кислотой — трет-бок-L-фенилаланином в инертном растворителе о при температуре от 0 С до комнатной в присутствии дициклогексилкарбодиимида, разделяют дистереомерные эфиры, правовращающие изомеры извлекают, гидролизуют и, в случае необходимости, для получения соединений формулы (1), когда М—
-С=О, окисляют хромовой кислотой.
2. Способ по п.1, о т л и ч а— ю шийся тем, что до разделения диастереомерных эфиров удаляют
2-бутоксикарбонилзащитную группу трифторуксусной кислотой.
3. Способ по пп. 1 и 2, о т— л и ч а ю шийся тем, что-разделение диастереомерных изомеров осуществляют методом колоночной хроматографии.
1168094
/ Z (а)к-М
C), где атомы водорода в положениях . 20
4а и 9Ь находятся в транссоотношении друг к другу;
Х и У вЂ” одинаковые или разные и означают каждый водород или фтор; 25
2 — водород, фтор или метоксил;
М вЂ” -С=О или-СН-ОН с
n = --3 или 4, ацилированием 4а, 9Ь-транс-2,3,4,4а, 5,9Ь-гексагидро-l Н-пиридо- (4, З-Ь) ин- ® долов, с последующим восстановлением полученного промежуточного соединения алюмогидридом лития fl)
Указанные соединения обладают транквилизирующим действием. 35
Целью изобретения является разработка способа получения одного из оптических изомеров соединений указанной общей формулы с правовращающим фрагментом формулы
45 обладающего более сильным транквилизирующим действием.
Поставленная цель достигается тем, что согласно способу получения транс-2-эамещенных-5-арил-2,3,4,4а, 5,9Ь-гексагидро-lН-пиридо(4,3-Ь)индолов общей формулы (I) Изобретение относится к получению новых правовращающих производных, транс-2-замещенных 5-арил-2,3,4,4a,5,9Ь-гексагидро-1Н-пири до(4,3-Ъ) индолов, обладаницих S транквилизирующими свойствами.
Известен способ получения рацемйческих 2-замещенных 5-арил-2,3,4,4а
5,9Ь-гексагидро-1Н-пиридо(4,3-Ь) индолов общей формулы
Z — (г)п-М (Ay) У где атомы водорода в положениях 4а и
9Ь находятся в транссоотношении друг к другу; .Х и У вЂ” одинаковые или разные и обозначают водород или фтор;
Z — - водород, фтор или метоксил; ив
М—
Зили 4, 0Н
C (" или их
0Н
О смесь, или соединение общеи формулы (II) -(сн,)>- сн
I он этерифицируют оптически активной кислотой — трет-бок-L-фенилаланином в инертном растворителе при темпера-, туре от О С до комнатной в присутствии дициклогексилкарбодиимида, разделяют диастереомерные эфиры, правовращающие изомеры извлекают, гидролиэуют и, в случае необходимости, для.получения соединений формулы (7) когда М вЂ” С = О, окисляют хромовой кислотой.
До разделения диастереомерных эфиров действием молярного избытка трифторуксусной кислоты удаляют
2-бутилоксикарбонилэащитную группу.
Полученную смесь диастереомеров разделяют методом фракционной кристаллизации или хроматографии.
Предпочтительным методом разделения является колоночная хроматография на силикагеле.
Найдено, что соединения такого типа, у которых часть 5-арил-2, 3, 3
4,4а, 5, 9Ь-гексагидро-1Н-пиридо(4,3-b) индол (А) является правовращающей, более высокоактивны, чем соединения, у которых указанная часть (А) является левовращающей.
П р и и е р 1. Хлористоводород. ный dР-транс-8-фтор-5-(n-фторфенил)-2- (4-окси-4-(n-фторфенил)бутил)-2,3,4,4а,5,9Ь-гексагидро— 1H-пиридо(4,3-Ь) индол и хлористоводородный транс-8-фтор-5-(и-фторфенил)-2-(4-(n-фторфенил)-3-бутенил)-2,3,4,4а,5,9Ь-гексагидро-1Н-пиридо(4,3-Ь) индол.
В реакционный сосуд емкостью
1000 мл, оборудованный магнитной мешалкой и капельной воронкой и поддерживаемый в атмосфере азота, помещают 177 мл 0,94 М борана и в тетрагидрофуране. Раствор охлаждают на ледяной бане и к холодному раствору добавляют в течение 30 мин раствор.25 r (0,0555 моль) 8-фтор-5-(п-фторфенил)-2-(4-окси-4-(п-фторфенил)бутил)-2,3,4,5-тетрагидропиридо(4,3-Ь) индола в 295 мл тетрагидрофурана. Полученную смесь перемешивают при температуре окружающей среды в течение 20 мин, затем нагревают с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают, упаривают в вакууме и получают жидкий остаток.
К нему добавляют смесь 50 мл уксусной кислоты и 50 мл 5 н. соляной кислоты, после чего происходит энергичное выделение газа, Смесь нагревают с обратным холодильником в течение 1 ч, охлаждают до комнатной температуры и фильтруют.
Фильтрат охлаждают на льду и подщелачивают путем добавления 50Х-ного (вес/вес) раствора гидроксида натрия.. Основную смесь экстрагируют дважды 150 мл порциями хлороформа, соединенные органические слои высушивают над сульфатом магния и выпаривают досуха в вакууме, получают желтое твердое вспененное вещество, 25 r. При помощи тонкослойной хроматографии на силикагеле с применением системы растворителя гексан/этилацетат 1:1 (по объему) установлено наличие двух продуктов. Вспененное твердое вещество хроматографируют на колонке с силикагелем и элюируют смесью
1168094
45
50 представляет собой диастереомер.
II p и м е р 3. Хлористоводородный с11-транс-5-фенил-2(3 -(n-фторбензо55 ил)пропил -3,4,4а,5,9Ъ-гексагидро-1Н-пиридо(4,3-Ь) индол.
В реакционный сосуд емкостью
25 мл, оборудованный магнитной мешал5
35 гексан/этилацетат 1:1 (объем) с контролем фракций при помощи
-ТСХ. Фр акции, содержащие только более подвюкный продукт, т.е. 8-фтор-5-(n- горфенил)-2-(4-(n-фторфенил)-Э-бутенил 1-2,3,4,4а,5,9Ъ-гексагидро-iH-пиридо(4,3-Ь) индол, выпаривают досуха, растворяют в ацетоне и превращают в хлористоводородную соль путем добавления безводного хлористого водорода в ацетоне. Полученное более твердое вещество отделяют фильтрованием, высушивают, получают 1,5 г .
Э-бутенил.соединения. Т.пл. 270—
273 С.
Фракции, содержащие только менее подвижный 8-фтор-5-(n-фторфенил)-2— (4-окси-4-(n-фторфенил)бутил -2,3, 4,4а,5,9Ь-гексагидро- IH-пиридо(4,3-Ь) индол, выпаривают, растворяют в этиловом эфире и превращают в хлористоводородную соль путем добавления безводного хлористого водорода..
Получают 10,8 г этого продукта в виде смеси двух, диастереомеров, Т.пл.
241-245 С.
Содержание более подвижного Э-бутенил соединенйя возрастает до 100Х при соответствующих повышении кислотности и увеличении продолжительности нагрева с обратным холодильником в смеси уксусная кислота/соляная кислота.
Пример 2. Процесс проводят аналогично примеру 3, но с применением в качестве исходного вещества
8-фтор-5-(о-фторфенил)-2-(4-(n-фторфенил)бутил -2,3,4,5-тетрагидропи,ридо(4,3-b) индола.Быстрее движущийся через силикагель при хроматографии компонент идентифицирован как транс-8-дафтор-5-(о-фторфенил)-2 4†(п-фторфенил)-3-бутенил) -2,3,4,4а, 5,9Ь вЂ” гексагидро-1Н-пиридо(4,3-Ь) индол. Т. пл. 141 142 С.
Медленнее движущийся компонент идентифицирован как транс-8-фтор-5-(о-фторфенил)-2-(4-окси-4-(п-фторфенил)бутил -2,3,4,4а,5,9Ь-гексагидро-1Н-пиридо(4,3-Ъ) индол.
Т.пл. 195-197 С. Каждый продукт
1168094 кой и йоддерживаемый в атмосфере . азота„ помещают 0,828 ип (8,0 г, 10,3 ммоль) безводного пиридина и
10 мл дихлорметана. К раствору добавляют 517 мг (5,17 ммоль) триоксида 5 хрома и полученную темно-красную суспенэию перемешивают в течение
15 мин при комнатной температуре.
Добавляют одной порцией раствор
359 (0,862.ммоль) свободного основания df-транс-5-фенил-2- (4-оксиС-4- (n-фторфенил) бутил)-2,3, 4,4а,5, 9Ь-гек с а гидро-1Н-пиридо (4, 3-Ь) индола
" в 5 MJI дихлорметана. Реакционная смесь быстро превращается в коричневую суспензию. Ее перемешивают при комнатной температуре в течение
30 мин. Нерастворимое вещество отделяют фильтрованием, промывают дихлорметаном и соединенные фильтраты и промывные воды экстрагируют
20 мл 10%-ного раствора гидроксида натрия. Органический слой сушат над сульфатом магния и выпаривают досуха в вакууме, получают смолу. Смолу 25 очищают методом колоночной хроматографии на силикагеле, элюируя смесью
1: 1 (по объему) гексан/этилацетат.
Фракции, содержащие требуемый продукт, соединяют, выпаривают до получения желтой смолы, смолу растворяют в этиловом эфире и обрабатывают безводным хлористым водородом. Полученную суспензию выпаривают досуха, суспендируют в 3 мл холодного дихлор35 метана. Образуется бесцветное твердое вещество, которое отделяют фильтрованием и сушат, получают 20 мг указанного соединения. Т. пл. 244246,5 С.
Пример 4. Хлористоводород. ный dl-транс-8-фтор-5-(n-фторфенил)-2-(3-(n-фторбенэоил)пропил)-2,3,4,4а, 5,9Ь-гексагидро-1Н-пиридо(4,3-Ь)индол.
В колбу емкостью 100 мл, содержа- 45 щую 20 мл дихлорметана и 1,76 мл (21,9 ммоль) пиридина добавляют
1,09 г триоксида хрома и полученную темную суспензию перемешивают в течение 15 мин. Затем добавляют одной 50 порцией раствор 824 MF(1,82 ммоль) свободного основания dg-транс-8-фтор-5-(n-фторфенил)-2-$4-окси-4: -(п-фторфенил)бутил)-2,3,4,4а,5,9Ьгексагидро-1Н-пиридо(4,3-Ь) индола 55 (полученного иэ хлористоводородной соли путем подщелачивания водного раствора гидроксидом натрия, экстрагирования дихлорметаном и выпаривания экстракта досуха) в 10 мл дихлорметана. Полученную красно-коричневую суспензию перемешивают при комнатной температуре в течение 1 ч и обрабатывают по методике, примененной в примере 10, получают
25 мг требуемого продукта. Т.лл.
260-263 С.
Пример 5. Разделение диастереомеров dE-транс-8-фтор-5-(n-фторфенил)-2-(4-окси-4-(п-фторфенил)бутил)-2,3,4,4а,5,9Ь-гексагидро-1Н-пиридо(4,3-Ь) индола.
А. 5 r смеси диастереомеров хлористоводородного dX-транс-8-фтор-5-(n-фторфенил)-2-1"4-окси-4-(n-фторфенил)бутил)-2,3,4,4а,5,9Ь-гексагидро-1ф-пиридо(4,3-Ь) индола, полученного в примере 3, превращают в свободное основание путем распределения между метиленхлоридом и
10Х-ным водным раствором гидроксида натрия. Органическую фазу сушат (Na, S04 ) и выпаривают до образования пены, которую растворяют в 12,5 мл этилацетата и 45 мл гексана прй температуре кипения смеси. После охлаждения в течение ночи выпавший в осадок продукт отделяют фильтрованием и получают 2,24 r продукта. Т.пл.126129 С. Его перекристаллизовывают трижды из смеси этилацетат/гексан и получают 1,22 г одного диастереомера. Т.пл. 1 32-134 С. Это свободное
О основание превращают в хлористоводородную силь путем добавления эфирного раствора хлористого водорода к раствору свободного основания в метаноле и получают 1,30 г, Т.пл. 259-260 С. о
Жидкостный хроматографический анализ при высоком давлении показал, что данный продукт является o(t1 -диастереомером > 99%-ной чистоты.
В. Маточный раствор после первой кристаллизации выпаривают до.получения смолы, растворяют в этиловом эфире и превращают в хлористоводородную соль путем добавления эфирного раствора хлористого водорода.
Оставшееся твердое кристаллическое вещество перекристаллизовывают трижды из смеси ацетонитрил/метанол и получают 1,03 r.âòoðoão диастереомера, обозначенного как / 3 -диастереомер. Т. пл. 237-239 С. Жидкостный хроматографический анализ при высо! 168094 ком давлении показал, что данный продукт содержит около 95 вес.7. чистого (3 -диастереомера.
Пример 6. Разделение диастереомеров df. — транс-8-фтор-5-(n-фтор- 5 фенил)-2ã (4-окси-.4-(n-фторфенил)бутил1-",3,4,4а,5,9Ь-гексагидро — 1Н-пиридо(4,3-Ь)индола.
А. Разделение К 3-диастереомера на IX, -энантиомер и P этантиомер.
Раствор 2,40 r (5,3 ммоль) рацемического, -диастереомера, полученного как описано, и 2,0 г. (7,5 ммоль) N-трет-бутоксикарбонил-L ôåHèëàëàíHíà в 80 мл хлороформа охлаждают на ледяной бане в атмосфере азота. К перемешиваемому раствору добавляют 1,55 г (7,5 ммоль) дициклогексаилкарбодиимида и полученную смесь перемешивают в течение 1 ч 20
8 при 0 С и еще в течение 1 ч при комнатной температуре. Выпавшее в осадок твердое вещество (мочевину) отделяют фильтрованием и промывают метиленхлоридом. Фильтрат и промывные воды 25 выпаривают в вакууме и остаток хроматографируют на силикагеле, элюируя смесью 5:1 (по объему) метиленхлорид/ этилацетат. фракции, содержащие эфиры
N-трет-бутоксикарбонил-1тфенилаланина3р соединяют и выпаривают в вакууме и получают 2,5 r белой аморфной пены.
К этой пене добавляют 30 мл безводнои трифторуксуснои кислоты при 35
0 C и смесь перемешивают на ледяной бане в течение 30 мин, за это время происходит растворение. Трифторуксусную кислоту удаляют выпариванием в вакууме и вращающемся ис- ф парителе без внешнего подогрева колбы. Оставшееся твердое вещество растворяют в холодном метиленхлориде и промывают холодным
1Х-íûì (вес/вес) водным раствором бикарбоната натрия до появления нейтральной реакции на индикаторной рН-бумаге. Нейтральный органический слой сушат (MgSO@), растворитель выпаривают и получают 1,6 г бледно- у желтой смолы. Смолу очищают хроматографией на 40 г силикагеля Ме сК
230-400 меш, элюируя смесью 35:1 (объем) этилацетат/метанол. Фракции, содержащие Ь-фенилаланиновый эфир у
К-энантиомера, .и фракции, содержащие L-фенилаланиновый эфир 3 -этантиомера, разделяют, выпаривают досуха в вакууме и получают 636 и
474 мг соотве тственно.
Перемешиваемый раствор 625 мг
L-фенилаланинового эфира Ы -энантиомера в 10 мл метанола при комнатной температуре ббрабатывают 10%-ным водным раствором гидроксида натрия до помутнения, затем перемешивают в течение 30 мин при комнатной температуре. Удаляют метанол выпариванием при пониженном давлении, затем добавляют 10 мл воды. Водную суспенйзию экстрагируют метиленхлоридом и соединенные органические слои сушат над сульфатом магния.
После выпаривания растворителя получают бледно-желтую смолу, которую растворяют в ацетоне (5 мл), обрабатывают избытком эфирного раствора хлористого водорода, из которого кристаллизуется в виде пластинок хлористоводородная соль правовращающего оС -энантиомера, 380 мг
Т.пл. 251-255 С;(K) z) = +32,2 (С = 1,67 в метаноле).
В результате гидролиза L-фенилаланинового эфира Р -этантиомера (474 мг полученного продукта) аналогичным образом получают левовращающий Р -энантиомер хлористоводородного 8 — фтор-5 †(и-фторфенил)—
-2- Р4-окси-4-(n-фторфенил)-2,3,4, 4а,5,9Ь-гексагидро — 1Н-пиридо(4,3-Ь) индола. Т.пл. 252-255 С.. (w) = 33,0 (С = 1,67 в метаноле).
Анализ методом жидкостной хроматографии при высоком давлении показал, что чистота оь -энантиомера и
Р-энантиомера составляет 99Х и более.
B. Разделение 3 -диастереомера на и 3 -энантиомеры. 3 -Диастереомер транс-8-фтор- 5†(n-фторфенил) -2-14-окси-4-(n-фторфенил)бутил1-2,3,4,4а,5,9Ь-гексагидро-iH-(4,3-Ь) индола взаимодействует с N-трет-бутоксикарбонил-L1
-фенилаланином, затем полученный эфир
t-бок-L-фенилаланина взаимодействует с трифторуксусной кислотой дпя удаления аминозащитной (t-бок) группы. Затем эфиры аминокислоты хроматографируют для разделения L-фенилаланиновых эфиров -энантиомера и 6 -энантиомера как описано в части А примера 6. Затем разделенные — и р -эфиры гидролизуют отдельно и очищают с целью получения правовращающего g -энантиомера .
9 1168094 и левовращающегося - энантиомера в виде хлористоводородных солей по мето дике, описанной в части А примера 6. -Энантиомер: т.пл. 240-248 С (разл.); (и) = +3,1 (С = 1,67, метанол) . о -Энантиомер: т. пл. 240-248 С (разл. ) (p) > = -2,7 (С = 1,67, метанол).
Анализ методом жидкостной хроматографии при высоком давлении показал, 10 что чистота -энантиомера. составляет около 95Х, а о -энантиомера — 977.
Меньшая чистота этих энантиомеров ожидается вследствие загрязнения. выше упомянутого ) f -диастереомера C((3 -диас15 тереомером.
Транквилизаторы согласно изобретению характеризуются снятием таких проявлений шизофрении у человека, как галлюцинации, враждебность, подо 2п зрительность, эмоциональный или соци. альный уход, тоска, волнение и напряженность. Стандартный метод определения и сравнения транквилизирующей активности соединений этого ряда, д для которых имеется отличное соотношение с человеком, заключается в опре делении антагонизма к вызванным амфетамином симптомам у крыс, по Вайсману
Группы из пяти крыс были помещены Зо в закрытую пластмассовую клетку размерами приблизительно 26к42х16 см.
После непродолжительного периода акклиматизации в клетке крысам каждой группы вводили подкожно (п.к.) испытуемое соединение. Затем спустя 1,5и
25 ч им давали интраперитонально (и.п) d-амфетамисульфат, 5 мг/кг, Через 1 ч после введения амфетамина
- г Г наблюдали поведение каждой красы .На 40 основании данных о поведении после ам фетамина с учетом дозы можно определить эффективную дозу испытуемого соединенйя, необходимую для подавления или блокирования характерного амфетаминного поведения — движения по клетке — для 50Х подопытных крыс (ED ). Выбранное время оценки совпаденйе с пиковым действием амфетамина, составляющим 60-80 мин после его вве.5О дения.
55
По описанной методике некоторые
4а,9Ь-транссоединения испытаны на способность блокировать поведение под действием амфетамина. Результаты приведены в виде EDyg за бпределенное время.
Результаты, полученные для смеси диастереомеров таких соединений,. у которых R содержит вторичную спиртовую группу, и с отдельными диастереомерами других 4а,9Ь-транс-гексагидропиридоиндолов-представлены в табл, 1.
В табл. 2 приведены результаты опытов, в которых предлагаемые соединения, описанные в части А примера 6, сравниваются с соответствующими 3 -замещенными 5-арил-1,2,3,4-тетрагидропиридо(4,3-Ь) индолами (патент США У 4 001 263). Для каждой пары приведены сначала результаты, полученные с известным соединением (а), затем с предлагаемым соединением (Ь). В тех случаях, где это указано, испытуемое соединение вводили также орально (п.о) и опыты проводили в течение 48 ч.
В табл. 3 приведены результаты опытов, полученные разделенными диастереомерами0с/1- и у3 — и каждым из энантиомеров g, P, g и 3 .
В каждом случае соединения имеют формулу
В табл, 4 представлены значения
ЕП (мг/Kl) полученные с очищенными к, 3, g и 8 -энантиомерами. приведенной формулы, но полученными путем синтеза. Опыты проводили в течение 72 ч.
Ингибиторы связывания Н-спироперидола допаминовыми рецепторами.
Методика и результаты испытаний.
Показано, что относительное средство лекарств к участкам свя1168094
)2 эывания допамина взаимосвязано с их относительной фармакологической способностью действовать на поведение, вероятно, посредством допаминэвых рецепторов, Лучшее 5 исследование связывания нейролеп4 тических рецепторов проведено Лей-, зоном с применением H-спироперидола (спиперона) в качестве меченого лиганда. Была применена следующая методика.
Крысы-самцы 250-300 г были обезглавлены, и мозг немедленно препарировали на охлажденной льдом стеклянной пластинке для удаления полосатого тела (100 мг/мозг).
Ткань гомогенизировали в 40 объемах (1 r + 40 мл) охлажденного льдом 50 мМ Трис(трис-оксиметиламинометана); буфер THAM«HCI, рН ч
4,7. Гомогенат центрифугировали дважды при 50000 r (20000 об/мин) в течение 10 мик с повторной гомогенизацией промежуточного осадка в свежем буфере THAM (таком же 25 объеме). Конечный осадок осторожно суспендировали в 90 объемах холодного приготовленноro (срок хранения менее одной недели) 50 мМ буфера
Tris — рН 7,6, содержащего 120 мМ 3{) хлорида натрия (7,014 г/л), 5мМ хлорида калия (0,3728 г/л), 2 мМ хлори да кальция (0,222 г/л), 1 Мм хлорида магния (0,204 г/л), 0,1 аскорбиновой кислоты (1 мг/мл) и 10 мкМ паргилина З (100 мкл смеси/100 мл буфера; исходный раствор = 15 мг/10 мл бидистиллировакной воды). Аскорбиновую кислоту и паргилин добавили свежеприготовленными. Суспензию ткани поместили 4О в водную баню при 37 С на 5 мин для
С обеспечения дезактивации моноаминоксидаэы ткани и затем до употребле:ния держали на льду. Инкубационная смесь состояла иэ 0,02 мл раствора .ингибитора, 1,0 мл гомогената ткани и 0,10 мл меченого индикатора (Н- .
-спироперидол, New England nuclear
23,6 кюри/ммоль), приготовленного так, ч"обы получить 0,5 HM в конечной инкубационной среде (обычно разбавля - 2,5 мкл исходного раствора
17 мл бидистиллированной воды). Про. бирки инкубировали в течение 10 мин при 37 С партиями по три, после чего 0,9 мл от каждой инкубационной пробирки фильтровали через фильтры
Whatman GF/Â с применением высоковакуумного насоса. Каждый фильтр поместили в сцинтилляционную ампулу в нее добавили 10 мл жидкого сцинтилляционного фтора и каждую ампулу подвергли энергичному завихрению в течение приблизительно 5 с. Пробы оставлены на ночь, чтобы фильтры стали прозрачными, затем оки снова были подвергнуты завихрению, и затем в течение 1,0 мин подсчитали радиоактивность. Связывание ° рассчитывали как фентамоли (10 моль) H-спироперидола, связанные 1 мг про теина. Опыты с контрольными растворами (носителр или )-бутакламол, 10 Г1; 4,4 мг растворили в 200 мкл ледяной уксусной кислоты, затем разбавили до 2,0 мл бидистилли >ованной водой для получения 10 М исходного раствора и хранили а холодильнике), растворами слепых проб (d-бутакламол, 10 М; ™ на
) 2мл
10 М исходного раствора, так же, как для 1-бутакламола) и растворами ингибиторов повторяли по три раза.
Концентрацию, при которой связывание уменьшалось на 50 (ИК О), оценивали на полулогарифмической бумаге.
Нерастворимые лекарства растворяли в 50 -ном этаноле (инкубация в 1 -ном этаноле}.
Результаты, полученные с различными формами хлористоводородного транс-8-фтор-5-(n-фторфенил)-2-) 4-окси-4-(n-фторфенил)бутил) -2,3,4, 4,а,5,9b-гексагидро-iH-пиридо (4,3-Ь)индола, представлены в табл.5.
11б8094!
Таблица 1
ЕР мг/кг,, за время, ч
4 24.. С Н СН-(СНз)з
ОМ п-FCü Н4 Н (СН ) ОН п-СН ОС Н СН-(СН ) 6 4 4
0Н
О, 032-0, 1 О, 1-0,32
0,032-0 1
Н Н
0,1-0,32
0,1-0,32 0,1-0,32
01032 пь10
Н Н
О, 1-0,32
Н Н и-FC Н С-(СН )— б 4ц 2 з
О п-Фт ор C CH- (CH ) ,оН
Р о-Фтор, п-РС Н4 СН-(СН )
ОМ
F и-Фтор п-ЕС Н 1 Н-(СН,), ОН
F n-Фтор п-СН,ОС Н СН-(СН,)з
ОН
F п-Фтор и-FC Н С -(СН )
6 4ц
О
Н/Ь/ Н Н
0,1-0,32 О;32
0,32 (0,32
Ф
<0,32
0,1-0,32
0,1-0,32 (О 32 0.0,32
0,032-0, 1 0,032-0, 1
0,032-0,1
0,1-0,32 0,1
<1,0 (0,32
<1 О с1,0
3,2-32
)3,2
)32
Не испытан
Н/Ъ) Н
-1 0
3,2
С,Н
Н/Ь/ Н СН СН,—
+10
3,2-32
3;2-10
3,2
Н/Ь/ И С Н (СНз)з цис-9- (3-(4-метил-1-пиперазинил)пропилиден)-2-(диметилсульфонамидо)- тиоксантен***
3,2-10
0,32-1,0
32
* Найдено, что для соответствующего аналога 4а,9Ъ-цис ED = 56 мг/кг при времени наблюдения 1 час.
** Патент США У 3 991 199
***Патент США 9 3 310 553.
1168094
16
Таблица 2 м
Ев„„cr/кг, sa вренгг, ч
Способ
Соединение
R введе4а
1 5 24
С Ы СН-(СН ) он (a) 3,2-!О (б) О 032-0 ° 1
3i2- IO
0,032-0, 1
Oi l-З,2!
O,I-О,З2
I 0-3,2 и.п. и-FC Н СН-(СЫ ) !
Ои
3,2-1,0 и.п
О, 1-О,32 и. и.
0,032-0,! 0,032-0,f.0,32-1,0
О,! 0,32 I 0-З ° 2
0,1-0,Э п. о. п.о. и. и. и.п. и-PC Û1Ñ(СН, ) г0
P и"P
>10 (1,0 а 1,0
>f0 и-FC Н СН-(СН )
6, г г
ОН
1-3,2 и. и. са O,f са 0,1
a,î.
ED мкг/кг, sa время, ч
1 (5
Соединение
32-100
32-100
32-100
32-100
32-00
32-100
+32,2 120.-33,0 >1000
32
>1000
>1000
32-100
32-!00
32-100
32-100
320-1000
+3, 1 180 о о
-2,7 1000
560
ED<0, мг/кг, sa время, ч
Т Е Т
Энантиомеры
24 48 72
1 5
0023 0014 0033 са1
+30, 1
>1О о
-33,7
5, 7 7t,10
>10
>10
+1,7
О, 178 0,045 0,018 са о
-2,7
5, 7 .>10
>10
>10 >10
Смеси диастереомеров (a) 0,1-0,32 (б) 0,032-0,1 (a) 1-3,2 (6) o,з2-1,о (а) 3,2-10 (б) . 0 (а) 0,32-1 (б) О, 1-Oi 32 (б) а!
Таблица 3. ч
Таблица 4
1168094
Таблица. 5
Соединение
Подавление связывания Н-спиропериодола, мП (ИК ) Смешанные вК/1- и. g 8 -ди.астереомеры по i примеру 1
В,(-Диастереомер по примеру 5 °
Правовращающий ф -энантиомер по примеру 6
23
Левовращающий -энантиомер по примеру 6
1800 ф -Диастереомер по примеру 5
Нравовращающий $ -энантиомер
-по примеру 6
Левовращающие 3 -энантиомеры по примеру 6
30
Составитель И. Бочарова
Редактор Т. Колб Техред Т Маточка Корректор Л. Бескид
Заказ 4448/56 Тираж 384 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал IIIIII "Патент", r. Ужгород, ул. Проектная, 4