Способ хранения биологических проб животного происхождения для определения глутатиона
Иллюстрации
Показать всеРеферат
СПОСОБ ХРАНЕНИЯ БИОЛОГИЧЕСКИХ ПРОБ ЖИВОТНОГО ПРОИСХОВДЕНИЯ ДЛЯ ОПРЕДЕЛЕНИЯ ГЛУТАТИОНА путем предварительного обезбелачивания пробы сульфосалициловой кислотой, отличающийся тем, что, с целью увеличения сроков хранения, в обезбелаченную пробу добавляют .0,651 ,0 кратный объем 510 М раствора хлористой ртути с последующим доведением рН реакционной смеси до 2,5- 6,0.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (! 9) (11) (5!)4 G 01 N 33/48
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPCKOMY СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21j 3591357/28-13 (22) 08.02.83 (46) 23.07.85. Бюл. Р 27 (72) M.À. Иехтиев, Е.Г. Гаузер, Б.Ф. Керимов и Е.В. Драгунова (71) Институт физиологии им.А.И.Караева (53) 6 12.115(088.8) (56) Anafyt, Biochem. 1968, 25, р. 192-205., (54)(57) СПОСОБ ХРАНЕНИЯ БИОЛОГИЧЕСКИХ ПРОБ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ
ДЛЯ ОПРЕДЕЛЕНИЯ ГЛУТАТИОНА путем предварительного обезбелачивания пробы сульфосалициловой кислотой, отличающийся тем, что, с целью увеличения сроков хранения, в обезбелаченную пробу добавляют 0,651,0 кратный объем 5 ° 10 М раствора хлористой ртути с последующим доведением рН реакционной смеси до 2,56,0.
1168861
Изобретение относится к биологии и медицине и может быть использовано при диагностических исследованиях.
Целью изобретения является уве- 5 личение сроков хранения.
Пример 1. К О, 1 мл цельной гепаринезированной крови крысы добавляют 0,6 мл 10Х-ного раствора сульфосалициловой кислоты (1:6).
Смесь перемешивают и после 10-минутного стояния центрифугируют при
5000 об/мин в течение 10 мин. Объем надосадочной жидкости считается равным сумме объемов соответствующих
Ъ компонентов (0,7 мл). К нему добавляют равный объем (0,7 мл) 5 10 Ъ раствора Н8СХ и затем устанавливают рН реакционной смеси до 4,0 0,1 н раствором NaOH или Ca(OH)> .. Пробу 2О хранят в плотно закрытом флаконе
60 дней. Избыток HgCfz не вошедшего с глутатионом в реакцию, определяют обратным амперометрическим титрованием 1 10 М раствором цистеина.
По разности между внесенным количеством НяСР и оттитрованным в конце определения находят содержание глутатиона в пересчете на 100 мл цельной крови по формуле 30
1o0 (v -v )
Va где Q — - содержание глутатиона на
100 мл цельной крови, мкмоль, V . - объем 5 ° 10 М раствора Н8СР, З5
-4 предварительно добавленного к цельной крови, мл
Ч вЂ” объем 5 10 М раствора НяСР, непрореагировавшего в реак- 40 ционной смеси, определяемый графическим путем, мл,"
V — объем цельной крови, взятой для анализа;
500 Mr ткани почки крысы гомогени-4 зируют с 4 мп 10Х-ного раствора сульфосалициловой кислоты (1:8). Смесь перемешивают при 5000 об/мин в течение 10 мин. Объем надосадочной жидкости равен сумме объемов соответствующих компонентов (500 мг = 0,5 мл, V=0, 5 мл+4,0 мл=4, 5 мл), к нему добавля-, ют 3,5 мп 5 ° 10 М НяСР и затем устанавливают рП реакционной смеси до 4,0
О, 1 н раствором NaOH или Ca(OH)>..
Пробу хранят в плотно закрытом флаконе 60 дней. Затем избыток ионов
Hg не вошедших в реакцию с глута21 тионом,. определяют обратным амперо-э метрическим титрованием 1 10 М раствором цистеина.
По разности между внесенным количеством HgCI> и оттитрованным в конце определения находят содержание глутатиона в пересчете на 100 г ткани по формуле
100 (Ч, -Ч,)
У
ga где 0 — содержание глутатиона на
100 г ткани, мкмоль, V — объем 5 ° 10 M раствора HgCE предварительно добавленного к гомогенату тканей, мл, Ч вЂ” объем 5 10 М раствора HgCZ непрореагировавшего в реакционной смеси, определяемый графическим путем, мл, ,„ — вес навески тканей.
Испытуют содержание глутатиона в разных пробах животного происхождения и при других сроках хранения.
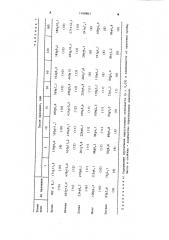
Влияние сроков хранения пробы на определяемость глутатиона (М + m) представлены в табл. 1.
Как явствует из данных, химическая обработка биологических проб животного происхождения раствором
HgCI позволяет хранить их с перво2 начальным уровнем глутатиона в течение 100 дней.
Пример 2. К 0,1 мл цельной гепаринезированной крови крысы добавляют 0,8 мл tOX-ного раствора сульфосалициловой кислоты. После перемешивания и 10-минутного стояния смесь центрифугируют при 5000 об/мин в течени 10 мин. К ней добавляют 0,6 мп
5 ° 10 M раствора HgCI<, устанавливают О, 1 н раствором NaOH рН реакционной смеси 4,5. Пробу хранят в плотно закрытом флаконе 180 дней. Содержание глутатиона в пробе находят так как описано в примере 1. Выбор оптимальных соотношений между объемом надосадочной жидкости и раствором
5 ° 10 М HgCX (М + m) представлен в табл. 2. Полученные результаты свидетельствуют о том, что при химической обработке надосадочной жидкости 0,65-1,0 кратными объемами
5 104М раствора HgCE данные о содержании глутатиона во время хранения проб (180 дней) статистически
1168 недостоверно отличаются от данных до хранения пробы, что является оптимальным интервалом соотношений объема надосадочной жидкости и HgCE
g (V„ ñ. ли4 V HgCE = 1: (0,65-1,0) .
Пример 3. 100мгткани печени крысы гомогенизируют при о
0-4 С с 1 мл 10Х-ного раствора сульфосалициловой кислоты при 800 об/мин в течение 1 5 мин. После 10-минут- 10 ного стояния суспензию центрифугируют при 5000 об/мин в течение 10 мин.
В надосадочную жидкость добавляют равный объем 5 1б М раствор Н8СЮ и 0,1 раствором БаОН или К0Н, или .15
Ca(OH) устанавливают рН реакционной смеси 1,5; 2,0 2,4 2,5; 3,5, 4,5; 6,0; 6,2; 7,0; 8,0; 10,0. Смесь хранят в плотно закрытом флаконе 180
861 4 дней и затем определяют содержание глутатиона как описано в примере 1.
Во всех исследованных тканях крыс (печень, почки, легкие, мозг, надпочечник) при рН меньш . 2,5 получаются заниженные, а при рН больше
6,0 - завышенное дбдержание глутатиона по отношени1о к данным полу-!
Ф ченным до хранения пробы. В интервале рН 2,5-6,0 найденные данные о содержании глутатиона в тканях крыс при хранении пробы до 180 дней недостоверно отличаются (р > 0,05) от данных по содержанию в тканях крыс до хранения пробы. Этот интервал рН (2,5-6,0) является оптимальным в предлагаемом способе хранения биологических проб животного происхождения для определения глутатиона.
1 ф 1 х I л
СЧ. м (М л
Ф.
+I
00 ь л
Г
+1
СЧ
° 0
lO
О
Р (ь
+I ь
0О л
+I
М
0 л
О1
+1
01
0О л О +! О
+1 ь
I
I ь
М л О
+I
С4 О
00 л л
+1 О
Ф
М ь О б
+1 ь
1 — -4
1 ь
1 М
C) л ь л.,О р, О) О\ л
+I
LCl и
С 4 О л
+1 О
01 л
Ф О
М
+!
00 Г л ь
+1
М О л О
+t ь
0О О л
О\
+! ь
4 (4 л л
CV м
Ch ь о 1
°
1
У
I
1
1 O (ч
О л
+! О
С 4
С 4
Ch
+( ь
0О л
+1 О
С 4
С 4 л
+!
0О
О
1
СЧ л
+( (с
t(;
С3 О
+( ь
СЧ
° °
04 л л
+! б
М
С4
М л
+1 О
С4
00 х
I Х
I Ою
04 х
Х
Г.ю
04
Ю и
О
Е л х х х х
0(С4
Х
1 1
I
1 (o
00 1 ь
СЧ ч»
1
i
1 О л
+(01
1 л (+!
Б Ф О л
СЧ
+(0О ( 0
С 4 л
М
+I л 0
«
1168861
СО л
+( О
СЧ
«-( О
00 ь л
0 00 .1-1 ь
С 4 1 !
С
+1
СЧ 1 ь л н а
С 1
СО л г
+1
О1
00 л г», 0O Ch ч:)
+I I л
1 л С(«
+1
М
1 l О л О\
М)
О х и
О
Е х и х
О
О
О х
"х (х Х
Ц(Гч Ф
1168846
Линейные индексы удерживания (3) Кислоты о виде соответствующих эфиров
Известный способ
72,9+3,40
17,6+1,50 б,б
4,7
63,22+1,5 В:л
2,8
8,5 Средняя погрешность измерений
11,2
7,5
С1,(54,47+3,60
Продолжение табл.4
Предлагаемый способ сч I
1 р! 1
1 1!
1 л
I o л № л
CO
Ch м.ф
М м с 3 сч
О
+1 и
Ц цо 1 !
1 ! м с"1
Ю
° е е.ф м л м
+! 3
CO м
Ф с»4 е о
Ф!
»Ф л
3!В О
+!
К) с 3
+сч О
+I
О
Ю
Ф л
О
+l
О сч 1е л м
Ch з!» л м
О о м е1е
chI
ФЧ л м
+I!
С4
Ch л
° \
CO
A л
+1
О
+I м л
+(IA
О
CV м
Ю
+1 м сч О
Ф О
+!
С4
Ф
Ch л
Ю +1 м л
+I л
Ф л о1
Ф л со
+! О сч ъ!е с 3
° \
CO
Ф
Ю
Ю еО
Н м
»
Ф с л
+! сс
Зф о в
+! с»!
4 сО
° ь сO
+1 л
4 л с0
+I еО еО
Г ь
Ъе
ЪФ сГ) л
° е
+I м
00 №
О
° ь лъ
+! ь еО (Ю
° ь л
° е
CV
Ю о
+1
Щ ь с»! ж ф
С4 х о с . О
Ю л»
+1 м сч л л
+1 со
1, i1
1 с4 г
Ф ф
О фьС ее и ж
o1o ф a ! 1
Q ее ф »в
X Ф ! о (I I ! Ю
>Ж 1 о1I
Р1- — -1
2! !!О
О I O
g I O
1 сс!
X I
Ф I I
Р I I
lo I м 1 о
I 1
Ф I o 1
1 - I
Ж l
Е» 1 о I л о ! Ю
° е
» г — — (!
X I
Э I
1168861
I х о с»
Ц о
I" ° ф о о щ
Ю.О" 5
Ю 6 е а
:о
9 l Ill
i I»
v о I с о сф ° a Q р оа цЙо
a ) 5
1168846