Способ получения аналогов линкомицина и клиндамицина
Иллюстрации
Показать всеРеферат
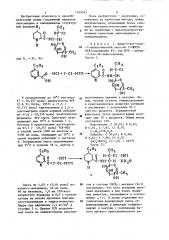
СПОСОБ ГОЛУЧЕИМ АНАЛОГОВ ЛИНКОМИЦИНА И КЛИНДАМИЦИНА общей формулы Сн. Л I о (I с 1JH-CH N Н Wсн . ОН где R - этил или бутил, отличающийся-тем, что в присутствии катализатора гидрируют соединение общей формулы ,
СОКИ ООВЕТСНИХ
Ш I IN lit lk
РЕСПУБЛИК (1% (И) ГОСУ АРСТВЕНН HOM
4 bN ИТЕТ ССОР
Л\Ю ЭЕЙ и й
ОПИСАНИЕ ИЗО6РЕТЕНИЯ
К ПАТЕНТУ вЂ” в-сн, ° ОН
СОХ (21) 3444858/23-04 (62) 3210609/23-04 (22) 19.08.81 (23) 21. 11. 80 (31) 096652, 148 056 (32) 23. 11. 79, 19.05. 80 (33) US (46). 23.07 ° 85. Бюп. 9 27 (72) Роберт Дейвид Виркенмайер (US) (71-) Две Апдлюн Компани (US) (53) 547.458.2(088 ° 8) (56) Патент CRA Р 3496163, кл. 260-210, 1970.
Augustine R. L„ Catalytic Hydrogenatoin. Marcel Pekker INC. N-У, 1965, р. 104-106. (бР+С 07 Ц 5 08 15/Ûß4.,3j1 К 31/445 (S4) (57) СПОСОБ ПОЛУЧЕНИЯ АНАЛОГОВ
Ш Ю* формулы Я (-Н
Ъ
0 Н -а
Н
С- Н-СН где R< — этил или бутил, отличающийся -тем, что в присутствии катализатора гидрируют соединение общей формулы где К„ имеет укаэанные значения
Х вЂ” 7 fS f — хлорметил-t-тио- о(-линкосаминид.
Пр корит ет; по приз на к ам:.
23.11.79 при R - этил:
19.05.80 при R„бутил.
1169543 ной формулы Я
СН
О HC-C1
II 1
МН-СН
Пример 1. Амид-4-Нис-этил10 -1-пипеколиновой кислоты 7-CgMTJI
НС (соединение У), где МТЛ вЂ” метил-1-тио- о -линкосаминад.
Часть 1. 3
ОН где К Et, Bu.
С,Н, О - He1+ +7-С1 — МТЛ
С.
ОН
-СН
С,ц (2Н 5 о ясов
II
М
С+ 7- С1-ИХЛ ИЗ
0Н
50 ках в системе CHCE . метанол (6:1) показывают, что весь исходный материал превращен в два более полярных вещества, находящихся в соотношении 1:1. В целях отделения ка55 тализатора реакционную смесь отфильтровывают и фильтрат концентрируют в вакууме с получением белого мягкого кристаллического ве1
Изобретение относится к способу получения новых соединений аналогов линкомицина и клиндамицина структурК охлажденному до 10 С раствору
67 r (0,357 моль) аминокислоты НС9 (С,А 51,1643а, 1957) и 71,5 r (0,714 моль) тризтиламина в 2,5 л ацетонитрила одной порцией добавляют 47,6 r (0,354 моль) изобутилхлор;формиата. Эту смесь (раствор) перемешивают при 10 С в течение 1 ч. о
Раствор Б приготовляют растворением 97,7 г (0,357 моль) 7С9-МУЛ в теплой смеси 1500 мл ацетона и
1500 мл воды, охлаждают до 30 С и одной порцией добавляют к раствору
А. Реакционную смесь перемешивают при 25 С в течение 18 ч, ацетон и
Смесь из 4,05 r (0,01 моль) исходного материала, 40 мл воды, 60 мп метанола, 1,0 мл 37Х-ного хлористого водорода и 8,0 г катализатора на основе двуокиси платины восстанавливают в гидрогенизаторе
Парра под давлением 3,4 кг/см в течение 3 ч. Данные ТСХ реакционной смеси на силикагелевых пластин2
Цель изобретения - получение, основанное на известном методе, новых антибиотиков, обладающих более сильными бактериостатическими свойствами по сравнению с широкораспространенными аналогами линкомицином и клиндамицином. ацетонитрил удаляют в вакууме. Белый, мягкий остаток отфильтровывают и кристаллическое вещество собирают и высушивают с получением 95 r чистого продукта, Переработкой фильтрата путем хроматографии получают еще 10 г продукта. Общий выход составляет 73Х.
Подсчитано: С 50,42; Н 6,22;
И 6,92, S 7,92, CI 8,76.
С Н 5 СИЯО 5 °
Найдено: С 50,67; Н 6,40;
N 6,64; S 7,90; CI 8,70. (el CHCCI: (С-1,0) + 293 С
Часть II.
1169543 4 превращают в свободное основание, хроматографируют на еиликагеле с использованием в качестве растворителя СНС! метанол (6:1).
Получают менее полярный из двух, упомянутых в части II, продуктов.
Его превращают в хлористоводороднокислую соль и перекристаллизовывают иэ ацетона и воды. Этому изомеt0,ру можно приписать структуру VA
ОН
С2Н5 ч Зтиеризация,О
М С-7-С2-ИТЛ "
С2Н5
vA Зиимеризация О ф ЧС
С - 7- C 2-МТЛ
Сж,Н5 С2П5 р Зпинеризация 0
0Н Ч H Н
vA /идфояиз 2 5
v Ги Цюолиз
g Зпимеризация 0
N м
Он v6 Н Н
3 щества, которое отфильтрбвывают с сохранением получаемого фильтрата.
Белое твердое вещество, оказавшееся более полярным из двух полученных продуктов согласно ТСХ восстановленной смеси, перекристалли-. зовывают из воды, с получением желаемого продукта Ч 57,930 с тд„
222-224 С и выходом 25-35Х.
Подсчитано: С 45,63, Н 7,21, N 6,26; S 7,17; С 15,85.
С17Н92С? я ОНайдено: С 4Е,77; Н 7,44;
N6,,39, S 7,21, CI 16,17. (о )Р Н.О: (С-1 О). +176е
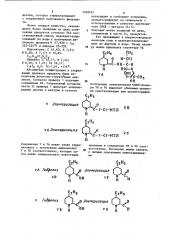
Абсолютная конфигурация и стереохимия целевого продукта были определены рентгено-структурным анализом . Согласно примеру 1 получают соединение VA. Сохраненный согласно части II примера 1 фильтрат концентрируют.досуха в вакууме и остаток
Соединения У и УА можно также гидро- . лизовать с получением аминокислот
У и УЕ соответственно, которые за40 тем можно эпимеризовать известили
С2Н5
О Н-СС1 п l
С-ВН-С-н
К НО О
VA
И-Сн, Получаемые эпимеризацией транос-изомеры УВ и УС выделяют обычными приема ми кристаллизации или хроматографии приемами в соединения VF u VG соответственно. Последние можно связать с любыми описанными линкосаминидами
1169543
C4Hg
О
g-r- d>-мтп
s-eH
ОН (Og Н 2Й2И20ф {Х2Н20) 4Б9 СНз
ИА р
M С- NH- С.п.
Цо О
ОН
{C 1y HggCi Kg0g 8 X Hgg),а
С- -Ci NTB
Пример 2. Амид 4-цио-и-бу1
Смесь 4,0 г (0,0093 моль) исходного материала, 40 мл воды, 40 мл метанола, 2 мл 37Х-кого хлористого водорода и 8,0 r катализатора на основе двуокиси платины восстанавливают с помощью гидрогенизатора Парра при давлении 3,4 кг/см2 в течение 18 ч.
В целях удаления катализатора отфильтровывают реакционную смесь и фильтрат концентрируют в вакууме с получением масла янтарного цвета.
Последнее растворяют в 20 мл раствора CHCt и метанола (2: 1} и в целях нейтрализации присутствующего хлористого водорода добавляют достаточное количество триэтиламина. Этот раствор хроматографируют на силикагеле с применением системы растворителей СНС1 . метанол (2:1). Получают фракции двух главных продуктов. Фракции, содержащие быстрее продвигающийся. материал, собирают и выпаривают в вакууме с получением белой твердой фракции А.
Фракцию А из предыдущего опыта превращают в ее хлористоводороднокислую соль тем же образом, что и фракцию Б. Получают продукт с выходом 25-35Х который на основе данных ЯМР-спектра в основном оказы; тил-L-пипеколиновой кислоты i-CfMTJI;
QQHg ц
) 5
H-С-Ci 1
О с-кн-с-н (х) н а
I 2
П НО
Ъ
Фракции, содержащие медленнее )родвигающийся материал, собирают и выпаривают в вакууме с получением белой твердой фракции Б, которые растворяют в незначительном количестве воды и добавляют достаточное количество 37Х-ного хлористого водорода в целях доведения значения рН до 2. Затем проводят кристаллизацию. Твердый материал собирают и перекристаллизовывают из воды с получением белых кристаллов желаемого продукта с т. пл.
224-226 С и выходом 25-35Х.
Подсчитано: С 47„99) Н 7,63;
30 N 5 89: S 6 75 Ñ 14 92
С,НЗ2С,М,0,8.
Найдено: С 47,97; Н 7,42;
И 6,23, S 6,90; CI 14,87-. а МеОН: + 178а (С-1,0) °
35 Структура подтверждена данными анализа ЯМР-спектра.
П о и м е р 3. Амид-4-q))c-n-бутил-D-пипеколиновой кислоты.7,.-.:O-MTJ1. вается идентичным с продуктом из фракции Б.
Минимальная бактериостатическая концентрация (ИБК) соединения V и клиндамицина относительно аэробиых бактерий представлена в табл.1, 1169543
МБК, мк г/мп
Организм
Штамм ндамицин Соединение Ч
6685
25
0,5
6686
6687
0 25
6688
25
6689
0,5
6690
0,25
6691
-10
6692
>25
>25
6693
78
6694
1 25
>25
6695
-10
-39
6696
39
6675
0,5
0,5
746
40,5
0,5
571
78
570
719
20
3389
20
694
6,25
152 а 0,12
153
С0,5 с 0,12
4 0,12
3213
)50
50
Staphy fococcus aureus
Staphy tococcus
epidermidis
streptococcus faecatis
streptococcus pyogenes
Streptococcus viridans
DipIococcus pneumoniae I
DipIococcus pneumoniae II
Escherichia coIi (0,12
c 0,12 (0,12 (0,12
Таблица 1
1169543
МБК, мкг/мл
Штамм
Организм 50
>50
50
6,25
50
126
50
95.
МЕК,.мкг/мл
Организм
ЧС
Клиндамицин
Соединение Ч
6513
0,06
0,12
6428
0,06
0,25
6864
3,9
2,0
6862
7„8
15,6
2,0
6512
0,5
6518
0,12
0,03
6326
0,06
0,05
247
0,06
0,12
6509
0,06
0,12
6329
0,06
0,12
6508
7,8
7,8
6510
С0,03
0,06
Proteus vuIgaris
KIebsieIIa pneumonia
SaImoneIIa schottmueIIeri
Pseudomonas aeruginosa
Указанные испытания проводятся следующим образом.
Значение МБК обоих соединений относительно аэробных бактерий определяют методом последовательных разведений. В качестве питательной среды используют бульон из мозга и сердца. Пластинки инкубируют при 37 С в течение 20 ч.
Штаммы Saureus VC 6685-6696, выделяющиеся в клинических условиях, Bactегоides fragiIis
Bactегоides meIaninogenicus г
Bactегоides distasonis
Bactегоides melaninogenicus
Coostridi perfrindens
CIostridium novyi В
CIostridium tertium
CIostridium cadaveris
Продолжение табл.! линдамицин Соединение являются устойчивыми к одному или более торговым антибиотикам. Символ
UC означает зарегистрированный товарный знак коллекции The Upjohn
Company CuIturure CoIIection, в г. KaImazoo в.штате Мичиган, из которой по запросу можно получить указанные культуры.
МБК клиндамицина и соединения Ч относительно грам-положительных и грам-отрицательных анаэробных бактерий представлена в табл. 2.
Т аблица 2
1169543
Продолжение табл.
МБК9 мкг/мл
ЧС
Организм
2,0
0,5
6505 0 Оз
6 0,03
« 0,03
6521
6506
0,25
0,06
0,50
6507
6834
7,7
3,9
6857
125
250
6858
3,9
3,9
6860
500
500
6861
2,0
3,9
0,12
6564
0,06
6575
0,06
0,03
6515
2,0
2,0
6522
0,50
1,0
5920
0,25
0,25
6516
0,12
0,12
0,06, 0,06
6324
6052
3,9
15,6
0,06
0,06
0,50
0,25
6258
0,06
0,05
Peptococcus manus
4 0,03
0,06
0,12
0,12
СЕовСгЫизш вогйеЕЕИ
CIostridium rentani
CIostridium 6otuginum А
CIostridium 8ifermentans
CIostridium diHiciIe
Propionibacterium acnes
Eubacterium Ишовцш .Eubacterium centum
Actinomyces naes2undii
Fusobacterium nucIeatumi
Fesobacterium varium
Fusobacterium necrophorum 6568
Peptococcus авассЬаго)Ьй сив 6214
Peptococcus aегоgenes 6319
pertostreptococcus апаетоЬии 6321
Указанные испытания проводят следующим образом.
Приготовляют серию разведений соответствующего антибиотика в отношении 1:2 в бульоне Шедлера (по
1,0 мл), а затем добавляют 9,0 мл
Клинд ц Со дине„„е V расплавленной при 47 С агаровой среды Вуилкенса Чалгрэна. После смешивания с антибиотиком агаровую среду выливают на чашки Петри (100 мл
К20 мм) и перед засевом последние выдерзивают в течение ночи. Культу14
1169543
Клиндамицин
Соотношение
5,7(4,2 + 7,8 2
12,3(8,8 + 17,3) Подкожно
Перорально
Подкожно
1+5 и 10
2,3(1,6+3,3 ) 0,25, 10
Подкожно Перорально
3,3(2,6 + 4,2)
12,3(10,2+14,8) 4,2
2,9(2,0+
+0,4,1)
320
320
+ЭД, мг/кг йО ры засеивают штрихам на чашки с агаром Вуилкенса-Чалгрэна и, выращивают их в течение 48 ч при 37 С.
Собирают газон микробов и готовят суспензию клеток в бульоне Педлера до мутности 0,5 Nafarfand Standard (10 клеток/мл) . Полученную суспенS зию пипеткой переносят в резервуары аппарата Steers repIicator и из него около 1-2 мкл наносят на поверхность агаровых.пластинок. После высыхания посеянной суспензии в течение нескольких минут пластинки помещают в сосуд (85X N, 107. Н, SX СО ) о и инкубируют при 37 С в течение
72 ч. МБК означает минимальную концентрацию действующего начала, задерживающую рост бактерий, причем очень тонкая пленка бактерий, т.е. менее
3 колоний, считается отрицательным результатом.
Агаровая среда Вуилкенса-Чалгрэна.
Растворитель — следующие компоненты, г, в 1000 мл дистиллированной воды (рН 7,0, 7,2):
Триптиказа 10
Гелисат 10
Дрожжевой экстракт 5 глюкоза 1
NaCI 5
Микроорганизм и способ применения действующего начала
Указанные испытания проводят следукщим образом.
Группы по 10 обычных лабораторных мьппей штамма CF 1 весом 18-20 r внутрибрюшинным путем заражают приСвободный от аргинина 1
Натриевая соль пи5 ровиноградной кислоты 1 . Агар 15
Добавляют растворы гема и витамина К с получением окончательной
10 К0НпеНТра Н 5 MKr/ìë гемина и витамина К„. Выдерживают автоклав при
121 С в течение 15 мин в аэробных условиях. Основной раствор гема:
0,5 г гемина + 10 мл 1 н. МаОН +
15 + 990 мл Н . Выдерживают автоклав при 121 С в течение 12 мин. Добавляют 10 мл основного раствора на литр среды. Основной раствор витамина К . 0,05 мл раствора витамина
20 К + .20 мл 957.-ного этанола. Стерилизуют фильтры. Добавляют 0,2 мл основного раствора на литр среды.
Среднее значение ЛД (внутрибрюшинно у мышей) соединения У из двух
25 идентичных определений составляет
592 мг/кг,что приблизительно в два раза превышает ЛДSo клиндамицина
НС1, т.е. острая внутрибрюшинная токсичность соединения Y приблизи3б тельно в два раза меньше, чем у клиндамицина НС1.
Испытания на защиту мьппей. Методика приведена в табл. 3.
Таблица 3 близительно 100 дозами ЛД п нормированных суспензий клеток бактерий, которые предварительно замораживали при -170 С, а затем быстро размоо раживали и должным образом раэбавля1169543
l6 ли. Сразу-же начинают лечение и проI должают его в течение 4 сут (препа-. рат вводят раз в день, первый суточный период равен единице. Группы необработанных зараженных мышей служат в качестве вирулентного контроля культуры.
Через 7 дн. после начала лечения выживших животных умерщвляют и вычисляют среднюю ЗД антибиотика и его 953-ный доверительный интервал в пересчете на смертность среды обработанных животных согласно методу Спэрмена и Карбера с помощью
ЦВМ 360. P-Цис-изомер УА при испытании с рассмотренным в связи с табл. 1 бульоном из мозга и сердца оказывает антибактериальное действие. Результаты испытаний представлены в табл. 4.
Таблица 4
Значения МБК, мкг/мл, UI у различных бактерий представлено в табл. 5.
Таблица
БК VI
Микроорганизм!
0,125
S. aureus
0,25
570
746
0,062
S. faecalis
0,25
694
0,008
152
$,pyogenes
D, pneumoniae
41 0,016
45 31,2
58 7,8
Е. coIi
К, pneumoniae
VC МБК, мкг/мл
Микроорганизм
S schottmueIIeri 126 31 2
250
Б, aureus
Ps. aeruginosa
95 >125
1000
570
125
746
Испытания проводят по методу, указанному в примере 1. Действие вещества VI испытывали на обычныс лабораторных мышах, которых для этой цели заражали бактериями, причем его сравнивали с действием Ч.
Результаты опытов показывают, что на D. pneumoniae и вещество III в мьппах и вещество Ч? оказывает гораздо. большее действие чем вещество У. Против S. aureus u
4 Я. ЬешоВу испв вещество VI обладает в основном такой же активноСтьв как и вещество Ч.
S. fecaIis
694 >1 000
62,5
152
S, pyogenes
D.pneumoniae
Е. coIi
К.pneumoniae
62,5
21000
>1000
S schottmueIIeri 126
>1000
Ps. aeruginosa
95 p1000
Составитель Ю. Белоусов
Редактор В. Данко Техред Л.Мартяшова Корректор В.Бутяга
Заказ 4633/57 Тираж 354 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4