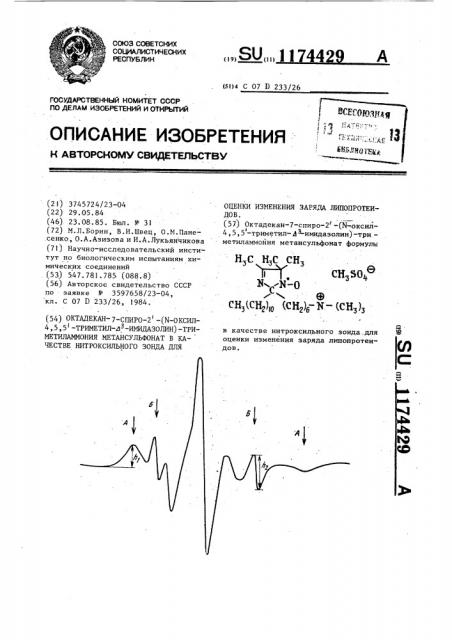
Октадекан-7-спиро-2-/ @ -оксил-4,5, 5-триметил- @ - имидазолин/-триметиламмония метансульфонат в качестве нитроксильного зонда для оценки изменения заряда липопротеидов
Иллюстрации
Показать всеРеферат
Октадекан-7-спиро-2 (N-OKCHji4 ,5,5-триметил- Л имидазолин) -три. метиламмония метансульфонат формулы СН, VY,СНзЗО/, е NYK-O ® СНз(СН2)ш (СН2)б--К-(СНз)з S в качестве нитроксильного зонда.для оценки изменения заряда липопротеи (Л ДОВ.
СОЮЗ СОНЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК (19) (ill 1 1 44 (51)4 С 07 D 233/26 хесарщр
1 . л.йл с,1 А1 . "Блй01%к
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ABTOPCHOMV СВИДЕТЕЛЬСТВУ
СНЗ Ф
ГОСУДАРСТЯЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21 ) 3745724/23-04 (22) 05.84 (46) 23.08.85. Бюл. Ф 31 (72) M.Ë.Áoðèí, В.И.Швец, О .М.Пане.сенко, О.А.Азизова и И.А.Лукьянчикова (71) Научно-исследовательский институт по биологическим испытаниям химических соединений (53) 547.781.785 (088.8) (56) Авторское свидетельство СССР по заявке h"- 3597658/23-04, кл. С 07 D 233/26, 1984. (54) ОКТЖЖКАН 7-СПИРО-2 -(N-ОКСИЛ4,5,5 -ТРИМЕТИЛ-d -ИМИДАЗОЛИН) -ТРИМЕТИЛАЯМОНИЯ МЕТАНСУЛЬФОНАТ В КАЧЕСТВЕ НИТРОКСИЛЬНОГО ЗОНДА ДЛЯ
ОЦЕНКИ ИЗМЕНЕНИЯ ЗАРЯДА ЛИПОПРОТЕИДОВ. (57) Октадекан-7-спиро-2 -(N-оксилI
4,5,5 -триметил- -имидазолин) -три.— метиламмойия метансульфонат формулы
3 НЗ- 3
Г . Щ
CH3(CÍ )„(CH ); N- (CH3)
4 в качестве нитроксильного зонда.для оценки изменения заряда липопротеидов.
1174429 2
Вычислено, X: C 60,67, Н 10,48, N 7,86.
Изобретение относится к новым производным имидазолина, а именно к октадекан-7-спиро-2 -(N-оксил4,5,5 -триметил-Л -имидазолин).-триI I метиламмония метансульфонату формулы
10 в качестве нитроксильного зонда для оценки изменения заряда липопротеидов. Цель изобретения — поиск новых соединений в ряду имидазола, обладающих гидрофобными свойствами и чувствительностью .к изменению поверхностного заряда липопротеидов, что позволяет их использовать в качестве нитроксильного зонда для оценки изменения заряда липопротеидов ..
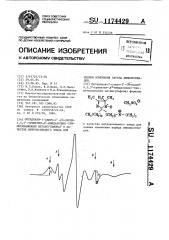
На чертеже изображена кривая спектра ЭПР предлагаемого соединения.
Соединение формулы (13 получают
30 взаимодействием мезилата октадекан7-спиро-2 -(N-оксил-4,5,5 -триметилI I ,о -имидазолин)ола с триметиламином . при 120 С.
Пример. В ампулу, содержащую
145 мг мезилата в 10 мл сухого тетрагидрофурана при охлаждении до
-25 C пропускают сухой газообразный триметиламин до накопления 2-3 мл.
Ампулу замораживают, запаивают и нагревают в течение 3 ч при 120 С. 40
Ампулу охлаждают, снова эамораживают, вскрывают, избытку триметиламина дают испариться, смесь упаривают досуха, остаток растворяют в четыреххлористом углероде, добавляют 45 сухой эфир для высаживания соли. Осадок отделяют обратным фильтрованием, растворяют в хлористсм метилене и хроматографируют на колонке с силикагелем. Смесью хлороформ:метанол
3:1 элюируют целевое соединение. Получают 96 мг (60,3X ) соли в виде светло-желтого воскообразного вещества.
ИК-спектр, см : 1210-1180 (S03), 1650 (C=N). ЭПР-спектр (10 М растsop в спирте ): М 1,46 мТ, 5,8 х 10 спин/моль.
3 3 3
НЗ о%
Ni Я-О ,С ф
СИЗА )1О (Сн )6- Х- (СН3)
С27Н ИЗБОУ
Найдено, 7: С 60,12; H 10,95, N 7,47.
В качестве объекта изучения использовали ЛПНИ и ЛПВП, выделенные из плазмы крови здоровых доноров и больных ишемической болезнью сердца (ИБС ).
Липопротеиды выделяют из плазмы крови. здоровых доноров и больных ИБС методом ультрацентрифугирования в солевых растворах различной плотности. Полученные препараты ЛНПН (d =
1,065-1,125 г/см,) и JIIIBII> (<1
>1,21 r/cM3) диализуют прй 4 С против раствора 5 мМ трио-НС1-буфера рН 7,3 в течение 18 ч.
Методика приготовления образцов для регистрации ЭПР-спектров заключается в следующем. К 100 мкл суспензии ЛП (содержащей 1 мг фосфолипидов на 1 мл ) добавляют 1 мкл раствора зонда в этаноле. Конечная кон-5 центрация зонда 8,7 10 M этанола
1 об.7, Смесь инкубируют 5 мин, помещают в плоскую кварцевую ампул . и регистрируют спектр ЭПР в режиме: микроволновая мощность 10 мВт, амплитуда модуляции 1-1,6 Гс, развертка магнитного поля 25 Гс/мин при постоянной времени 1 с. Спектр ЭПР предлагаемого соединения представляет собой суперпозицию двух сигналов (фиг.1): от зондов, встроившихся в
ЛП (сигнал А), и от зондов, растворенных в водном окружении (сигнал Б ).
Для характеристики степени связывания соединения формулы (1 ) с ЛП из спектров ЭПР определяют параметр / Ъ где Ъ вЂ” интенсивность низко2 1 польного сигнала спектра ЭПР от зондов, связанных с ЛП, b2 — интенсивность высокопольной компоненты спектра ЭПР от зонда, растворенного в воде. Распределение заряженных соединений между мембраной и ее окружением зависит от поверхностного заряда мембраны, поэтому изменения измеряемого спектрального параметра
/ 1 отражают изменение поверхност2 ного заряда мембраны ЛП.
Для сравнения с предлагаемым соединением (зонд 1) определяют изменение параметра 1 „ /1 2 незаряженного структурного аналога (зонд 111). Обследовано 10 больных ИБС и 10 здороЗонд 1, / Й2
Зонд 111 Ъ„/,42
Абсолют- Процент ное зна- к контПроцент к контАбсолютное значение чение ролю олю
ЛПНП
0,65
100
100 . 1,81
58,5 2,02 здоровые
109,6
0,38 больные ИБС
ЛПВП
100 1,27
100
1,52 здоровые
1,99 130,9 1,31 больные ИБС
102,1
Составитель Н.Подхалюэина
Техред И.Асталош Корректор/ Л. Бескид
Редактор О.Юрковецкая
Заказ 5136/25 Тираж 384
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Подписное
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4 вых доноров, полученные данные усреднены.
Значения параметра распределения исследуемых зондов у здоровых доноров и больных ИБС представлены в таблице (ошибка измерений 107 ).
Иэ данных таблицы следует, что изменения параметра h / 5 зонда ll! незначительны и находятся в пределах ошибки опыта. В то же время рас174429 4 пределение предлагаемого зонда .! и
ЛП больных значительно отличается от его распределения в ЛП здоровых доноров: на 32,57 для ЛПНП и на
30,9Х для ЛПВП. Таким образом, предлагаемое соединение является чувствительным к изменениям заряда липопротеидов и может быть использовано в медицине для контроля за состоя l0 кием липопротеидов при различных типах патологии.