Способ получения амидиновых производных
Иллюстрации
Показать всеРеферат
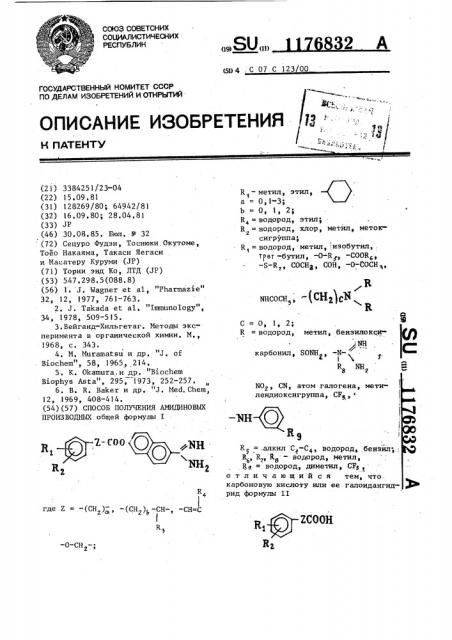
СПОСОБ ПОЛУЧЕНИЯ АМИДИНОВЫХ ПРОИЗВОДНЫХ общей формулы I 7.-СОО R. R,j-метил, этил, - а 0,1-3; / b О, 1, 2; R водород, этил; . R водород, хлор, метил, метоксигруппа; R, водород, метил, изобутш1, Т per-бутил, -0-R,f, -COOR, -s-R, сосНа, СОН, -0-Сосн,, / ( ШСОСН 3 3 с о V., 1, 2; R водород, метил , бензилокси .INH карбонил, SONH,, -N-f i I т В 2 N0, CN, атом галогена, метилендиоксигруппа, CF,« j Ку .ллкил , водород, .бензйт, ; 6 7 8 метил, . Ла. - водород, диметил, CFj , отличающийся тем,что. карбоновую кислоту или ее галоидангидрид формулы II где 2 -(СНр-, -(СН2),,-СН-, -О-СН -; ZCOOH
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИК
РЕСПУБЛИН
„„SU„„ (5D4, C 07 С 123 00
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ ф
ОПИСАНИЕ ИЗОБРЕТЕНИЯ 13
gg j
Н ПАТЕНТ
< — метил, этил, а = 0,1-3
О, 1, 2; водород, зтил; водород, хлор, метил, метоксигруппа; водород, метил,, изобутнл,.
ТРет -бутил, -О-К -СООТГ
СОСНд, СОН, -О-СОСН.,, R
К г
В мясосн, (СНДсМ Э
NR с = о, 1, 21
R — водород метил, бензилокси 11Н
БОНН, -N1 карбонил, К ИН
N02 СИ, атом галогена, метилендиоксигруппа, CF®, -ИЯ Х- t.oO
ФКН
2СООК
-О-СН
2 (21) 338425)/23-04 (22) 15.09.81 (31) 128269/80; 64942/81 (32) 16.09.80; 28.04.81 (33) JP (46) 30.08.85. Бюл. N 32 (72) Сецуро Фудзи, Тосиюки.Окутоме, Тоео Накаяма, Такаси Яегаси. и Масатеру Куруми (JP) (71) Тории энд Ко, ЛТД (JP) (53) 547.298,5(088.8) (56) 1. J. Wagner et а1, "Pharmazie"
32, 12, 1977, 761-763.
2. J. Takada et al. "Immunology.", 34, 1978, 509-515
3.Вейганд-Хильгетаг. Методы эксперимента в органической химии. М., 1968, с. 343, 4. М..Nuramatsu и др. "J. of
Biochem", 58, 1965, 214.
5. К, 01сашита.и др. "Biochem
Biophys Asta", 295, 1973, 252-257.
6. В. R. Baker и др. "J. Ned. Chem, 12, 1969, 408-414. (54)(57) СПОСОБ ПОЛУЧЕНИЯ АИИДИНОВЫХ
ПРОИЗВОДНЫХ общей формулы I д Z (СН2) (CH2)ь СН СН вЂ” С
I
Кэ
R> = ..алкил С -С, водород, бензйл; водород, Rq = водород, диметил, СР, отличающийся тем, что карбоновую кислоту или ее галоидангидрид формулы II
«NH
НО
Х-соо
ir МН g 1O группа, CF3 HH
Rq
I — у -О-сн, R> метил, этил, в
2
ZC008
- (с 4)ск
RZ где Z, R<, R< имеют указанные значения подвергают взаимодействию с 6-амиди но-2-нафтолом формулы Ш
Изобретение относится к синтезу биологически активных соединений, а именно к синтезу амидиновых производных общей. формулы I, где 2 - (СН )-, - (Сна )в 1
2 а ° 2
0,1-З, 0,1,2; водород, этил; водород, хлор, метил, метокси группа; водород, метил, изобутил, т ет-бутил, О-К » -COOR< 8 R соснь» сон» о-сосн » инсоснз»
С О, 1, г;
К водород, метил, бензилоксикарбонил, SONH
1176832 при температуре от -10 до 60 С, в среде растворителя в присутствии основания, и целевой продукт выделяют в свободном виде или в виде соли.
Приоритет по признакам:
16,09.80 при R = -NH-С-NH, R = Н, Z -(CH )a» а = О, 28.04.81 установлен согласно другим значениям радикалов, указанных в формуле изобретения, ФЮН
-N1 т
NO CN юн
Ь атом галогена, метилендиокси% = алкил С<-С4» водород, бензил;
Rg» Rp ° R8 водород» метил» = водород, диметил, СР
15 проявляющих антитрипсиновую, антиплазминовую, антикалликреиновую, антитромбиновую и антикомплементную активность.
Известен б-амидино-2-нафтол, ин2р гибирующий трипсин, плазмин, и тромбин (1) .
Известен также лаупетин, обладающий антикомплементной активностью (2j ю@
Цель изобретения — синтез соеди25 нений, обладающих более высокой антитрипсиновой, антиплазминовой, антитромбиновой и антикомплементной активностью.
Поставленная цель достигается спо . ,Зр собом, заключающимся в том, что карбоновую кислоту или ее галоидангидрид формулы II
4р r e Z, R » R< имеют указанные значения, 1176832 а подвергают взаимодействию с 6-амидино-2-нафтолом формулы III гг NH ин, при т емпер атур е от -10 до 60О С в среде растворителя в присутствии основания с выделением целевого продукта в свободном виде или в виде соли.
Способ основан на известной реакции кислот со спиртом (3).
Соединение формулы I может быть получено растворением или суспендированием карбокислотного соединения
II в таком органическом растворителе, как диметилформамид, пиридин и т.п. с последующим введением соединения II в реакцию с активатором карбоновой кислоты, например дициклогексилкарбодиимидом (ДЦК), дифенилфосфорилазидом (ДФФА)и т,п,, обычно применяемыми в качестве агентов дегидратации-конденсации, и прибавлением 6-амидино-2-нафтола (соединение
III) или предпочтительно его соли, образованной присоединением кислоты к реакционному продукту.
Например, при использовании ДЦК в качестве агента дегидратации-конденсации производное карбоновой кислоты
II прибавляют к растворителю — пиридину, после чего смесь перемешивают при охлаждении льдом или при комнатной температуре в течение 10 мин2 ч, и затем прибавляют 6-амидин-2-нафтол формулы III затем смесь продолжают перемешивать при температуре о от -30 до 80 С, предпочтительно при комнатной температуре, 3-5 ч для завершения реакции, Из реакционной смеси осаждается дициклогексилмочевина (ДЦМ), при этом соединение I либо осаждается вместе с ДЦМ, либо остается растворенным в растворителе, В первом случае оба осадка собирают фильтрованием, после чего суспендируют в подходящем растворителе (диметилформамид и т ° п.) и смесь отфильтровывают для удаления нерастворимой
ДЦМ, После добавления к фильтрату растворителя (этиловый эфир, этилацетат, ацетон и т,п,) осадок собирают фильтрованием и получают соединение
I. Кроме того, объединенные осадки
ДЦМ и соединения I можно собрать фильтрованием, добавить затем в подходящий растворитель (диметилформамид, вода и т,п,) для удаления нерастворимой ДЦМ фильтрованием, фильтрат добавить в насьпценный водный раствор гидрокарбоната натрия и получить соединение I в форме карбоната, Во втором случае, когда соединение I остается растворенным в реакционной смеси, ДЦМ удаляют фильтрованием, фильтрат смешивают с растворителем (этиловый эфир, ацетон, этилацетат и т,п.) и получают соединение I„
По другому способу, когда в каче10 стве промежуточного реакционноспособного производного карбоновой кисло= ты II используют галоидангидрид кислоты, соединение II вводят в реакцию с таким кислотгалогенирующим агентом1
15 как БОСЫ, БОВг, PCf и т.п. для получения галоидангидрида кислоты формулы IV
20 сох
30 где К и R определены выше, à Х представляет собой атом галогена.
Галоидангидрид добавляют в раствор
6-амидино-2-нафтола формулы III, предпочтительно в форме соли, образованной присоединением кислоты, растворенного в диметилформамиде, пиридине, диметилсульфоксиде и т.п. и вводят в реакцию в присутствии дегидрогалогенирующего агента. Пригодные для использования дегидро- . галогенирующие агенты включают в себя неорганические основания (карбонат калия, карбонат натрия, гидроокись натрия и т.п.) и органические основания триэтиламин, пиридин, ди45 метиланилин и т.п.) . Среди этих оснований предпочтителен пиридин. Хотя реакция легко протекает в интервале температур от -30 до 80 С, однако о для того, чтобы избежать побочных реакций, предпочтительно на ранней стадии проводить реакцию при охлаж.дении льдом, а затем при комнатной температуре, Реакция завершается в течение 2-5.ч> после чего реакционную смесь. обрабатывают обычным образом. Например, при использовании пиридина в качестве реакционной среды в нее добавляют растворитель!
1768
5 (серный эфир или этилацетат) для осаждения твердого продукта реакции, который затем перекристаллизовывают из подходящего растворителя (смесь метанола и этилового эфира), получая при этом соединение I.
Соединение I может быть получено в восстановленной форме путем восстановления подходящего соединения формулы I подходящим восстанавли- 10 вающим агентом, Например, соединение формулы Е, имеющее нитрогруппу, восстановлением превращают в соединение формулы I имеющее аминогруппу. Можно также превратить эфирное произ- 15 водное коричной кислоты, имеющее двойную связь,.в производное фенилйропионовой кислоты.
Кроме того, соединение I может быть получено удалением группы, за- 20 щищаницей аминогруппу, оксигруппу и карбоксильную группу. Защитные группы включают в себя обычно используемые защитные группы, например бензилоксикарбонил, т ет-бутоксикарбонил, >> бензил и Т ет -бутил. Например, соединение, имеющее аминометильиую группу, получают удалением защитной группы из соединения, имеющего бензилоксикарбониламинометильную группу, а 30 соединение, имеющее оксигруппу, получают из соединения, содержащего бензилоксигруппу.
Соли кислотного присоединения соединения I могут быть получены обычным образом. Например, карбонатную соль соединения I растворяют или суспендируют в метаноле, ДМф и т.п. и оставляют растворяться с добавлением метансульфокислоты хлористоводород40 ной кислоты и т,п. К раствору прибавляют растворитель 1,этиловый эфир, . этилацетат и т.п,) и получают соответствующую соль кислотного присоединения. Можно использовать фармацев- 45 тически приемлемые кислоты, включая такие неорганические кислоты, как хлористоводородная, серная и фосфорная,и такие органические кислоты, как уксусная, молочная, лимонная, метансульфоновая, янтарная, фумаровая и малеиновая.
Соединение Е и его фармацевтически приемлемые соли кислотного присоединения обладают мощной ингибирующей активностью против протеза, т.е. трипсина, плазмина, калликреина и тромбина, и эффективны в качестве зг 6 антнтрипсинового агента при лечении панкреатитов, антиплазминового и антикаллийреинового агента при лечении гемморагических заболеваний, антитромбинового агента при тромбозе, Трипсин представляет собой протеазу, первоначально существующую в форме проэнзима трипсиногена в поджелудочной железе, который секретируется в тонкую кишку, где трипсиноген превращается в трипсин активацией с помощью присутствующей в тонкой кишке энтерокиназы. Трипсин выступает в роли фермента пищеварения, Если трипсиноген каким-либо образом активируется в поджелудочной железе с образованием трипсина, то ткань поджелудочной железы повреждается и появляются клинические симптомы панкреатита. В экспериментах на крысах при обратном введении трипсина в поджелудочную железу можно получить набор интенсивных панкреатитов, причем заболевание вылечивается при назначении ингибитора трипсина. Следовательно, рассматриваемое соединение, имеющее сильную ингибирующую активность по отношению к трипсину, пригодно в качестве антитрипсинового агента, клинически эффективного при лечении панкреатита, Плазмин является ферментом, присутствующим в крови, обычно в форме проэнзима плазминогена, который превращается в плазмин активацией тканевым активатором плазминогена, таким как укрокиназа. Действие этого фермента противоположно действию тромбина, т.е. оно заключается в растворении фибрина. Таким образом плазмин играет важную роль в сохранении тока крови через капилляры, Однако когда этот фермент черезмерно активируется, он вызывает геморрагические заболевания, Фермент участвует также в воспалительном процессе, повьппая проницаемость сосудов и вьзывая эдему и т.п. Следовательно, ингибитор этого фермента пригоден в качестве лекарства при лечении геморрагических заболеваний и воспалений.
Калликреин представляет собой фермент, присутствуюшнй в крови н других органах и железах, обычно в форме своего предшественника, прекалликреина, активизируемого фактором Хаге1176 мана или другой протеазой. Этот spзим участвует в гипотензивной калликреин-кининовой системе, действующей против гипертензивной ренин-ангиотензиновой системы, и играет важную роль в регулировании кровяного давления, Этот фермент участвует также в экзогенной системе.коагуляции, Кроме того, калликреин, вырабатываемый в органах и железах, играет важную роль в улучшении локальной циркуляции, Однако черезмерная активация этого фермента, особенно черезмерная локальная активация, вызывает недостаточность локальной циркуляции, обусловленную черезмерной активностью и системы коагуляции, и приводит к воспалению, язве и т.п, Следовательно, ингибитор калликреина пригоден для контроля над кровяным давлением и в качестве лекарства для лечения воспаления или язвы, 30
Предлагаемое соединение и его фармацевтически приемлемые соли кислотного присоединения обладают сильной ингибирующей активностью по отношению к зкстеразе 01 (01г, Ols), способностью ингибировать вызываемый комплементом гемолиз и терапевтической активностью против шока Форссмана, при котором активация комплементной системы, вызываемая иммунным комплексом, играет значительную роль.
Это указывает на то, что предлагаемое соединение пригодно в качестве антикомплементного агента и эффективно при лечении аллергических заболеТромбин известен как фермент, обладающий кровосвертывающей активностью, В нормальном состоянии тромбин образуется при активации в крови протромбина, имеющей место при повреждении сосудистой стенки, Действие тромбина заключается в разложении фибриногена в крови до фибрина, Результирующий фибрин закрепляется на поврежденной части сосудистой стенки, препятствуя вытеканию компонентов плазмы крови и одновременно ускоряя заживление ткани, Однако если сис35 тема коагуляции черезмерно активирована, то в расположенных внутри тела капиллярах образуется большое число небольших тромбов, Следовательно, предлагаемое соединение пригодно в
40 качестве лекарства при лечении таких заболеваний, 832
8 ваний, таких как нефриты, связанные с комплементом.
Комплемент является системой белков сыворотки и включает 9 компонен— тов от 01 до 09. Компонент 01 подразделяется на 3 кодкомнонента 0)q, Оlr и Оls, Под Ols u Olr подразумеваются соответственно активированные Ols u Olr. Комплемент рассматривался сначала как часть защиты живого организма от инфекции, так как он проявляет бактериолитические свойства, однако недавно были получены доказательства еro более тесной взаимосвязи с иммунной системой. Было показано, что комплемент последовательно активируется иммунным комплексом от 01 до 09 и на конечной стадии проявляет цитолитические и немолитические свойства (активация
09), Было такм показано, что фрагменты (например, 03а, 05a), освобождающиеся в ходе активации комплемент ной системы, усиливают сосудистую проницаемость и промотируют хемотаксис полиморфоядерных лейкоцитов или иммунную адгезию. В последнее время интенсивно изучалось взаимоотношение между черезмерной активацией комплемента и различными заболеваниями, особенно иммунными заболеваниями, в результате начали описывать тесную связь аутоиммунных заболеваний с комплементом, Примерами аутоиммунных заболеваний, вызываемых черезмерной аКтивацией комплемента, являются аутоиммунная гемолитическая анемия, аутоиммунная тромбоцитопения, лейкопения, гломерулонефриты, системный люпус-эритематоз, заболевания сыворотки и периартериитная узловатость, Вероятно, можно лечить такие заболевания ингибированием активации комплемента или ингибированием активированного комплемента на ранних стадиях, Был проведен ингибирующий эффект соединений I по отношению к 01эстеразе с использованием Ol-эстеразы в качестве тестируемого фермента и влияние соединений I на комплементную систему для оценки пригодности рассматриваемого соединения в качестве лекарства против аутоиммунных заболеваний, Вызываемый комплементом гемолиз широко применяется для определения титра комплемента, Этот способ основан на том, что гемолиз вызывается активацией комплемента при добавлении последнего в комплекс (имунный комплекс) эритроцитов и их антител. Степень гемолиза изменяется в зависимости от количества добавленного комплемента. Следовательно, если используют известное количество комплемента, смешанного с ингибитором эстеразы 01, то гемолиз подавляется пропорционально ингибиторной активности. Предлагаемое соединение, обладая ингибирующей 01-эстеразу активностью проявляет, как будет по-. казано ниже сильную ингибирующую активность по отношению к вызываемому комплементом гемолизу.
Предлагаемое соединение испытывали при шоке Форссмана. Весьма отличаясь от других животных морская свинка имеет на поверхности своих органов специфический антиген, называемый антигеном Форссмана, который специфически взаимодействует с антителом эритроцита овцы. Шок Форссмана вызывается введением антител эритроцитов овцы морской свинки.
Известно, что при этом шоке комплемент играет принципиальную роль и комплементная система последовательно активируется, начиная с 01.
Так как установлено участие комплемента в аутоиммунных заболеваниях, то лекарство, эффективное при лечении шока Форссмана, пригодно в качестве лекарства от аутоиммунных заболеваний.
Антитрипсиновую, антиплазминовую, антикалликреиновую и антитромбиновую активности определяли по способу Мурамасу (A . Результаты представлены в табл, 1. Данные табл. 1 представляют собой молярные концентрации (ID ) испытуемого соединения, ингибирующие 50 -ную активность каждого фермента при гидролизе тоэиларгининметилового эфира (ТАМЭ ). Цифры в скобках показывают процент ингибирования при концентрации соединения
1 х 10 N.
Активность против эстеразы 01 определяли по методу Окамуры f5), Ингибирование вызываемого комплементом гемолиэа определяли .по способу Бакера 16) . Полученные результаты пред« ставлены в табл, 2, Сокращения в табл, 2 означают следующее:
176832 10
01r — молярная концентрация испытуемо го соединения, инги бирующая способность 01r гидролизовать ацетиларгининметиловый эфир (ААМЭ) на 50 (JD%0 )
01s - молярная концентрация испытуемого соединения, ингибирующая способность 0 1s гид10 ролизовать ацетилтирозинэтиловый эфир (ЛТЭЭ ) на 50 .
Цифры в скобках обозначают процент ингибирования при концентрации соеди-Х нения 1х 10 M.
Ингибирующая активность указана как процент ингибирования при различных концентрациях соединения.
Шок Форссмана, Используют Хартлеевских морских
20 свинок с весом тела около 300 г. Каждой морской свинке из контрольной группы внутривенно вводят 0,5 мл (минимальная доза, вызывающая шок), немолизина (коммерческий гемолизин, 5000 ед, в соответствии с оценкой, данной по способу Огата), при этом отмечают время до наступления смерти, В испытуемой группе каждой морской свинке внутривенно вводили испы-.
30 туемое соединение за 5 мин до введения немолизина и отмечали время до смерти. Полученные результаты представлены в табл. 3. По сравнению с контрольной группой время жизни свинок, обработанных предлагаемым соединением, существенно увеличилось.
Предлагаемое соединение назначают орально или в виде инъекций. Его используют также в комбинации с други40 ми лекарствами. Соединение можно вводить в чистом виде либо с добавками в таблетках, порошках, капсулах сиропах и растворах. Оральные композиции могут содержать обычные до45 бавки такие как связующие разбавиt тели, диспергаторы и инертные медицинские носители. Оральные растворы ,могут быть в форме водной или масляной суспензии, раствора, эмульсии, сиропа или эликсира, а также в форме
50 сухого сиропа, который перед использованием разбавляют водой или другим подходящим растворителем, Растворы могут содержать обычные добавки, такие как суспендирующие агенты, душистые соединения, разбавители или эмупьгаторы, Для инъекций можно использовать водные или масляные суспензии, лоза 33,4
Кальциевая карбоксиматилцеллюлоза 3,6
Стеарат магния 4 0
Общий вес 200,0
Мелкие гранулы:
Предлагаемое соединение 50,0
Лактоза 249,0
Маннитол 75,0
Кукурузный крахмал, 110,0
Гидроксипропилцеллюлоза 16,0
Общий вес 500,0
Инъекция:
Предлагаемое соединение, мг
Вода для инъекции, мп
Токсичность. ч
Дозы 50%-ной смертности (LD мг/кг рассматриваемого соединения представлены ниже:
Соединение Внутривенно Орально
22 200 2500
27 200 2500
Физические свойства соединений представлены в табл. 4.
5,0
2,0
Пример 1 соединение 1).
Синтез 6-амидино-2-нафтилбензоата
СОО ЯН
ЗК
Дозирование.
Данное соединение можно назначать орально в дозе 10-200 мг в день или внутривенной инъекцией в дозе 1-20 мг в день. Дозу подбирают индивидуально в зависимости от возраста, веса тела пациента и в зависимости от призна-. ков заболевания, Примеры рецептур (содержание компонентов приводится в миллиграммах) .
Капсулы:
Предлагаемое соединение 100,0
Лактоза 59,0
Кристаллическая целлю
176832 12 образования осадка, который собирают фильтрованием. Осадок растворяют в метаноле и результирующий раствор добавляют в насыщенный водный раствор бикарбоната натрия, При этом образу-. ется осадок, который собирают фильтрованием и получают карбонат 6-амидино-2-нафтилбензоата. К суспендированному в метаноле карбонату добавляют
10 метансульфоновую кислоту, а затем эти ловый эфир и получают 2,4 r бесцветного порошка, представляющего собой метан сульфонат 6-амидино-2-нафтилбензоата, 15 Пример 2. (соединение 2), °
Синте з 6-амидино-2-нафтил-2-метил» бензоата.
К 50 мл безводного пиридина добавляют 2,4 г 2-метилбензойной кислоты, а затем при охлаждении льдом 4,4 .r
ДЦК, После перемешивания в течение
30 мин и добавления 5 0 г 6-амидиноt
-2-нафтолметансульфоната смесь перемешивают в течение ночи при комнатной температуре, Осадок собирают фильтрованием, промывают сначала .небольшим объемом пиридина, а затем последовательно диэтиловым эфиром и ацетоном. Осадок растворяют в
ДМФ и нерастворимый остаток удаляют фильтрованием. В фильтрат добавляют диэтиловый эфир, выпавшие кристаллы, перекристаллизовывают иэ этанола и получают 1,4 r пластинчатых бесцветных кристаллов метансульфоната 6-амидино-2-нафтил-?-метилбеHsoата, Пример 3 (соединение 3).
Синтез 6-амидино-2-нафтил-2-метилбензоата
СОО
ФИН ° а
В 50 мл пиридина суспендируют, 2,8 г б-амино-2-нафтолметансульфоната, В суспензию при охлаждении льдом и перемешивании добавляют 14,1 г бен— зоилхлорида. Смесь перемешивают 1 ч при охлаждении льдом и в течение ночи при комнатной температуре. После завершения реакции в реакционную смесь добавляют этиловый эфир для
К раствору 2,3 г мета-метилбензойной кислоты в 30 мл безводного пиридина добавляют 4,4 г ДЦК. В пере-)3
))76832 мешиваемую смесь при охлаждении льдом прибавляют 5 r 6-амидино-2-наф» тол-метансульфоната. После перемешивания в течение 24 ч нерастворимый остаток удаляют фильтрованием и в 5 фильтрат добавляют диэтиловый эфир, После отделения результирующего маслянистого соединения декантацией оно эакристаллиэовывается. Кристаллы перекристаллизовывают иэ смеси метанол - эфир и получают 2,2 r метансульфоната 6-амидино-2-нафтил-3-метнлбенэоата.
Пример 4, Следующие соединения получены аналогично примерам
1-3:
@,-ДО-соо, МН жн" . 2
СОО
СОО
С 3 у Н ИН2,« кн
NH> гз
СНЗСОО СОО
СОО мн
NH2 Н юн
30 сн, СН ООС СОО,БН
МН2
iÃNH Н2 (3 С о 0
ХН2
С1 СОО
Ф
МНг ;ян
2 45 ЯЯ СОО
МН2
02Ж С00
/.
СОО
4HH
КНг ггпу
П р и и е р 5 (соединение ) )), Синтез 6-амидино-2-нафтил -4-оксибензо ата,я() СОО
rr%i ЮС СОО ЮН2
ФЯН жН2
CR,O Coo
СН СН))СНР СН20 СОО
CH О СОО
К 50 мл безводного ДМФ добавляют
4,0 г 6-амидино-2-нафтил-4-бензилокси— о бензоата метансульфоната и 0,4 r
107.-ного палладия на угле. Смесь подвергают каталитическому гидрогенизированию, После поглощения стехиометрического количества водорода из реакционной смеси фильтрованием удаляют нанесенный на уголь палладий, После добавления в перемешиваемый фильтрат диэтилового эфира осадок собирают фильтрованием, перекристаллизовывают из смеси ДИФ вЂ” диэтиловый эфир и получают 2,4 r белого порошкообразного метансульфоната б-амидино-.
-2-нафтил-4-оксибензоата.
Пример 6. Следующие соединения получают аналогично примерам
1-3:
1176832
15
Н2Ж СОО
Зн
43Н2
1Î
Смесь 3,0 r метансульфоната 6-амидино-2-нафтил-4-нитробензоата, 0,88 г метансульфоновой кислоты, 0,3 r 10%-ного палладия на угле и безводного ДМФ подвергают каталитической
СБ20СОМНСН2 СОО
Ф
@ 2
Пример 9 (соединение 22) °
Синтез 6-амидино-2-нафтил-4-аминометилбензоата
Qo) "
30 2 2
К смеси растворителей, состоящей из 100 мл метанола и 20 мп ДМФ, при бавляют 5,0 r метансульфоната 6-амидино-2-нафтил-4-бензилоксикарбониламинометилбензоата, 1,0 r 10%-ного палладия на угле и I 1 г метансульфоновой кислоты. Водород при интенсивном перемешивании пропускают в смесь в течение 3 ч. После завершения ре »
411 акции реакционную смесь отфильтровывают и фильтрат концентрируют до половины объема, В концентрат добавляют диэтиловый эфир, осевшие кристаллы собирают фильтрованием и получают 3,0 r белого порошкообразного 6-амидино-2-нафтил-4-аминоме.тилбензоата диметансульфоната.
Пример 10. Следующие соединения получают аналогично примеру8 или 9:
СН20СОНИСН 2СБ2 СОО
СОО ив
ЮК2
Пример 7 (coåäèíåíèå 20), Синте з 6-амидино-2-нафтил-4-аминобензоата
К 50 мл сухого пиридина прибавляют 5,1 г 4-бензилоксикарбониламинометилбензойной кислоты и 4,4 г
ДПК. Смесь перемешивают при охлаждении льдом 30 мин, смешивают с
5,0 г метансульфоната 6-амидино-2-нафтола и перемешивают сначала 1 ч при охлаждении льдом, а затем в течение ночи при комнатной температуре. Реакционную смесь отфильтровывают и фильтрат смешивают с диэтиловым эфиром. Образовавшийся осадок собирают фильтрованием, перекристаллизовывают из смеси ДМФ вЂ” этанол и получают 3,8 г белого порошкообразного метансульфоната 6-амидино-2-нафтил-4-бензилоксикарбониламинометилбензоата.
Оставшийся на фильтре осадок растворяют в ДМФ при нагревании, нерастворившуюся часть отфильтровывают и из фильтрата получают еще 3 5 г белого порошкообразного целевого продукта добавлением диэтилового эфира и последующим фильтрованием и собиранием осадка. гидро генизации. После поглощения стехиометрического количества водорода из реакционной смеси удаляют палладий с углем с помощью фильтрования, После прибавления при перемешивании диэтилового эфира к фильтрату осадок собирают фильтрованием и перекристаллизовывают из смеси ДИФ вЂ” диэтиловый эфир, получая при этом 3,5 г диметансульфоната б-амидино-2-нафтил-4-аминобензоата в виде белого порошка.
Пример 8 (соединение 21).
Синтез б-амидино-2-нафтил-4-бензилоксикарбониламинометилбензоата
1176832
Пример 11 (соединение 23) .
Синтез 6-амидино-2-нафтил-3-диметиламинобензоата МБ .цБ
СОО
СН3 К
СБ3
СОО WH МН2
К 50 мп сухого пиридина добавляют
2,9 г 4-диметиламинобензойной кислоты и 4,4 г ДПК. Смесь перемешивают
30 мин при охлаждении льдом, После добавления 5,0 r метансульфоната 6-амико-нафтола смесь перемешивают еще I ч при охлаждении льдом, а за- 55 тем в течение ночи при комнатной температуре. Реакционную смесь отфильтровывают, собранный осадок проК 70 мп сухого пиридина прибавляют 2,9 г 3-диметиламинобензойной кислоты и 4> 4 r ДПК. Смесь перемешивают
30 мин при охлаждении льдом. После добавления 5,0 r метансульфоната 6-амидино-2-нафтола смесь еще перемешивают 1 ч при охлаждении льдом и затем в течение ночи при комнатной температуре. Реакционную смесь отфильтро- 0 вывают и фильтрат смешивают с диэтиловым эфиром. Образовавшийся осадок собирают фильтрованием, растворяют в небольшом количестве метанола и при перемешивании прибавляют к насыщенному водному раствору бикарбоната натрия, Осажденные кристаллы собира" ют фильтрованием и получают 3,8 г
6-амидино-2-нафтил-3-диметиламинобензоата карбоната, плавящегося выше
120 С с разложением. Кристаллы сусо пендируют в этаноле, смешивают с
1 ° 4 r уксусной кислоты и перемешивают до образования прозрачного раствора, из которого через некоторое время осаждаются кристаллы, Кристаллы собирают фильтрованием, перекристаллизовывают из этанола и получают 2,5 белого порошкообразного ацетата 6-амидиио-2-нафтил-3-диметиламинобенэоата.
Пример 12.(соединение 24), Синтез 6-амидино-2-нафтил-4-диметиламинобензоата.
18 мывают пиридином, диэтиловым эфиром и нагревают в ДМФ, Нерастворимую часть отфильтровывают и фильтрат смешивают с диэтиловым эфиром, Образовавшийся осадок собирают фильтрованием, перекристаллизовывают из смеси метанола и диэтилового эфира и получают 1,2 r белого порошкообразного метансульфоната 6-амидино-2-нафтил-4-диметиламинобензоата, Пример 13 (соединение 25), Синтез 6-амидино-2-нафтил-4-ацетиламинобензоата р c00 Q© ин 4 0 П m
Синтез проводят так же, как в примере 2.
Пример 14 (соединение 26), Синтез 6-амидино-2-нафтил-3-гуаЮ нидинбензоата
СОО ÍÍ жк
В 200 мл этанола суспендируют
32 r гидрохлорида метд -аминобензойной кислоты, После добавления 15,5 r цианамида (NCNH<) смесь перемешивают
24 ч на масляной бане при 55 С. Оса док собирают фильтрованием, смешивают с насыщенным водным раствором гидрокарбоната натрия и осевшие кристаллы собирают фильтрованием, Кристаллы суспендируют в этаноле, смешивают с метансульфоновой кислотой, результирующий раствор смешивают с диэтиловым эфиром, получая маслянистое соединение, которое отделяют декантацией, и получают 27 r метансульфоната мета -гуанидинбеызойной кислоты.
К раствору 4,7 г метансульфоната
Юет4-гуанидинбензойной кислоты в
50 мл безводного пиридина добавляют
4,.4 г ДПК. К этой смеси при охлаждении льдом и перемешивании прибавляют 5,0 г метансульфоната 6-амидино-2-нафтола, После перемешивания в течение 24 ч из реакционной смеси фильтрованием удаляют нерастворимый
19
1176832
Ие
""-С СОО
5Н .\
:ые мн
Ъ остаток и фильтрат смешивают с эфиром. Образуется маслянистое соедине1 ние, которое кристаллизуется при добавлении этилацетата, Перекристаллизацией из смеси метанола и эфира получают 3,2 г диметансульфоната
6-амидино-2-нафтил-3-гуанидинбенэоата.
Пример 15 (соединение 2 7).
Синтез 6-амидино-2-нафтил-4-гуанидинбензоата
HM ©-coo О
НM
Способ А, К 100 мл тионилхлорида прибавля-. ют 21,6 r гидрохлорида 4-гуанидинбензойной кислоты. Смесь кипятят с обратным холодильником при перемешивании 1 ч. В реакционную .смесь.
25 прибавляют н -гексан и получают блед-, но-желтые кристаллы гидрохлорида .
5-гуанидинбензохлорида, В 200 мл пиридина растворяют 28,2 г метансульфоната б-амидино-2-нафтола, В результирующую смесь при охлаждении льдом добавляют полученный гидрохлорид 4нуанидинбензоилхлорида. Смесь перемешивают при охлаждении льдом 1 ч и затем ночь при комнатной температуре, После завершения реакции реак- 35 ционную смесь смешйвают приблизительно с 300 мл диэтилового эфира, Выделенное маслянистое соединение растворяют в 300 мл воды и нерастворимый остаток удаляют фильтрованием. 40
К фильтрату добавляют насыщенный водный раствор гидрокарбоната натрия, при этом осаждаются бледно-желтые. кристаллы. Их собирают фильтрованием, промывают водой и ацетоном и получают. 5
30 r (выход 63 7 ) карбоната 6-амидино-2-нафтил-4-гуанидинбензоата.Карбонат суспендируют в 100 мл метанола, После прибавления 17 r метансульфоновой кислоты в суспензию образуется прозрачный раствор, что сопровождается бурным выделением газа, В раствор добавляют приблизительно 200 мл диэтилового эфира, при этом осаждаются белые кристаллы, которые собирают 55 фильтрованием, и получают диметансульфонат 6-амидино-2-нафтил-4-гуанидинбензоата. ди- па Ра-толуолсульфонат 6-амидино-2-нафтил-4-гуанидинбензоата получают аналогичным образом, Дигидрохлорид 6-амидино-2-нафтил-4-гуанидинбензоата получают добавлением смеси
ДИФ вЂ” хлористый водород к полученному ранее карбонату.
Способ В, К 100 мл пиридина добавляют 8,6 гидрохлорида 4-гуанидинбензойной кислоты и 9,0 r ДПК, Смесь перемешивают
1 ч при охлаждении льдом (реакционная смесь А). К 100 мл пиридина прибавляют 113 г метансульфоната б-амидино-2-.
-нафтола. В эту смесь при перемешива-. нии и охлаждении льдом порционно при» бавляют реакционную смесь А в течение
1 ч. После окончания прибавления результирукнцую смесь перемешивают еще
1 ч и затем ночь при комнатной температуре. Осевшие кристаллы собирают фильтрованием, промывают пиридином и ацетоном, Затем кристаллы растворяют приблизительно в 200 мл воды и нера» створимую ДПМ удаляют фильтрованием.
В фильтрат добавляют насьпценный водный раствор бикарбоната натрия, при этом осаждаются бледно-желтые кристаллы, Их промывают водой, аце тоном и получают 15 г (выход 79,8%) карбоната б-амидино-2-нафтил-.4-гуанидинбензоата. Из этого карбоната ° могут быть получены другие соли кислотного присоединения аналогично способу А.
Пример 16 (соединение,28), Синтез 6-амидино-2-нафтил-4-(Н—
t6 метил) гуанидинбензоата
В 150 мл метанола суспендируют
19 г гидрохлорида паяц-метиламинобензойной кислоты. После добавления
8,4 г цианамида смесь перемешивают о в течение ночи при 50 С. Из реакционной смеси перегонкой под понижен— ным давлением удаляют растворитель, остаток смешивают с 20 мл этанола и тщательно перемешивают. Затем добавляют еще 200 мл этилацетата и смесь продолжают перемешивать до образования коричневого твердого соединения, которое собирают фильтрова22
21
1176832
©-соо
ФИН
БН2
Гагсоо
СязСО
CF3 RH % NH жн, СОО сн
СОО
NH ми, Н2Х
ЖН ) щ 40
ЯК 45
Пример 18. Следующие сое- 5р динения получают так же, как в примера» 1-3;
00 соо
5Hg$0g ОГ"
ФЮН » 2 55
5Н %
СООН
ИИ
-N
Н2Ы Н нием, после чего обработку повторяют и получают 14 r бледно-коричневого
Ж порошкообразного гидрохлорида 4-(N— метил) гуапидинбензойной кислоты.
В 100 мл .пиридина растворяют
4,6 г по |ученного ранее гидрохлорида
4-(11 -метил) гуанидинбензойной кисл-ты, а затем 6,2 г ДПК, Смесь перемешивают при комнатной температуре
30 мин, затем смешивают с 5,6 г метансульфоната 6-амидино-2-нафтола и перемешивают в течение ночи при комнатной температуре. Нерастворимый остаток собирают фильтрованием, суспендируют в 50 мл воды, после чего 15 удаляют нерастворимые частицы. В маточную жидкость добавляют 100 мл насыщенп<н о раствора бикарбоната натрия. Смесь перемешивают при охлаждении льдом. Осевшие кристаллы собирают 20 фильтрованием и суспендируют в 5 мл метанола, После прибавления при перемешивании метансульфоновой кислоты для осаждения кристаллов прибавляют диэтиловый эфир, После удаления 25 растворителя остаток растворяют в горячем метаноле, затем раствор охлаждают и смешивают с диэтиловым эфиром для осаждения кристаллов. Кристаллы собирают фильтрованием и получают 3п
0,8 r серовато-белого порошкообразного диметилсульфоната 6-амидино-2 нафтил-4-(N -метил)гуанидинбензоата.
Пример 1 7. Следующие соеди35 нения получают так же, как в примере 16:
СО0
1 еИ 1, И Н
HN СОО
Е,ф лв, Пример 19 (соединение 35), Синтез 6-амидино-2-нафтил-4-амино-3-метилбензоата
В 25 мя ДМФ (безводного) прибавляют 2,2 г метансульфоната 6-амидино-2-н афт ил-3-ме тил-4-нит р î бе н з о ат а, 0,63 г метансульфоновой кислоты и
0,23 r 10Z-ного палладия на угле, В смесь при интенсивном перемешивании пропускают водород, После удаления фильтрованием 1ОЕ-ного палладия, нанесенного на уголь, реакционную смесь смешивают с диэтиловым эфиром для от деления маслянистого соединения, кото рое промывают эфиром и перекристаллизовывают из смеси этанол — диэтиловый эфир, получая при этом 2,8 г порошкообразíîro диметансульфоната
6-амидино-2-нафтил-4-амино-3-метилбензоата, имеющего цвет от белого до бледно-коричневого.
Пример 20 1, Синтез гидрохлорида 4-гуанидино-3-метилбензойной кислоты
1176832
ОР СОО
Ив ЮН н, соа
Cl у Синтез проводят так же, как в примере 7 или 19., Пример 23-1.
Синтез 2-хлор-4-гуанидинбензойной
20 кислоты
С00
HN
-МН
НгХ СН, 2
НК ,,- нМ СОО
К. N
В 140 мл этанола прибавляют 22.,6 г гидрохлорида 4-амино-3-метилбензойной кислоты, а затем 7,6 r цианамида.
После перемешивания в течение ночи при 60 С из реакционной смеси удаляют растворитель перегонкой при пониженном давлении и к смеси добавляют ацетон1 после чего кристаллы собирают фильтрованием. Их промывают ацетоном, перекристаллизовывают из смеси этанола и этилацетата и получают 8,9 г белых кристаллических гранул гидрохлорида 4-гуанидино-3-метилбензойной о кислоты. Т,пл. 231 С (с разложением), Пример 20-2 (соединение 36).
Синтез 6-амидино-2-нафтил-4-r анидин-3-метилбензоата
В 50 мл безводного пиридина прибавляют 4,1 r гидрохлорида 4-гуанидино-3-метилбенэойной кислоты, После прибавления 4,4 r ДПК при охлаждении льдом смесь перемешивают 30 мин и смешивают с 5,0 г метансульфоната
6-амидино-2-нафтола. Смесь перемешивают в течение ночи при комнатной температуре, после чего смешивают с диэтиловым эфиром и кристаллы собирают фильтрованием. Кристаллы промывают диэтиловым эфиром, растворяют в воде и н