Способ анализа смеси азотная кислота-пятиокись азота- четырехокись азота
Иллюстрации
Показать всеРеферат
СПОСОБ АНАЛИЗА СМЕСИ АЗОТНАЯ КИСЛОТА - ПЯТИОКИСЬ АЗОТА - ЧЕТЫРЕХОКИСЬ АЗОТА, отличающийся тем, что, с целью упрощения способа и повышения точности анализа, проводят потенциометрическое титрование анализируемой смеси водой или водным раствором азотной кислоты с концентрацией не более 90 мас.% и по характеристическим точкам кривой титрования рассчитывают содержание компонентов смеси. В СО со СО
СОЮЗ СОВЕТСНИХ
МЯЧ
РЕСПУБЛИН
„.,SU„, 1179199 (51)4 G 01 N 27/52
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
IlO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ
ОПИСАНИЕ HSOBPETEHHR!
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
Е,В (21) 3713856/24-25 (22) 21.03.84 . (46) 15 ° 09.85. Бюл. Ф 34 (72) А.А.Чичиров, Л.M.Амирова, Н.М.Хусаенов, Н.А.Бусыгина, Ю.М.Каргин, А.В.Смоленцев, Г.Г.Гарифзянов и Г.Н.Марченко (53) 543 ° 257. 1(088.8) (56) Авторское свидетельство СССР
Ф 106989, кл. 6 02 N 27/46, 1956.
Марков С.С. Анализ системы
HN0,Н О - Н О методом измерения ее окислителЬйо-восстановительного потенциала. НТИ ГИПХ, Л., 1959, с ° 51.
Авторское свидетельство СССР
У 105938, кл. С 01 N 27/52, 1956. (54) (57) СПОСОБ АНАЛИЗА СМЕСИ АЗОТНАЯ КИСЛОТА — ПЯТИОКИСЬ АЗОТА — ЧЕТЫРЕХОКИСЬ АЗОТА, о т л и ч а ю— шийся тем, что, с целью упрощения способа и повышения точности анализа, проводят потенциометрическое титрование анализируемой смеси водой или ъодным раствором азотной кислоты с концентрацией не более
90 мас.7 и по характеристическим точкам кривой титрования рассчитывают содержание компонентов смеси.
1 1179
Изобретение относится к аналитйческой химии и может быть использовано в различных отраслях химической пр омышле н но сти.
Цель изобретения - упрощение способа и повьннение точности анализа.
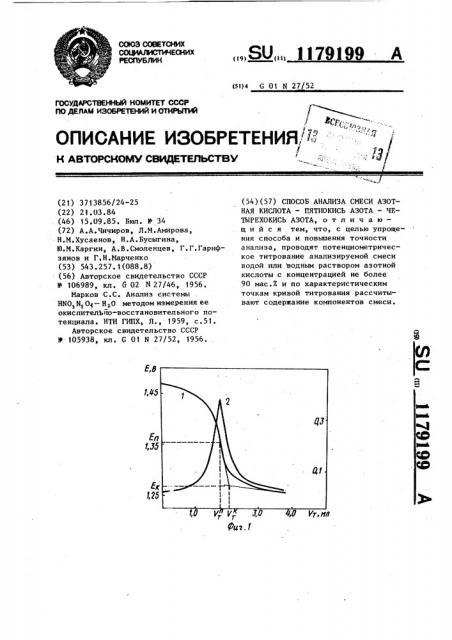
На фиг. 1 представлены кривая 1 потенциометрического титрования и дифференциальная кривая 2 титрования (ЬЕ/ЬЧ), где AE — изменение по- 10 тенциала, а AV — изменение объема титранта; на фиг. 2 — положение точки перегиба (пика) в зависимости от концентрации пятиокиси азота в исходном титруемом растворе концент-15 рация четырехокиси азота в растворах данной серии вблизи точки перегиба 22 вес. % (с учетом разбавления по четырехокиси азота), где
Ся,о †. концентрация пятиокиси аэо- 20 та, соответствующая точке перегиба, о а Сч o> — начальная концентрация пятиокиси азота в титруемом растворе); на фиг. 3 — положение точки перегиба (пика) в зависимости от 25 концентрации четырехокиси азота в исходном. исследуемом растворе вблизи точки окончания скачка (с учетом разбавления раствора по четырехокиси азота); содержание пятиокиси
ЗО азота в растворах данной серии
5 вес.%; на фиг. 4 — зависимость окислительно-восстановительного IIo тенциала в конце скачка (E s) от со-. держания четырехокиси азота в растворе вблизи точки Ея.
Пример. Проводится титрова- ., ние исследуемого раствора и строится кривая Е-Ч (для более точного нахождения точки перегиба можно пост-,40 роить .дифференциальную кривую
АЕ/ЛЧ вЂ” Ч).
Из графика на фиг. 4 определяется содержание четырехокиси азота в растворе. вблизи точки, соответствующей
Е „(Сй о) и по приведенной формуле определяется концентрация И 04 в ис,ходном растворе
К 8, (+Ч Р) я204 50 где С< Π— содержание N 04 в исо е Р. 4 ходном растворе, вес.%.
Cg 0
К а 4 55 растворе вблизи точки, соответствующей Е, вес. %;
199
m, — масса исходного растК вора, г;
Чт — объем добавленного титранта, мл, PT — плотность титранта, г/см .
Далее по графику (фиг. 3), связывающему положение точки перегиба (fn) с содержанием четырехокиси азота в растворе, находим поправочную концентрацию пятиокиси азота (Cg p ), а затем по формуле определяют содержание И, Ор в исходном растворе, и
Рт Сн о *108
Д о 18 m о
С ярО э (2» о где Ся,о — содержание N,O в исходном растворе, вес.%;
VT — объем титранта в точке перегиба, мп, PT — плотность титранта, г/см, Ся„g - содержание воды в титруемом растворе, %/100;
108 и 18 — молекулярные веса N Oy и Н2Q
Содержание азотной кислоты в исо ходном растворе (С1ц1О ) находится по разности
Сняо = 100 — См o — Су 04. (3)
Таким образом, предлагаемый способ позволяет определять содержание всех компонентов, используя одно титрование.
Пример 1. Контрольный раствор пятиокиси и четырехокиси азота в азотной кислоте готовят путем растворения навесок пятиокиси и четы-, рехокиси азота в 100%-ной азотной кислоте. Состав контрольного раствора 10,20% Л 05 и 30,16% И, 04.Пробу контрольного раствора, имеющую вес m - 80,24 r, титруют дистиллированной водой и условиях, описанных выше. По результатам титрования строят интегральную и дифференциальную кривые титрования и находят величины Е „, Ен, V и V . Значение и к
Е равно 1,250 В. Находят (фиг. 4), что содержание четырехокиси азота, определенное в растворе в конце скачка (Сй, 4) равно 29,2% и по формуле (1) с учетом того, что объем. равен
i,18 мл, рассчитывают содержание четырехокиси азота в исходном растворе.
0,0 составляет 29,6%..Поправочная
1i 79199
ДО
ЮО
2,0 о . 1,О
С„ /е
2О
Фиг. 3
АЛО
f,2$
1О 2О Я С /
Яяа4
Составитель А.Федосеев
Редактор М.Петрова Техр д И.Нинц Корректор E.Сирохман
Тираж 897 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Заказ 5665/44
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4 концентрация пятиокиси азота (Су, равна для данного случая 1,96%, Й, наконец, по формуле (2) с учетом того, что V" равен 1,08 мл, определяют содержание пятиокиси азота.
Для данного раствора оно составляет
10,03%.
Пример 2. Анализ контрольного раствора из примера 1 выполняют в тех же условиях, но в качестве титранта используют 60%-ную азотную кислоту. Параметры титрования следующие: и = 80,42, Е к. = 1,250 В;
29,21, Сф О = 1,96%. Применяя ту о jygg /О же математическую обработку, что и в примере 1, получают: Ся 0 о
30,2% H 0 а 10 15%
Пример 3. Контрольный раствор титруют в тех же условиях, что и в примерах 1 и 2, но в качестве титранта используют 90%-ную азотную кислоту. Параметры титрования: m
И = 80,12 г, Е = 1,260 В» Ч. = 7,28 мп, )! О4 26 5% СДр
= 2,09% ° Применяя ту же математическую обработку, что и в примере 1 и
2, получают С о4 = 30,3% и Cg g = !
$. = 10,22%.