Способ получения пиримидо-2-бензазепинов или их фармакологически совместимых кислотно-аддитивных солей (и его вариант)
Иллюстрации
Показать всеРеферат
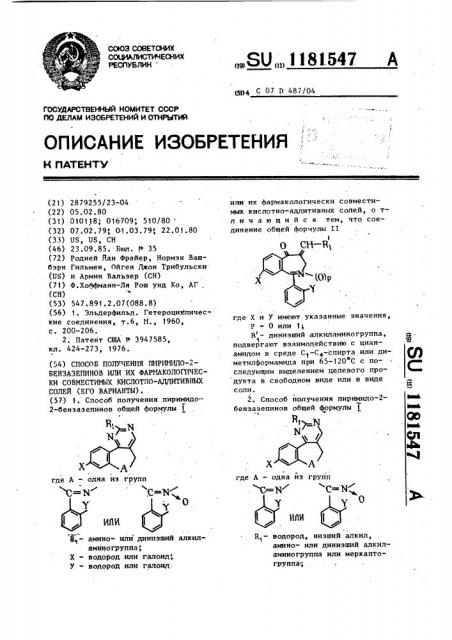
1. Способ получения пиримидо2-бензазепинов общей формулы 1 . о ипи Вцаминоили динизший алкиламйногруппа; X - водород или галоид; У - водород или галоид. или их фармакологически совместимых кислотно-аддитивнмх солей, о тличающийся тем, что соединение общей формулы II О CH-RI где X и У имеют указанные з-начения, Р О или 1; R- динизший Алкиламиногруппа, § подвергают взаимодействию с цианСО амидом в среде С -С4-спирта или диметилформамида при 65-120 С с последующим выделением целевого продукта в свободном виде или в виде соли. 2. Способ получения пиримидо-2бензазепинов общей формулы 00 N где А - одна из групп ИЛИ водород, низший алкил, аминоили динизший алкиламиногруппа или меркаптогруппа-;
СОЮЗ СОВЕТСКИХ
CIWl
РЕСПУБЛИК
1Р), С 07 Р 487/04
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К flATEHTV
0 СИ вЂ” Ry (0)р
Я13м : N
ИПИ амино- или динизший алкиламиногруппа, водород или галоид, водород или галоидХ— уГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 2879255/23-04 (22) 05,02.80 (31) 010118, 016709, 510/80 (32) 07,02 ° 79; 0-1.03 ° 79, 22.01 ° 80 (33) US% USi СН (46) 23.09.85. Бюл. Р 35 (72) Родней Йан Фрайер, Нормэн Вашбэрн Гильмен, Ойген Л кон Трибульски (US) и Армии Вальзер (СН) (71) Ф.Хоффманн-Ля Рош унд Ко, АГ . (СН) (53) 547.891.2.07(088.8) (56) 1. Эльдерфильд. Гетероцишлические соединения, т,6, И., 1960, с. 200-206.
2, Патент CIIIA Р 3947585, кл. 424-273, 1976. (54) СПОСОБ ПОЛУЧЕНИЯ ПИРИИИДО-2БЕНЗАЗЕПИНОВ ИЛИ ИХ ФАРИАКОЛОГИЧЕСКИ COBMECTHNbIX КИСЛОТНО-АДЛИТИВНЦХ
СОЛЕЙ (ЕГО ВАРИАНТЫ). (57) 1. Способ получения пиримидо2-бенэазепинов общей формулы 1 где А — одна из групп с-м с-и а, Y 0
„„SU „„1181547 A илн их фармакологически совместимъпс кислотно-аддитивных солей, о тл и ч а ю шийся тем, что соединение общей формулы ?Т
I где Х и У имеют укаэанные значения, Р = 0 или 1;
Н - динизший .алкиламиногруппа, 1 подвергают взаимодействию с цианамидом в среде Ñ1-С - спирта или диметилформамида при 65-120 С с последующим выделением целевого продукта в свободном виде или в виде соли.
2, Способ получения пиримидо-2бензазепинов общей формулы 1
Х А где А — одна йз груйп с=юг с- я"
Y о
R водород, низший алкил, амино- или динизший алкиламиногруппа или меркаптогруппа;
Х - водород или галоид!
У - водород или галоид, или их фармакологически сьвместимых кислотно-аддитивных солей, о т,л и ч а ю шийся тем, что соединение общей формулы II
О СН-R, (0)p где Х и У имеют указанные значения, P. 0 или
R - динизший алкиламиногруппа, подвергают взаимодействию с соеднненйем общей формулы Т?Т с
Rll с н ън,, где R - меркаптогруппа, или с его кислотно-аддитивной солью, если R„ - водород, низший алкил, амико- или динизший алкиламиногруппа, в С1-С -спиртовом растворе
С1-С -алкоголята щелочного металла, 1181547 в случае необходимости в присутствии хлористого метилена или в формамиде при температуре от комнатной до !
00 С с последующим выделением целевого продукта в свободном виде или в виде соли.
Приоритет п 6 п р и э " какам:
07.02.79 - взаимодействие соединения t1l, где P=1 и R - диметиламиногруппа
Х и У - водород или галоид с атомным номером максимально 35, с соединением Л1, где R — аминогруппа
01.03.79 - взаимодействие соединения н где P 0 и Rt — диметил-..
Э
1 амико, с цианамидом или с соедине нием tn, где R „ — меркаптогруппа, или же взаимодействие соединения It, где R — диметиламино, с соединением
1 и
Ф, где R - водород, низший алкил, 1 амино- или диметиламино, причем
P 0, если В„ — амино., а Х и У вЂ” водород или галоид с атомным номером ., максимально 35.
22.01.80 — взаимодействие соединения и, где P=1, R, — диметиламино группа, с цианамидом или с соединением Н(, где R" - меркаптогруппа.
Х где А — одна иэ групп
lo Сыи С-N у у О
Цель изобретения - создание на основе известного метода епособа по- лучения новых соединений, обладающих ценными фармакологическими свойства- 13 ми с улучшенным действием.
Поставленная цель достигается . согласно способу получения пиримидо- - или
2-бензазепинов общей формулы 20 мых
Изобретение относится к новым производным пиримидо-2-бензазепинов, которые могут быть использованы в медицине в качестве успокоительных и. устраняющих чувство страха средств.
В литературе широко описано получение пиримидинов реакцией циклизации с использованием производных гуанидина, тиомочевины или S-низшей алкилтиомочевины f1), R - амино- или динизший алкил1 аминогруппа;
Х - водород илн галоид;
У - водород или галоид их фармакологнчески совместикислотно-аддитивных солей, за1181547 4
О CH10 гдЕ Х и У имеют указанные значения, P = 0 или 1;
8 — динизший алкиламино, 1 подвергают взаимодействию с цианами- 15 дом в среде С -С -спирта или диме1 4 .о тилформамида при 65 — 120 С с после дующим выделением целевого продукта в свободном виде или в виде соли.
Согласно второму варианту соеди- 20 нение общей формулы Й подвергают взаимодействию с соединением общей формулы
МН вЂ” С
ЙН2.
25 где К вЂ” меркаптогруппа, или с его кислотно-аддитивной солью, если R„ — водород, низший алкил, амико- или динизший алкиламиногруппа в С -С -спиртовом растворе С— т Ф 1.
С4-алкоголята щелочного метала, в случае необходимости в присутствии хлористого метилена или в формамиде при температуре от комнатной до 35
100оС с последующим выделением целевого продукта в свободном виде или в виде соли.
Пример 1. 2-Амино-9-хлор-7фенил-5Н-пирииидо(5,4-d)(2j-бензазе- 40 пин.
К перемешиваемой суспензии, содержащей 10 г (0,032 моль) 8-хлор3,4-дигидро-4- диметиламино)метилен )-фенил-5Н-2-бензазепин-5-она и 8,5 г (0,047 моль) гуанидинкарбоната в 250 мл метанола, одной порцией добавляют 5,1 (0,094 моль) метилата натрия при комнатной температуре в среде аргона. Через 10 мин добавляют 50 метиленхлорид (150 мл) и продолжают перемешивать смесь. Такие же количества метилата натрия и гуанидинкарбоната добавляют еще два раза в2-часовые интервалы, после чего 55 смесь перемешивают в течение ночи, затем ее разбавляют 250 мл метиленхлорида, промывают водой, высушива3 ключающийся в том; что соединение.общей формулы ют над сульфатом натрия и упаривают при пониженном давлении. Кристаллизация остатка из этанола дает светло-. коричневые кристаллы с т.пл. 209210 С. После перекристаллизации из метиленхлорида и этилацетата получают беловатые призмы с т.пл. 210211 С.
Пример 2. 2-Амино-9хлор-7-(2-фторфенил)-5Н-пиримидо
1"5,4-d) $2)-бензазепин.
К перемешиваемой суспензии, со держащей 16 r (0,047 моль) 8-хлор1-(2-фторфенил)-3,4-дигидро-4-(диметилаиинометилен1-5Н-2-бенэазепин5-она и 12,5 г (0,07 моль) гуанидинкарбоната в 460 ил метанола, при комнатной температуре в среде аргона добавляют одной порцией 7,5 r (0,14 моль) иетилата натрия. Через
10 мин добавляют иетиленхлорид (290 мл) и продолжают перемешивать смесь. Такие же количества метилата натрия и гуанидинкарбоната добавляют еще два .раза в 2-х часовые интервалы. Затем смесь перемешивают в течение ночи, после чего ее разбавляют 460 мл иетиленхлорида, промывают водой, высушивают над сульфатом натрия и упаривают при пониженном ,давлении. Перекристаллизация остат-. ка иэ раствора этанола и метиленхлорида дает беловатые кристаллы с т.пл. 245-248 С.
Дигидрохлоридная соль.
Теплый раствор указанного конечного продукта в 100 мл метанола и метиленхлорида в соотношении 1:1 отфильтровывают и концентрируют на половину объема на паровой бане.
Фяльтрат обрабатывают 5 .мл 5,7н. этанолового раствора хлористого водорода и выдерживают 2 ч при комнатной температуре. Светло-желтые кристаллы. отфильтровывают, промывают этанолом и высушивают воздухом, после чего получают дигидрохлоридную соль с т.пл. 232-237оС.
П р и и е р 3. 9-Хлор-2-метил-7фенил-5Н-пирииидо(5,4-d)(21-бензазепин.
К перемешиваемой при комнатной . температуре в среде аргона суспензии, содержащей 1,6 г (0,005 моль)
8-хлор-3,4-дигидро-3"(диметиламино) метилен)-1-фенил-5Í-2-бензазепин-5она и 0,7 г (0,0075 моль) ацетамингидрохлорида. в 50 мл метанола, до,бавляют одной порцией 0,8 г
1181547 (0,015 моль) метилата натрия. После10-минутного перемешивания добавляют 30 мл метиленхлорида и продолжают перемешивать смесь. Через 2 ч добавляют еще 0,8 r (0,015 моль) ме- тилата натрия и 0,7 r (0,0075 моль) ацетамидингидрохлорида. Еще через
2 ч добавляют еще раз 0,015 моль метилата .натрия и 0,0075 моль ацетамидингидрохлорида и перемешивают смесь в течение ночи при комнатной температуре. После разбавления смеси
50 мл метиленхлорида ее промывают водой, высушивают над сульфатом натрия и упаривают при пониженном, давлении. После растворения остатка в 20 мл теплового гексана и охлаждения происходит кристаллизация.
Упариванием растворителя полунают еще одну порцию продукта. Рекристаллизацией из гексана (древесного угля) получают беловатые кристаллы с т.пл. 120-122 С.
Пример 4. 9-Хлор-7-(2-фторфенил) -2-метил-5Н-пиримидо $5, 4-d ) (2 -бензаэепин.
К суспензии, содержащей 5,1 r (0,015 моль) 8-хлор-1-(2-фторфенил)—
3,4-дигидро-4-((диметиламино)метилен)-5Н-2-бензазепин-5-она и 2,1 г (0,0225 моль) ацетамидингидрохлорида в 150 мл метанола, перемешиваемой при комнатной температуре в среде аргона, добавляют одной порцией 2,4 r (0,045 моль) метилата натрия. После 10-минутного переме,шивания добавляют 90 мл метиленхлорида и продолжают перемешивать. Через 2 ч добавляют еще 2,4 r (0,045 моль) метилата натрия и 2,1 r (0,0225 моль) ацетамидингидрохлорида. После 2-часового интервала повторяют добавку, в которую входит
0,045 моль метилата натрия и
0,0225 моль ацетамидингидрохлорида, и продолжают перемешивать смесь в течение ночи при комнатной температуре. Разбавив смесь 150 мл метиленхлорида, ее промывают водой, высушивают над сульфатом натрия и упаривают при пониженном давлении.
Рекристаллизация остатка иэ гексана (древесного угля) дает белые о кристаллы с т.пл. 104-107 С.
Пример 5. 9-Хлор-7-(2° фторфенил)-5Н-пиримидо15,4-dj (2)бензазепин-2-амин и 9-хлор-7-(25
За
55 фторфепил)-N, N-диметип-5Н-èèpèìèäî (5,4-d .1 (2)-бензаэепин-.2-амин.
Раствор, содержащий 7,0 r (0,0204 моль) 8-хлор-1 †(2 — фторфенил)3,4-дигидро-4-((диметиламино)метилен)-5Н-2-бензазепин-5-она и 3,5 г (0,0833 моль) цианамида в 300 мл абс. этанола, нагревают 18 ч с обратным холодиЛьником и упаривают досуха. Остаток промывают водой, отфильтровывают и дважды пегекристаллизовывают из метанола с получением
N,N-диметиламиносоединения. Фильтраты концентрируют, отфильтровывают перекристаллиэовывают иэ метанола с получением аминосоединения.
Фильтраты упаривают, растворяют в дихлорметане и подвергают хроматографии на флоризиле (Florisil). Колонку элюируют дихлорметаном, который упаривают, выкристаллизовывают иэ метанола и получают другую порцию, N,N-диметиламиносоединения. Пробу этого продукта перекристаллизовывают иэ дихлорметана и эфира с получением игольчатых кристаллов с т.пл.
175-180 С. Затем колонку элюируют
5Ж-ным раствором эфира в дихлорметане и эфиром. Эфирную фракцию упаривают и выкристаллизовывают из метанола с получением другой порции аминосоединения, часть которой перекристаллизовывают из метанола с получением белых призматических кристаллов 9-хлор-7-(2-Аторфенил)—
5Н-пиримидо-(5,4-d)(2)-бензазепин-2амина с т.пл. 242-247 С, содержащему 0,2 г (0,5 ммоль) N,N-диметиламиносоединения в 5 мл метанола, добавляют 0,05 г (О 5 моль) метансульфокислоты. Метанол упаривают, а масло кристаллизуют иэ изопропанола и пере- . кристаллизовывают из метанола и эфира с получением желтых призматических кристаллов 9-хлор-7-(2-Аторфенил)N,N-диметил-5Н-пиримидо (5,4-dg (2 )бензазепин-2-амина с т.пл. 190-195 С.
П р е р 6. 9-Хлор-7-(2-хлорфенил)-2-метил-5Н-пиримицо(5,4-d3 (23 бенэазепин.
5,5 г (58 ммоль) ацетамидинхлоргидрата и 15 мл (62 ммоль) 4,12 M этанолового раствора метилата натрия добавляют пятью одинаковыми порциями в течение 3 ч к раствору, содержащему
3,5 r (10 ммоль) 8-хлор-1-(2-хлорфенил)-3,4-дигидро-4 ((диметиламино)метилен)-5Н-2-бензазепин-5-.она в 140 мл
1181
7 метанола и 140 мл хлористого метилена. Смесь разбавляют водой и экстрагируют хлористым метиленом. Метиленхлоридный раствор промывают водой и высушивают безводным сульфатом:натрия 5 после концентрирования которого при пониженном давлении получают желтое масло. Масло растворяют в 10 мл (10 ммоль) 1 М метанолового раствора метансульфокислоты с получением со- 10 ли, которую осаждают добавкой эфира, Ъ после чего получают желтые призмати-ческие кристаллы с т.пл. 197-198 С. о
Перекрнсталлизация из смеси метанола и эфира дает желтые призматические 15 кристаллы с т.пл. 197-198 С.
П р и м.е р 7. 9-хлор-7-(2-хлорфенил)-5Í-пиримидо(5,4-й) (2$-бензазепин.
21 r (200 ммоль) формамидинацета- 20 та и 32,5 мп (135 ммоль) 4, 12 М метанолового раствора метилата натрия добавляют пятью одинаковыми порциями в течение 3 ч к раствору 7,2 г
Ф (20 ммоль) 8-хлор-1-(2-хлорфенил) - 25
3,4- дигидро-4-((диметиламино)метилен)-5Н-2-бензазепин-5-она в 270 мл метанола и 270 мл хлористого метилена.
Раствор разбавляют водой, экстрагируют хлористым метиленом, промывают 5б водой, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении с получением желтого масла. После очистки путем колоночной хроматографии (100 r силикаге35 ля), растворитель — хлористый метилен и этилацетат в соотношении 1:1 .получают целевой продукт с т.пл.
122-124 С. Перекристаллизация из о эфира дает светло-желтые призмати- аО ческие кристаллы с т.пл. 122-125 С.
Пример 8. 9-хлор-7-(2-хлорфенил)-2-изопропил-5Н-пиримидо(5,4Й) (2 3-бензазепин.
Смесь, содержащую 3,5 г(10 ммоль) 45
1-(2-хлорфенил)-3,4-дигидро-4- (диметиламиио)метилен)-5Н-2-бензазепин-5-она, 4,8 г (40 ммоль) изобутирамидинхлоргидрата, 10 мл (41 ммоль) (V) 4,12 М метанолового 50 раствора метилата натрия и 100 мл метанола, перемешивают 2 ч при комнатной темнературе. Смесь разбавляют водой и экстрагируют хлористым метиленом, Метиленхлоридный раствор 55 высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении с получением желтого
547 8 масла. Кристаллизацией масла эфиром получают светло-желтое вещество с т.пл. 127-129 С. Перекристаллизация из смеси эфира с петролейным эфиром дает бесцветные палочкообразные кристаллы с т.пл. 127-129 С.
Пример 9. 2-Амино-9-хлор7-(2-хлорфенил)-5Н-пиримидо«5,4"Й) (2 )-бензазепин.
14,4 r (80 ммоль) гуанидинкарбоната и 20 мл (82 ммоль). (Ч) 4, 12 И метанолового раствора метилата натрия добавляют двумя одинаковыми порциями в течение 90 мин к раствору, содержащему 3,6 r (10 ммоль)
8-хлор-1-(2-хлорфенил)-3,4-дигидро-4-((диметиламино)метилен)-5Н-2бензазепин-5-она в 100 мл метанола.
Смесь разбавляют водой и экстрагируют хлористым метиленом. Метиленхлоридный раствор высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении с получением желтого масла. Кристаллизацией масла хлористым метиленом получают белое твердое вещество с т.пл. 240-241 С. Перекристаллизация из смеси. эфира с хлористым метиленом дает бесцветные игольчатые кристаллы с т.пл. 240-241 С.
Пример 10. 7-(2-Хлорфенил)2-метил-5Н-пиримидо55,4-Й)(2 )-бензазепин-метансульфонат.
7,2 (76 ммоль) Лцетамидинхлор - гидрата и 18 мл (80 ммоль) 4,46 М метанолового раствора метилата натрия добавляют четырьмя одинаковыми порциями в течение 3 ч к раствору
4,5 г (14 ммоль) 1-(2-хлорфенил)3,4-дигидро-4- (диметиламино)-метилен -5Н-2-бензазепин-5-она в 180 мл метанола и 180 мл хлористого метилена. Смесь разбавляют водой и эк"трагируют хлористым метиленом. Метиленхлоридный раствор промывают водой, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении с получением желтого масла. Масло растворяют в смеси, содержащей 15 мл изопропанола и 1,3 r (14 ммоль) метансульфокислоты, после чего удаляют изопропанол при пониженном давлении.
Остаток выкристаллизовывают из смеси эфира и хлористого метилена с получением светло-желтого твердого вещества с т.пл. 147-151 С. Перекристаллизацией из смеси эфира и
1181547
25 хлористого метилена получают желтые призматические кристаллы в виде нолугидрата с т.пл. 159-1 60 С.
Пример 11. 2-Метил-7-фенил5Н-пиримидо(5,4-d)$23-бензаэепинДигидрэхлорид.
9,0 r (95 ммоль) ацетамидинхлоргидрата и 22,5 мп (0,2-0,1 моль)
4,46 М метанолового раствора метилата натрия добавляют пятью одина- 1О ковыми порциями в течение 3 ч к раствору, содержащему 4,5 г (15 ммоль) 1-фенил-3,4-дигидро-41(диметиламино)метилен)-5Н-2-бензазепин-5-она в 180 мл метанола и 15
180 мл хлористого метилена. Смесь разбавляют .водой и экстрагируют хлористым метиленом. Метиленхлоридный раствор промывают водой, высушивают над безводным сульфатом 20 натрия и концентрируют при пони- женном давлении с получением масла, которое растворяют в избытке
6Х метанолового хлороводорода. Растворитель затем удаляют досуха при пониженном давлении. Остаток выкристаллизовывают из смеси эфира и хлористого метилена с получением белого твердого вещества с т.пл. о
211-221 С. Перекристаллизацией из 50 смеси метанола и эфира получают хлопьевидные белые кристаллы с т.пл. 217-227 С.
Пример 12, 9-Хлор-7-(2-хлор. фенил) -5Н-пиримидо(5 4-d7 $27-бензаэеЭ
35 пин-2-тиол.
Смесь, содержащую 2,8 г (7,8 ммоль)
8-хлор-1(2-хлорфенил)-3,4-дигидро-4((диметиламино)метилен)-5Н-2-бензазепин-5-она, 2,8 r (37 ммоль) тиомо- i0 чевины и 8,0 мл (32 ммоль) 4,0 .метанолового раствора и метилата натрия в 80 мл метанола, перемешивают 18 ч при комнатной температуре. Смесь разбавляют водой и экстрагируют эфиром. 5
Водный слой нейтрализуют уксусной кислотой и экстрагируют хлористым метиленом. Раствор хлористого метилена высушивают над безводным сульфатом натрия и концентрируют при по-. 50 ииженном давлении с получением желтого твердого вещества с т.пл.
238-239 С. После перекристаллизации из тетрагидрофурана получают желтые кристаллы с т.пл. 232-234 С.
Пример 13. 9-Хлор-7-(2-фтор,фенил)-5Н-пиримидо (5,4-d) (2 )-бензазепи .
I0
Смесь, содержащую 34,2 г(0,1 мсль)
8-хлор-3,4-дигидро-1-(2-фторфенил)4-((диметиламин ) метилен1-5Н-2бензаэепин-5-она, 62,4 r (0,6 моль) формамидинацетата и 35 r (0,63 моль) метилата натрия в 700 мл метанола перемешивают 3 ч при комнатной температуре, барботируя через раствор азота. Смесь разбавляют водой и экстрагируют хлористым метиленом.
Раствор хлористого метилена высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении с получением красного масла. Масло суспендируют в кипящем гексане, а гексановый раствор декантируют. После охлаждения собирают целевой продукт путем фильтрации.
Иерекристаллизацией из циклогексана получают беловатые кристаллы с т.пл. 123-125 С.
Пример 14. 2-Амино-9-хлор7-(2-.фторфенил)-5Н-пиримидо(5,4-d)
f2)-бензазепин-б-оксид.
В течение 2 ч к раствору, содер- жащему 7,0 r (20 ммоль) .8-хлор-1.(2-фторфенил)-3,4-дигидро-4- 1(диметиламино)метилен1-5Н-2-бенэазепин5-он-2-оксида в 210 мл метанола, добавляют двумя одинаковыми порциями
28 r (150 ммоль) гуанидинкарбоната и 38 мл (150 ммоль) 4,09 М метанолового раствора метилата натрия.
Смесь разбавляют водой и экстрагируют хлористым метиленом. Иетиленхлоридный раствор высушивают безводным сульфатом натрия и концентрируют при пониженном давлении с получением твердого красного вещества. Перекристаллизацией из смеси метанола и этилацетата получают целевой продукт в виде желтых игольо чатых кристаллов с т.пл. 320-323 С.
Пример 15. 9-Хлор-7-(2хлорфенил)-2-метил-5Н-пиримидо
1,—
5,4-d) f2 7-бенэазепин-б-оксид.
Смесь, содержащую 1 г (2,8ммоль)
8-хлор-1-(2-хлорфенил)-4- ((диметиламино)метилен)-3,4-дигидро-5Н-2бензазепин-5-он-5-оксида, 1,0 г (11 ммоль) ацетамидингидрохлорида и 2,0 мл (9,9 ммоль) 4,46 М метанолового раствора метоксида. натрия в смеси 20 мл метанола и 20 мл хлористого метилена, 2 ч перемешивают при комнатной температуре. Смесь разбавляют водой и экстрагируют хлористым метиленом. Метиленхлоридный раствор
1181547
12 l0 цвета. иромь»ваю» водой, сушлт безводным сульфатом натрия и концентрируют досуха при пониженном давлении. Перекристаллизацией остатка из смеси . эфира и хлористого метилена получают 5 бесцветный твердый продукт с т.пл.
215-216 С.
Пример 16. 9-Хлор-7-(2хлорфенил)-5Н-пиримидо(5,4-d)(2Jбензазепин.
Смесь, содержащую 90,5 r (0,25 моль) 8-хлор-1-(2-хлорфенил)3,4-дигидро-4-1(диметиламино)метилен -5Н-2-бензазепин-5-она, 100 г (0,96 моль) формамидинацетата и 1,0л15 формамида, нагревают 16 ч на паровой бане. Смесь охлаждают до 0 C полученный осадок собирают фильтрацией.
Осадок промывают водой и сушат до достижения поставленного веса, по- 20 лучая кристаллы с т.пл. 120-121 С, беловатого цвета.
Пример 17. 9-Хлор-7-(2-фтор.— фенил-5Н-пиримидо)-5,4-d)(2 j-бензазепин-б-оксид. 25
Смесь, содержащую 0 4 г (1,1 ммоль)
8-хлор-1-(2-фторфенил)-3,4-дигидро4- ((диметиламино)-метилен )-5H-?-бензазепин-5-он-2-оКсида, 1,0 г(9,6 ммоль) формамиденацетата и 20 мл формами- щ да, нагревают на паровой бане 6 ч.
Смесь выливают на лед и экстрагируют хлористым метиленом. Метиленхлоридный раствор промывают водой, сушат безводным сульфатом натрия и кон35 центрируют при пониженном давлении.
Остаток кристаллизуют с добавлением смеси эфира и хлористого метилена, получая кристаллы с т.пл. 186-188 С беловатого цвета.
Пример 18. 9-Хлор-7-(2хлорфенил)-5Н-пиримидо (5,4-d j (2jбензазепин-б-оксид.
Смесь, содержащую 0,4 г (1,1 ммоль)
8 -хлор-1-(2-хлорфенил) -3,4-дигидро. 4- ((диметиламино) метилен1-5Н-2бензазепин-5-он-оксида и 1,0 г (9,6 ммоль) формамидинацетата в ,20 мл формамида нагревают 7 ч на паровой бане. Смесь выпивают на лед и экстрагируют хлористым метиленом.
Метиленхлоридный раствор промывают водой, сушат безводным сульфатом натрия и концентрируют раствор при пониженном давлении. Остаток расти- 55 рают с эфиром, получают твердый продукт с т.пл. 215-217 С беловатого
Пример 19. 9-Хлор-7-(2фторфенил)-5Н-пиримидо(5,4-d)1 ? )бензазепин-2-тиол-б-оксиц.
Смесь, содержащую 1,5 r (4 мм» вь)
8-хлор-1-(2-фторфенил)-3,4-дигидро4- ((диметиламино)метилен .»-5Н-2-бен iа 3епин-5-он — 2-.оксида, 1, 5 г (20 ммоль) тиомочевины и 5 мл 4 И раствора метоксида натрия в 30 мл метанолл, перемешивают 5 ч при комнатной температуре. Смесь выливают в воду и экстрагируют хлористым мЕтиленом.
Водный раствор подкисляют уксусной кислотой и экстрагируют хлористым метиленом. Метиленхлоридньп» раствор сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток растирают с хлористым метиленом, получая твердьп» продукт оранжевого цвета. Перекристлллизлцией из хлористого метилена получлют продукт в виде оранжевых кристаллов с т.пл. 323-325 С (с разложением) .
Пример 20. 9-Хлор-7-(2фторфенил)-5Н-пиримидо(5,4-dj (21бензазепин-2-амин-6-оксил и 9-хлор-7(2-фторфенил)-N,N-диметил-5Н-пиримидо (5,4-»1)(2)-бензазепин-?-лмин6-оксид.
Раствор, содержащий 0,5 г (1,39 ммоль) 8-хлор-1(2-фторфенпл)4-((диметиламино)метилен ) 3,4дигидро-5Н-2-бензазепин-5-он-2оксида и 0,5 г (11,9 ммоль) цилнамида в 6 мл N,N äèìåòèëôîðìëì»»äë, о нагревают 4 ч при 85 С. После охлаждения смесь разделяют на 75 мл дихлорметана и 50 мл воды. Оргаш»»некий слой высушивают и концентрируют.
Остаток очищают толстослойной хроматографией на силиклгеле с применением этилацетата/метанолл (20л) в качестве элюента. Полосы, имеющие
Rg 0,5 и 0,7, удаляют и перекристаллизовывлют отдельно из дихлорметана/метанола для получения 9-хлор7-(2-фторфенил)-5Н-пиримидо(5,4-dj
21-бензазепин-2-амин-6-оксидл и
9 хлор-7-(2-фторфенил)-N,N-диметил5Н-пиримидо(5,4-d) (2 )-бензлэепин2-амина-6-оксида соответственно.
9-Хлор-7-(2-фторфенил)-5Н-пиримило (5,4-d)(2)-бензазепин — 2-лмин-6оксид получают в виде <есцветнь»х призм с т.пл. 3!0-350» и 9-хлор-7(2-фторфенил)-N,N-диметил-5Н-пир»»1 мидо (5,4-d) (2)-бензлзепин-2-лмив13
) l 81547
14
Продолжение табл,1 б-оксид получают в виде желтых прутков с т.пл. 212-218 С..
Пнримидо-2-бенэаэепины общей формулы 1 и их фармакологическн совместимые кислотно-аддитивные соли 5 являются полезными фармацевтическими продуктами и отличаются успокаивающими и устраняющими чувство страха н беспокойствия средствами. Эти соединения можно применять в виде обычных фармацевтических препара- тов.
В -табл. 1 приведены исследованные соединения, в табл. 2— результаты, полученные после проведенных на указанных соединениях ис-. пытаний; опыт с наклонным экраном, BloK на лапу, опыт на неанестезированной кошке и антипентаметнлентетразоловый тест (метраэоловый), а 20 также указывает на соответствующую токсичность.
Соеди некие
Вещество
Известд ное 2 )
Х 8-Хлор-б-фенил-1,4-дигидропираэоло-(4,3-dj(2)-бенэазепин
Таблица1
Вещество
Соединение
Предлагаемое
А,Таблица 2
)400
А, 2,5 1000
0,59
215
C.
3 125
0,52
71000
Ъ 400
0,37
900
7400
10.)400
10 у1 000
0,25
0,89
141
9-Xrrîð-7-(2-хлорфенил)-2-мет -5Н- римидо )5 > 4-Ц (2 ) бензазепин
9-Хлор-7-(2-хлорфенил)-5Н- . 35 пиримидо(5,4-d) )2)-бенэазепин
С 9"Хлор-7-(2-фторфенил)-5Нпиримидо(5,4-d)(2)-бензазепин-2- амин
D 9-Хлор-7-(2-фторфенил)-5Нпиримидо(5,4-dj(23-бензазеЕ 9-Хлор-7-(2-фторфенил)-N Nдиметил-5Н-пиримидо15, 4-<11 (21-бевзазепин-2-амин
F 9-Хлор-7-(2-хлорфенил)-5Нпиркмндо(5,4-d)(2)-бензаэепин-6-оксид
8-Хлор-6- (2-фторфенил) -1, 4дигидро-1-метилпиразоло(4,36.1(2)«бенэазепин
8-Хлор-2-метил-б-фенил-2Н, 4Н-пиразоло-(4,3-d) (2 )-бензазепин-гидрохлорид. 1181547!
Продолжение табл 2 20
7400
) 1000
) 1000
7100
2,5
158
25
10 р 100
158
775 по — перорально.
Составитель И.Бочарова
Техред Ж.Кастелевич Корректор M-Пожо
Редактор А.Козориз
Заказ 5954/63 Тираж 383 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Иосква, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r. ужгород, ул. Проектная, 4
Таким образом, токсичности всех соединений находятся в области одного и того же порядка величин, причем соединения D и, в частности, Е более токсичны, чем остальные.
В опыте с наклонной плоскостью— за исключением соединения F — не наблюдается превосходства. В опыте на неанестезированной кошке получаемые предлагаемые соедннения — за исключением двух соединений В и Е превосводят по действенности извест- д ные вещества. В опыте с шоком лапы и в метразоловом опыте все предлагаемые вещества превосходят по дей.ственности известные вещества, при этом превосходство в метразоловом опыте выражается особенно ярко.
Таким образом, предлагаемые соединения не только в общей сложности превосходят известные вещества в количественном отношении, но и обладают также иной картиной действия, в частности особенно ярко выраженной эффективностью в метразоловом опыте.