Способ получения 3-хлорцефемов
Иллюстрации
Показать всеРеферат
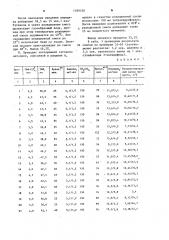
СПОСОБ ПОЛУЧЕНИЯ 3-ХЛОР- ЦЕФЕМОВ формулы I. S . С1 COORi где R - еложноэфирная защитная группа , такая как 4-нитробен&ил, бензгидрил, 2,2,2-трихлорэтил , бензил, пивалойлоксимётил , трет-бутил или фенацип путем взаимодействия 3-оксицефемового соединения с активным соединением хлора в среде органического растворителя с последующим переводом свободного основания в аддитивную соль с кислотой, отличающийся тем, что, с целью упрощения процесса , в качестве 3-оксицефемового соединения используют соединение формулы 11 ;. К-СШН-г- П Qj-l.OH COORi где R имеет указанные значения; .R - атом водорода, метил, бензил , 4-хлорбензилj фенокси-метил , тиенил-2-метил-, .формилоксибензил или 0 бензгидрилоксикарбонилбензил , . и его подвергают взаимодействию с 3,5-4,5 эквивалентами комплекса три .Ш фенилфосфита с хлором формулы П1 (Л Р-сц в качестве активного соединения хлора в среде инертного в условиях реакции органического растворителя в присутствии 1-3 эквивалентов акцептора галогена, такого как амилен, цик00 лопентен, циклогексен, 1,5-циклоок;о тадиен или. м-диметоксибензол, и 2,3-4,6 эквивалентов третичного ами00 ел на, такого как пиридин, хинолин,триэтиламин ,диэтиланилин,2,6-лутидин или 1,5-диазабицикло
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (l9) (Il) 1
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ и .
ВКЬЛЫЫ : -
R,— сонн м он
С0081. Q +n, 3 нс н
0 C1
СОоа1
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3534851/23-04 (62) 2879251/23-04; 3370149/23-04 (22) 10.01.83 (23) 01.02.80; 07.01.82 (31) 8470 .(32) 01.02.79 (33) П> (46) 30.10.85. Бюл. У 40 (71) Зли Лилли энд Компани (VS) (72) Лоуэлл Делосс Хатфилд, Ларри
Крис Бласчак и Джек Вэйн Фишер (US) (53) .547.869.1.07 (088.8) (56) Патент СССР У 676166; кл..С 07 D 501/59, 1973 (прототип) . (54)(57) СПОСОБ ПОЛУЧЕНИЯ 3-ХЛОРЦЕФЕИОВ формулы где R1 — сложноэфирная защитная группа, такая как 4-нитробенЗил, бензгидрил, 2,2,2-трихлорэтил, бензил, пивалоилоксиметил, трет-бутил или фенацил путем взаимодействия 3-оксицефемового соединения с активным соединением хлора в среде органического растворителя с последующим переводом свободного основания. в аддитивную соль с кислотой, отличающийся
I тем, что, с целью упрощения процесса, в качестве 3-оксицефемового соединения используют соединение формулы Ir (51)4 С 07 D 501 5 / А 61 К 3/545 где R имеет указанные значения; .R — атом водорода, метил, бензил, 4-хлорбензил, фенокси-. метил, тиенил-2-метил-, 0 .формилоксибензил или. К— бензгидрилоксикарбонилбензил, и его подвергают взаимодействию с
3,5-4,5 эквивалентами комплекса трифенилфосфита с хлором формулы ?И в качестве активного соединения хлора в среде инертного в условиях реакции органического растворителя в присутствии 1-3 эквивалентов акцептора галогена, такого как амилен, циклопентен, циклогексен, 1,5-циклооктадиен или м-диметоксибензол, и
2,3-4,6 эквивалентов третичного амина, такого как пиридин, хинолин,триг. этиламин, диэтиланилин, 2, 6-лутидин или
1, 5-диазабицикло(5, 4, О) ундецен-5, на
1 эквивалент 3-оксицефемового соединения формулы при температуре от -25 ,до -10 С с последующим введением в реакционную смесь 3-10 эквивалентов. низшего алифатического спирта, такого как изобутанол, 1,2-пропандиол, 1,3-пропандиол, 2-метипбутанол, 1,2-.
;бутандиол или 1,3-бутандиол,н хлорис- того водорода при температуре от -15 до +30 С.
Изобретение относится к способу получения 3-хлорцефемов формулы
118935О 2 цефемов формулы 1 3-оксицефемовое соединение формулы
НС1 Нф
Ы С1
COORS которые являются полупродуктами в синтезе антибиотиков цефалоспоринового ряда, а также сами обладают свойствами антибиотиков.
Известен способ получения 3-хлорцефемов формулы I который заключается в том, что соответствующий слож- 20 ный эфир 7-амино-3-окси-3-цефем-4- . карбоновой кислоты подвергают взаимодействию с активным соединением хлора в безводном диметилформамиде при 5-15 С с последующим выдерживао нием реакционной смеси при комнатной. температуре в течение 4-8 ч, затем выделяют свободное основание и переводят его в соль обработкой кислотой в растворителе (1) .
Предпочтительно в качестве активного соединения хлора используют треххлористый фосфор, Активное соединение хлора образует с диметилформамидом хлорид хлори- З5 миния формулы
CН3 +
N=CH Cl
СН
С1
40 который является хлорирующим агентом в реакции.
Недостатком известного способа 45 является то, что в качестве исходного продукта необходимо использовать цефем в неокисленной форме, содержащий в положении 7 свободную аминогруппу, который получают из 7- 50 ациламидоцефалоспорин-S-оксида двухстадийным способом с применением реакций деацилирования и восстановления.
Целью изобретения является упро- 55 щение процесса.
Эта цель достигается тем, что согласно способу получения 3-хлоргде R . — сложноэфирная защитная груп-! па,такая как 4-нитробензил, -10 бензгидрил, 2,2,2-трихлорэтил,пивалоилоксиметил,третбутил нли фенацил, 0
ll в-сомн
0 W OH
Il
coom, где К1 имеет указанные значения;
R — атом водорода, метил, бензил, 4-хлорбензил, феноксиметил, тиенил-2-метил, М -формилоксибензил или М -бензгидрилоксикарбонилбензил, подвергают взаимодействию с 3,5-4,5 эквивалентами комплекса трифенилфосфита с хлором формулы П1 в среде инертного в условиях реакции органического растворителя в присутствии 1 — 3 экв. акцептора галогена, такого как амилен, циклопентен, циклогексен, 1,5циклооктадиен или м-диметоксибензол, и 2,3-4,6 экв. третичного амина, такого как пиридин, хинолин, триэтиламин, диэтиланилин, 2,6-лутидин кпи 1,5-диазабицикло(5,4,0)— ундецен-5, на 1 экв. 3-оксицефемового соединения формулы П при температуре от -25 до -10 С с последующим введением в реакционную смесь
3-10 экв. низшего алифатического спирта, такого как изобутанол,1,2пропандиол, 1,3-пропандиол, 2-метилбутанол, 1,2-бутандиол или 1,3-бутандиол, и хлористого водорода при температуре от — 15 до ФЗО С. о
Предлагаемый способ позволяет в одну стадию получить 3-хлорцефемы в неокисленной форме и со свободной аминогруппой в положении 7 исходя из 7-ациламидо-3-оксицефем-S-оксидов путем одновременного деацилирования
7-ациламидогруппы, замены 3-оксигруппы на 3-хлор и восстановления
S-оксида и таким образом значительно упростить процесс получения 3-хлорцефемов формулы I .
В следующих примерах спектры ядерного магнитного резонанса (яИР) получены на Вариан Ассосиэйтс Т-60 спект1189350 4 рометре с использованием тетраметилсилана в качестве внутреннего стандарта.
Пример 1. Гидрохлорид 4-нитробензил-7-амино-3-хлор-3-цефем-4карбоксилата.
Раствор кинетического комплекса трифенилфосфита с хлором (ТФФ-Cf ) получают в результате одновременного введения хлора. и трифенилфосфита 10 (36,8.мл, 3,5 экв. на 1 экв. цефемсульфоксида, т.е. 22,3 г) в 150 мл хлористого иетилена при температуре о от -20 до .-10 C при поддержании слабого желтого цвета реакционной смеси в процессе совместного введения реагентов. При введении последних капель трифенилфосфита в реакционную смесь она дает отрицательные результаты по отношению к водно- 20 крахмальному тесту на хлор. После охлаждения смеси до -25 С к ней добавляют последовательно 5,1 мл амилена и 2,3 г 4-нитробензил-7-феноксиацетамидо-3-окси-3-цефем-4-карбоксилат-1-оксида.
После перемешивания в течение
25 мин при температуре от -15 до
-10 С начинают введение в смесь по о каплям- 11 мл (3,4 экв. на 1 экв. це- З0 фемсульфоксида) пиридина в 30 мл хло- ристого метилена. Введение пиридина продолжают в течение 53 мин. Спустя
50 мин после окончания введения пиридина к реакционной смеси добавляют 37 мл (10 экв.) изобутанола и пропускают через реакционную смесь газообразный HCf в течение 6 мин.
Целевой продукт кристаллизуют из раствора и выделяют фильтрованием, 40 после чего промывают 100 мл хлористого метилена и сушат в вакууме.
Выход 6,4 r (377).
ЯМР-спектр (ДМСО д-6), о,ррт:
4,07 (бс 2); 5,33 (кв. 2, Л = 4,5 Гц, Р -лактам Н); 5 (с, 2); 7,8-8, 3 45 (A! H) и 3,6 (очень широкий с,-NH ).
Пример ы 2-45. Описанную в примере 1 реакцию осуществляют, варьируя условия, с целью оптимизации процесса.
В табл. 1 приведены результаты проведенных исследований.
Природа субстрата (цефемсульфоксиды) и его количество (22,3 и), количество растворителя для пиридина — хлористого метилена (30 мл) и количество изобутанола (37 мл) остаются неизменными для каждого из приведенных в табл. 1 примеров.
Пример 46. 4-Нитробензил-7амино-3-хлор-3-цефем-4-карбоксилат.
Раствор комплекса ТФФ-С получают из 23 мл трифенилфосфита и хлора в 100 мл хлористого метилена согласно методике, описанной в примере 1.
К этому раствору добавляют при температуре от -10 до -15 С 5,28 мл о циклопентена (3,0 экв. на 1 экв. исходного цефемсульфоксида) и затем
11, l5 г 4-нитробензил-7-феноксиацетамидо-3-окси-3-цефем-4-карбокеилат1-оксида. После этого в течение
60 мин по каплям вводят раствор
0,2 мл (3,85 экв. на 1 экв. соединения II ) пиридина в 15 мл хлористого метилена (реальное соотношение реагентов: 0,02 экв. сульфоксида
3-оксицефема, 0,06 экв. циклопентена и 0,077 экв. пиридина). Температура реакционной смеси поддерживао ется в пределах от -10 до -15 С.
Затем к реакционной смеси добавляют
13, 5 мл (3 экв. ) изобутанола и пропускают через нее в течение 3 мин газообразный HCf. Реакционной смеси дают нагреться до комнатной температуры и фильтруют ее через 2 ч. Получают целевое соединение. Выход 80,4Х.
П р и м е-р ы 47-50. Используют ту же методику и те же количества реагентов (в эквивалентах), что и в примере 46, но меняют агент, связы/ вающий галоген.
В табл. 2 сведены результаты опытов по примерам 46-50.
Пример 51. Гидрохлорид 4нитробензил-7-амино-3-хлор-3-цефем4-карбоксилата (ацетонитрил).
А. Получают комплекс ТФФ-Cg согласно общей методике, описанной в примере 1, из хлора и 25,0 мл трифенилфосфита в 100 мл ацетонитрила. К полученному раствору добавляют 3,2 мл (0,03 экв..) амилена и
11,15 г (0,02 экв.) 4-нитробензил-7феноксиацетамидо-3-окси-3-цефем-4карбоксилат-1-оксида, после чего по каплям вводят 6,2 мл .(0,077 экв.) пиридина в ацетонитриле (соотношение реагентов: 1,5 экв. амилена и
3,85 экв. пиридина на 1 экв. сульфоксида З-оксицефема).! 189350 однако в качестве реакционной среды используют 100 мл тетрагидрофурана.
После введения изобутанола и НСУ к реакционной смеси добавляют также
25 мл хлористого метилена.
После окончания введения пиридина добавляют 18,5 мл (5 экв.) изобутанола и через реакционную смесь пропускают газообразный хлор, причем при этом температура реакционной смеси поднимается до 40 С. Для о охлаждения реакционной смеси .до
25 С используют баню со льдом. Целевой продукт кристаллизуют из смеси при 28 С. Выход 46,5Ж.
Б. Проводят эксперимент согласно методике, описанной в разделе А, Выход целевого продукта 35,1X
В табл. 3 приведены результаты
10 опытов по примерам 52-б! (соотношение реагентов: 1,2 экв. амилена и
3,4 экв. третичного амина на зкв. сульфоксида 3-оксицефема).
Таблица !
Время, м мин. фф%
Время> мин
При- ТФФ-C f
М> мер экв
Амилен СН Cf
7) мл/экв мл
ТФФ
11,0/3, 4
Э,5
2 4 5
6,4/37,0
5,1/1,0 150
-5> 1/1,2 150
3, 1/1,2 150
5,1/1,2 150
5,1/1,2 150
5,1/1,2 150
5,1/1,2 150
5, 1/1, 2 150
5,1/1,2 150
36 8
13,6/4,2 t2,42/71,6
12,3/3,8 13,05/76,4
13,6/4,2 12,94/75,7
47,3
3 4 О 42,1
25
47,3
4 4,5
5 3,5
6 4,5
9,43/55,9
99 13,0/4,2
36,8
47,3
53 13,5/4,2
7, 73/.44, 3
122
42,1
12,3/3,8 13,3 1/78,3
13,6/4,2 9,52/55,1
8 4,0
9 3,5 38,8
5, 1/1,2 150
5, 43/31, 7
9,7/3,0
42,1
10 4,0
11 4,0
42,1
12,3/3,8 13,58/79,2
5, 1/1,2 150
76
11>0/3,4
11,65/68,6
10,37/61,2
5,! /1,2
5, 1/1,2
150
12 4,5,, 47,3
63 11,0/3,4
150
36 3
1Э 3,5
12,24/70,8
40.12, 3/3,8
5,1/1,2 150
5, 1/1,2 150
5, 1/1,2 150
5, t/1,2 150
42,1
14 4,0
47,3
15 4,5
1 6 40 421
14,9/4,6 12,36/71,4
40
42,1
12,3/3>8
11;0/3,4
31,6
5,4
40 . 5, 1/1,2 150
9, 15/54, 2
7,69/44,7
5,1/1,2 150
36,8
13,6/4,2
5, 1/1,2 150
36,6
42,1
12,3/3,8 12, 18/72, 1
5, 1/1,2 150
76. 40
У 3 5 368,55
17 4,0 IS 3,0
19 3,5
20 3,5 21 4.,0
Пиридин . Скорректирован" мл/экв, ный выход продукта, г/Х
99 11,0/3,4 12, 13/70, 6
99 ° 13,6/4,2 12,35/78, Э
76 12,3/3,8 12,85/75,5
I 189350
Продолжение табл.! 7
76 .12,3/3,8 13,48(78,8
76 !2,3/3,8 12,93/75,6
150
52,7
5,0
150
42,1
23 40
47,3 55
24 4,5
25 4 5 47 3
25 51(12
11,45/66 3
99 11;О/3,4
150
478 25 51/!2
4,5
27 .35 368
99. 11,0/3,4
160
10 70/61,8
25 0 12, 3/3, В 12â 42/72, 2
150
28 4,6 . 42,1 40
4,0 42,1
О/О
76 12,3/3,8
150
4,0 . 42,! 40
Зо.
О 5,1/1 ° 2 .
4,0 42,!
40 5,1/1,2
42,!
42,1 76 12,3/3,8 8,2 /48,4
1О 5, 1(1,2
150
4,0
4 0
42,1!
42,1 10
4,0
76 12,3/3,8 !3, 19/75,4
200
42,1
1.0
4,0 42,1
76 12,3/3,8 !4,4 /83,1
5, 1/1,2
150.
40 12,8/3,8
6,4/1,5
150
13, 16/75, 7
13 54/81,6
1О, 6,4/1,5
76 12,3/3,8
150
40
4! . 4 ° 2 . 44 5
200
4,2 44,5
200
60, 12,3/3,8
14, 16
200
4,4 46,3
200
60 12 3/3,8 14;35
46,3
46,3
4,2 44,5 10
60 12 3/3 8 !3 77
6,4/1,5
200
Ф
Число Эквивалентов на Экв искодного цефемсулвфокснда.
Ф %1
Время после введения цефемсульфоксида до.начала введения пнриднна.
Время, в течение которого вводят раствор пиридина. в реакцноннув смесв.
4,0 42,1
4,2 44,5
4,2. 44,5
5,1/1,2
5, 1/.1,2
5, 1/1,2
5,1/1,2
5,1/112
5, l/1,2, 6,4/1,5
6,4/1,5
8,5(2,0
6,4/1,5
6,4/1,5 .
6,4/1,5
6,4/1,5
6,4(1,5
150 53 . 13,6/4,2 13,25/77,2
150 53 11,О/3,4 12,66/73,6
150 : 76 12,3/3,8 13, lá/76, 5
150 76 . 9,0/2,3 3,32/18,3
150 76 !2,3/3,3 12,6S/72,3! 50 76 2, 3/3,8 13, 33/78,6 !
50 76 12,3/3,8 13,90/Sf 0
40 !2,3/3,8 11,05/65,0
60 12,3/3,8 14,09/82,8
60 12,3/3,8 14,00/81, 7
1,189350
Таблица 2
Выход, X
Связывакнций агент
Пример
80,4
5,28
Циклопентен
72,8
6,08
Циклогексен
78,2
Циклогептен
1,5-Циклооктадиен
7,1
7,4
7,9
50 м-Диметоксибензол
ТриарилТаблица 3
Пример
Спирт
Растворптель Основание
Реагентн
Пирндин
Изобутанол
1,2-ПропендиOll
Хинолин снс е,снсе, 1,3-Пропандиол
Трнфенип
54 . 2,2,2-Трнхлорэтнл
Триэтил
Водород
2-Tsessnтриметнл
Диэтнланилин
55 4-Нитробензил cHÔсе1
57 Пивалонлохсиметил
СН СТСН СЕ Пиридин
56 Бенэил
Бенвил
1,2-Будандиол
Фенокснметнл
Трифе нил
Хлорбеиэол Ивохинолин Изобутанол
1,2-Пропанол
58 Трет-бутил
Тритолил сн се
ДБУ
СН СЕСН СЕ Пиридин
59 4-Нитробенэнл
1, 3-Бутаднол
Трнфе пил
2,6-Лутидин Изобутанол
CHBr СН СЕ
Фенокси метил
Пиридйн
Трифеннл сн се
Изобутанол
ВНИИПИ Заказ 6763/62 Тираж 383 Подписное
Филиал ППП "Патент", г.Ужгород, ул.Проектная, 4
52 4-Нитробенэил
53, Бенэгидрил
Бенвил
Метил . 4-Хлорфенилтноиетнл
Н -Форнилоксн бензил
К-Бенэгндрилоксикарбонил
Трифеннл
Трнтолнл (4-хлор» фе пил) Трн(4метоксифенил) Три(4метоксифеннл) Количество мл (3,0 экв) CH СЕ, сн сесн се
73,4
60,5
2-Метнлбутанол