Пентациклические замещенные 16,17 -циклогексеноэстра-1,3, 5/10/-триены в качестве промежуточных продуктов в синтезе стероидов и способ их получения
Иллюстрации
Показать всеРеферат
Пентациклические замещенные 16Ы, 17о1-циклогексеноэстра-1,3,5
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК
„„SU„„1194006 А ш4 С 07 J 1/00
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТЗФ
J . c,.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ,, ",.,"; -/
К ABTOPCHOMY СВИДЕТЕЛЬСТВУ (21) 3675632/23-04 (22) 19. 12.83 (46) 30.03.86. Бюл. 9 12 (71) Институт органической химии им. Н.Д. Зелинского (72) А.В. Камерннцкий, И.С. Левина, В.М. Жулин, Б.С. Эльянов, Курт
Понсольд и Хельмут Каш (РР) (53) 547.689.6.07(088.8) (56) Патент СССР У 1055334, 1982.
Авторское свидетельство СССР
Р 273195, кл. С 07 J 5/00, 1970. (54) ПЕНТАЦИКЛИЧЕСКИЕ ЗАМЕЩЕННЫЕ
16а(17о(-ЦИКЛОГЕКСЕНОЭСТРА-1 3 5(10)—
ТРИЕНЫ В КАЧЕСТВЕ ПРОМЕЖУТОЧНЫХ
ПРОДУКТОВ В СИНТЕЗЕ СТЕРОИДОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ. (57) Пентациклические замещенные
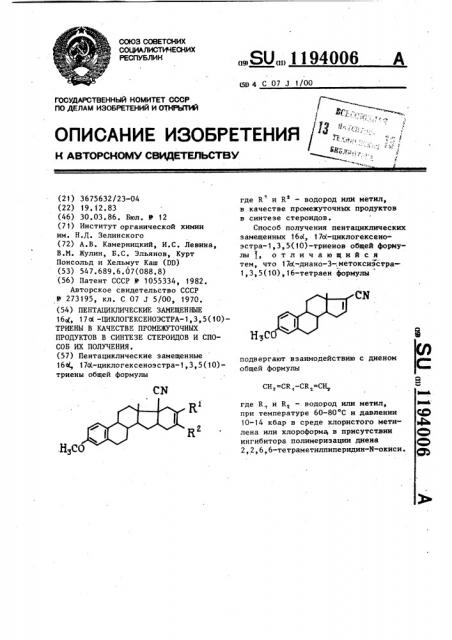
164, 17Ж-циклогексеноэстра-1,3,5(10)— триены общей формулы где К" и К вЂ” водород или метил, в качестве промежуточных продуктов в синтезе стероидов.
Способ получения пентациклических замещенных 16Ы, 17с(-циклогексеноэстра-1,3,5(10)-триенов общей формулы 1, отличающийся тем, что 17о -диано-3-;,метоксиэстра1,3,5(10),16-тетраен формулы
Нз(подвергают взаимодействию с диеном общей формулы
СН -CR -CR -СН где R и R †. водород или метил, при температуре 60-80 С и давлении
10-14 кбар в среде хлористого метилена или хлороформа, в присутствии ингибитора полимеризации диена
2,2,6,6-тетраметилпиперидин-N-окиси. НЗС
1194
НЗСО где R u R — водород или метил, 2 и новому способу их получения.
Цель изобретения — получение промежуточных продуктов в синтезе
;новых биологически активных стерои- . дов с помощью нового способа.
Пример 1. Раствор 0,2 r
17-циано-Э-метоксиэстра-1,3,5(10), 16-тетраена (3), 0,2 мл бутадиена, 0,001 r 2,2,6,6-тетраметилпиперидинЫ-оксила в. 1,5 мл сухого хлористого метилена выдерживают в тонкостенной тефлоновой ампуле при давлении
14 кбар и 80 С в течение 16 ч. Растворитель удаляют и кристаллический 30 остаток хроматографируют на колонке с силикагелем. Элюирование смесью толуол-ацетон (20:1) дало 0,14 г (60X) 16Ы, 17d. — öèêëoråêñ-3 -ено-Эметокси-176-цианоэстра-1,3,5(10)трие- 3 на с т.пл. 186-189 С (метанол-хлористый метилен). Сос) : 78,3 CHCf, С = 0,9. ИК-спектр (4 " cM КВч):
1610, 2230., Спектр ПИР (о, м.д.):
1 14 с (ЭН, 18-СН ), 3,77 с (ЗН, Э-ОСНОВ), 5,99 м (1Н, 3 -4 -H).
Пример 2. Раствор 0,22 г
17-циано»З-метоксиэстра-1,3,5(10), 16-тетраена, 0,25 мл 2,3-диметилбутадиена-1,3, 0,001 r 2,2,6,6-тетра- 4 метилпиперидин-N-оксила в 1,5 мл сухого хлористого метилена выдерживают в тонкостенной тефлоновой ампуле при 14 кбар и 80 С в течение
10 ч. Растворитель удаляют и остаток хроматографируют на силикагеле.
Элюирование смесью гептан-эфир (99: 1) дало О, 16 r (58X) 3,4 -диметил-164, 17с -циклогекс-3 -ено-17р-циано-Ç-метокси-эстра-1,3,5(10)-триена с т. пл. 174-178 С (эфир-гексан);
ВНИИПИ Заказ 1630/5
Филиал ППП "Патент", г. Ужг
1
Изобретение относится к новым промежуточным продуктам в синтезе новых биологически активных стероидов, а именно к пентациклическим замещенным 16а, 176.-циклогексеноэстра1,3,5(10)-триенам общей формулы
006 2
Га5„:60,1 (СНСЕ„С = О,ОЭ). ИК-спектр (см, КВч): 1605, 2235.
Спектр IIMP (8, м.д.): 1,13 с (ЗН, 18-СН ), 1,79 с (6Н, 3,4 -СН ), 3,78 с (ЭН, 3-ОСН ) .
Пример 3. Раствор 0,2 г
17-циано-З-метоксиэстра-1,3,5(10), 16-тетраена, 0,25 мл 2,3-диметилбутадиена, 0,001 r 2,2,6,6-тетраметилпиперидин-N-оксила в 1,5 мл сухого хлористого метилена выдерживают в тонкостенной тефлоновой ампуле при 14 кбар и 60 С в течение
6 ч. После стандартной обработки получено О, 1 г (40X) 3,4"-диметил164, 17о -циклогекс-3-ено-17-цианоЭ-метоксиэстра-1,3 5(10)-триена с т.пл. 174-178 С.
Пример 4. Раствор 0,2 r
17-циано-З-метоксиэстра-1,3,5(10),, (16-тетраена, 0,2 мл 2,3-диметилбутадиена, 0,001 r 2,2,6,6-тетраметил- пиперидин-N-оксила в 1,5 мл сухого хлористого метилена выдерживают в тонкостенной тефлоновой ампуле при
10 кбар и 70 С в течение 6 ч. После стандартной обработки получено
0,05 r (227) 3,,4 -диметил-16К, 174-циклогекс-3 -ено-17Р-циано-3 метоксиэстра-1,3 5(10)-триена с т.пл. 173-177,5 C.
Пример 5. Раствор 0,24 г
17-циано-З-метоксиэстра-1,3,5(10), 16-тетраена, 0,3 мл 2,3-диметилбутадиена, 0,001 r 2,2,6,6-тетраметилпиперидин-Н-оксила в 1,5 мл сукого хлористого метилена выдерживают в тонкостенной тефлоновой ампуле при 12 кбар и 80 С в течение 6 ч.
После стандартной обработки получено
О, 11 r (40X) 3,4 -диметил-1ád, 17о(-циклогекс-3 -ено-17р-циано-3 метоксиэстра-1,3,5(10)-триена с . т. пл. 175-177 С.
Пример 6. Раствор 0,22 г
17-циано-Э-метоксиэстра-1,3,5(10), 16-тетраена, 0,25 мл бутадиена, 0,001 r 2,2,6,6-тетраметилпиперидин-И-оксила в 1,5 мл сухого хлороформа выдерживают в тонкостенной тефлоновой ампуле при 14 кбар и 80 С в течение 15 ч. После стандартной обработки получено О, 125 r (48X)
16a 17М-циклогекс-3 -ено-3-метокси-1 7 g -цианоэ стра-1, 3, 5 (10) -триена с т. пц. 184-188 С.
Тираж 343 Подписное ород, ул. Проектная, 4