Способ получения хиназолиновых производных или их фармацевтически приемлемых солей
Иллюстрации
Показать всеРеферат
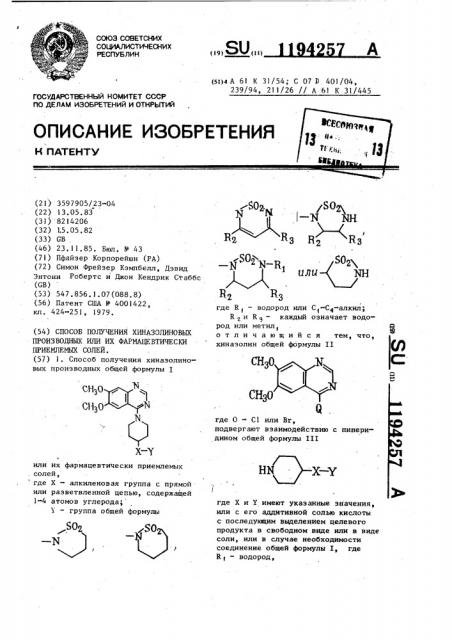
1. Способ получения хиназолиновых производных общей формулы I X-Y или их фармацевтически приемлемых солей, где X - алкиленовая группа с прямой или разветвленной цепью, содержащей 1-4 атомов углерода; Y - группа общей формуль ,S02 -N I I алиЧ NH где R, - водород или С -С -алкил; R 2 и R 3 каждый означает водоi род или метилJ отличающийся тем, что, (Л С хиназолин общей формулы II где О - С1 или Вг, подвергают взаимодействию с пиперидином общей формулы III Н/ У-Х--где X и У имеют указанные значения, или с его аддитивной солью кислоты с последующим выделением целевого продукта в свободном виде или в виде соли, или в случае необходимости соединение общей формулы I, где R , - водород,
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН (19) ()!) сн>о си о
Сн о
Х Y
Х вЂ” У
502
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3597905/23-04 (22) 13.05.83 (31) 8214206 (32) 15.05.82 (33) СВ (46) 23.11.85. Бюл. У 43 (71) Пфайзер Корпорейшн (PA) (72) Симон Фрейзер Кэмпбелл, Дзвид
Энтони Робертс и Джон Кендрик Стаббс (СВ) (53) 547.856.!.07(088.8) (56) Патент США У 4001422, кл. 424-251, 1979. (54) СПОСОБ ПОЛУЧЕНИЯ ХИНАЗОЛИНОВЫХ
ПРОИЗВОДНЫХ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ
ПРИЕМЛЕМЫХ СОЛЕЙ. (57) 1. Способ получения хиназолиновых производных общей формулы или их фармацевтически приемлемых солей, где X — алкиленовая группа с прямой или разветвленной цепью, содержащей
1-4 атомов углерода, 1 — группа общей формулы (5()4 А 61 К 31/54; С 07 Э. 401/04, 239/94, 211/26 // А 61 К 31/445
r $0)
1 или
82 Rs где R — водород или С(-С -алкил;
R z u R 9 каждый означает водо» род или метил, отличающийся тем, что, хиназолин общей формулы II где Π— С1 или Br подвергают взаимодействию с пиперидином общей формулы III где Х и У имеют указанные значения, или с его аддитивной солью кислоты с последующим выделением целевого продукта в свободном виде или в виде соли, или в случае необходимости соединение общей формулы I где
R (— водород, 1194257
Ън з,Мз, С1 130 си,о
X — Y so>! — Я NH з Г1 Ез
_#_ S0y алкилируют алкилгалогенидом общей формулы IV где R 1 — С,-С4-алкип, для получения соединения общей формулы I, где R з — С,— С+-алкил, или восстанавливают соединение общей формулы I, rpe Y — группа формулы
Изобретение относится к способу получения новых хиназолиновых производных общей формулы или его фармацевтически приемлемой соли, где Х вЂ” алкиленовая группа с прямой или разветвленной цепью, содержащей
1-4 атомов углерода, Y — группа формулы 2 м — R
1 или 2 3 где R — водород или С1-С4,-алкил;
R и R - каждый означает водород или метил, обладающий кардиостимулирующей активностью, и может быть использовано в медицине.
Цель, изобретения - разработка способа получения новых хиназолидействием боргидрида натрия для образования соединения общей формулы I.
2. Способ по п. 1, о т л ич а ю шийся тем, что реакцию соединений общих формул (II) и (III) проводят в присутствии триэтиламина. новых производных, обладающих ценными фармакологическими свойствами.
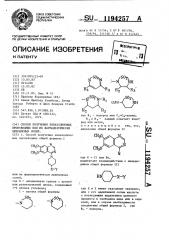
Пример 1, 0,71 г 4-хлор-6,7-диметоксихиназолина, 1,00 г 25 -(2- (4-пиперидил)-проп-1-ил)-изотиазолидин-1,1-диоксидигидрохлорида
1,полугидрата) и 2,2 мл триэтиламина смешивают и выдерживают при температуре кипения с обратным холодиль10 ником в течение 2,5 ч в 10 мп этанола.
Далее смесь осаждают и летучий материал удаляют в вакууме. Остаток растворяют в 25 мл воды и подверга-.
15 ют экстракционной обработке. тремя порциями по 25 мл хлороформа. Высушенные над сульфатом магния экстракты выпаривают в вакууме, а остаток подвергают хроматографической
20 обработке на двуокиси кремния (сорта "Иерк 60.9385"7, элюируя смесью метанола с этилацетатом в соотношении 1:9, в результате чего получают маслоподобный остаток. Последний
25 растворяют в небольшом количестве теплого этилацетата и в раствор добавляют циклогексан до появления слабо заметного помутнения. В результате охлаждения в холодильнике получают 6,7-диметокси-4 14-(I (1,1-диоксоиз отиазолидин-2-ил) -прои-2-ил1-пиперидин -хиназолина с т.пл. 129-131 С.
Найдено, 7: С 58,1; Н 6,9;
N 12,8
35 С21 НЪ01 1404 Б
Вычислено, Ж: С 58,0; Н 7,0;
N 12,9.
Пример ы 2-22. Аналогично примеру 1 получены соединения с ис и
40 пользованием 4-хлор-6,7-диметоксихиI ) 94257 сн, СЮ назолина, триэтиламина и соотнетствующего пиперидина (либо в форме свободного оснонания, либо н форме гид рохлоридной или ацетатной соли в зависимости от той формы, н которой 5 эти пиперидины были получены; и слу- чаях, где использована соль пиперидина, необходимо применять избыток .триэтиламина).
Результаты получения предлагаемых соединений по примерам 2-22 представлены в табл. 1, Эти соединения получены реакцией
4-хлор-6,7-диметоксихиназолина, триэтиламина и смеси (н пересчете на гидрохлориды) 2-(2-(4-.пиперидил)-этил) -4-метил-l 2,5-тиазолидин-),1-диоксида с 2-(2-(4-пиперидил)-этил)-З-метил-1,2,5-тиазолидин-l,l-диоксида в соотношении 3:1 и хроматографической обработкой на двуокиси кремния с целью разложения смеси продуктов на соединения по примерам 18 и
19. 25
Пример 23. Перемешиваемый раствор 0,7 г l-(6,7-диметоксихиназолин-4-ил) -4- j(),)-диоксотетрагидро -1,2,6-тиадиазин-2-ил) -метил1-пиперидин-1 2СН СН ОСОСН полученного 30 аналогично примеру 9, н 4,0 мл диметилформамида при комнатной температу ре обрабатывают 100 мг гидрида натрия (50Е-ная дисперсия н масле1 и смесь .подвергают перемешиванию н течение
45 мин. Затем в смесь добавляют
255 мг изопропилиодида и конечную смесь перемешивают в течение 6 ч.
Растворитель удаляют в вакууме и остаток растворяют в 50 мл хлороформа 4р и 25 мл воды, Водную фазу подвергают экстракционной обработке двумя порциями по 20 мп хлороформа и высушенные над сульфатом магния экстракты выпаривают с получением маслоподоб- - 45 ного продукта, который подвергают хрохроматографической обработке на дву " окиси кремния (сорта "Мерк 60.9385") элюируя хлороформом, в результате чего получают смолоподобную массу. После кристаллизации из этилацетата получают 460 мг 1-(6,7-диметоксихиназолин-4-ил)-4-t(),)-диоксо-б-изопропилтетрагидро-),2,6-тиадиазин-2-ил)-метил)-пиперидина с т.пл. 158-161 С.
Найдено, Е: С 56,7; Н 7,2;
И 15,3.
С Р Р 0w вычислено, 7: С 57,0; Н 7,2;
N 15,1 °
Пример 24. Аналогично примеру 23 с использованием в качестве исходных материалов натриевой соли
1-(6,7-диметоксихиназолин-4-ил )
-4- ((),l-диоксотетрагидро-1,2,6-тиадиазин-2-ил)-метил1-пиперидин«l 2CH CH OCOCH и иодистого метила получают соединение формулы
Найдено, 7: С 55,1; Н 6,7;
N 16,0
С Н И 048
20 29 5
Вычислено, 7: С 55,1; Н 6,7;
N 16,).
Пример 25. 0,025 r боргидрида натрия при комнатной температуре добавляют в перемешинаемый раствор
0,30 r 1-(6,7-диметоксихиназолин-4-ил)-4- ))-(l,l-диокса-5-метил-1,2,6-тиадиазин-2-ил -проп-2-ил -пиперидина в 5 мл абсолютиронанного этанола.
После перемешивания в течение 16 ч смесь подкисляют до рН 1 добавлением
2М раствора соляной кислоты и концентрируют в вакууме. Остаток обрабатывают водным раствором карбоната натрия с доведением рН смеси до 12, подвергают экстракционной обработке тремя порциями по 10 мл хлороформа и объединенные экстракты высушивают над сульфатом магния, выпаривают с получением маслоподобного остатка и подвергают хроматографической обработке на двуокиси кремния (сорта
"Мерк 60.9835:); элюируя смесью метанола с этипацетатом в соотношении
1:20, благодаря чему получают твердый продукт. Путем перекристаллизации из смеси этипацетата с диэтиловым эфиром в виде белых йикрокристаллов получают 0,15 r 1-(6,7-диметоксихиназолин-4-ил)-4- ()-(l,l-диоксо-5-меткптетрагидро-!,2,6-тиадиазин-2-ил)-прон-2-ил)-пиперидина с т.пл.
172-)75 С.
1194357 сн
СН30 сЖ сно
S0 си,сн, Найдено, %.: С 56,8; Н 6,7;
N 13,2.
Вычислено, Х: С 57,1; H 6,7;
N 13,3.
Пример 29. Получение некоторых кислых аддуктов 4-(4-12-(1,1-.
-диокс17-2-изотназолидинил)-этил3-пиперидин)-6,7-диметоксихиназолина (продукт примера 4).
Гидрохлоридная соль. 20,2 мл концентрированной соляной кислоты добавляют в течение 5 мнн в суспензию
100 r 4-(4-(2-(1,1-диоксо-2-изотиазолидинил)-этил)-пиперидин)-6,7-диметоксихиназолина в 1 л технического этилового спирта, денатурированного метиловым спиртом. Смесь нагревают до 45 С, а затем охлаждают с последующим ее перемешиванием при 0 С в теS
Найдено, %: С 57,2; Н 7,3;
N 14,6.
Вычислено, %: С 57,0; Н 7,2;
N 15,1.
Аналогично примеру 25 получают соединения формулы
Результаты получения предлагаемых соединений по примерам 26 и 27 представлены в табл. 2.
Пример 28. Аналогично примеру 1 с использованием в качестве исходных материалов 4-хлор-6,7-диметоксихиназолина, 5-(2-(4-пиперидил)—
-этилизотиазолидин-1,1-диоксида) и триэтиламина получают соединение с о т. пл, 204-206 С формулы чение 1 ч, Гидрохлоридную соль фильтруют и высушивают в вакууме с полуо чением 105,5 r соли с т.пл. 227-229 С.
Найдено, %: С 53 75; Н 645;
N 12,15.
С Н, 4 1,0,8- НС1
Вычислено, %: С 52,56; Н 6,4;
N 12,26.
Тозилатная соль. Раствор 4,5 г п10
-толуолсульфокислоты в 20 мл ацетона добавляют суспеизию 10 г 4-14-(2-(1,1-диоксо-2-изотиазолидинил)-этил)
-пиперидин -6,7-диметоксихиназолина в 82 мл при комнатной температуре.
Вначале достигают полного растворения после чего продукт кристаллизуУ о ют и перемешивают смесь при 0 С в течение 1 ч. Тозилатную соль фильтруют, промывают ацетоном и перекристаллизовывают из смеси ацетона с техническим этиловым спиртом, денатурированным метиловым спиртом, в результате чего получают 9,7 г соли с т.пл. !56-157 С.
Тартратная соль. Смесь 1Ñ г 4— (4- (2-(l,!-диоксо-2-изотиазолидииил
-атил)-пиперидии1-6,7-дииетоксихиназолина, 3, 6 r (+) -винной кисло тъ1, 70 мл технического этилового спир« та, денатурированного метиловым спиртом, и 10 мл воды выдерживают при температуре кипения с обратным холодильником до образования прозрачного раствора. Затем приготова
35 ленную смесь охлаждают до 0 С и подвергают гранулированию в течение 1 ч.
Тартратную соль отфильтровывают и промывают техническим этиловым спиртом, денатурированным метиловым спир40 том. Путем перекристаллизации из водного раствора технического этилового спирта, денатурированного метиловым спиртом, получают 11,1 г тартратной соли с т.пл. 116-118 С. о
45 Испытания проводят на собаках в анастезированном состоянии с целью оценки кардиостимулирующей активности предлагаемых соединений. Давление в левом желудочке (ДЛЖ) у под50 вергнутых анестезии внутривенным введением 30 мг/кг нембутала самцов и самок гончих собак измеряют посредством датчика Миллера, введенного в левый желудочек через левую ар55 терию каротидного синуса. Для фиксирования давления в левом желудочке в виде графика используют 4-канальные устройства, а для получения мак11942
Таблица1
ыделенна форма
/SO2
-сн;м
0,25 Н 0 138 55,5 6,5 13,6 (55,5) (6,5) (13,6) 502
-сн;м
Свободное 155 57,4 7,0 12,7 (57,1) (6,7) (13,3) Свободное 192- 56,8. 6,8 13,0 (57,1) (6,7) (13,3) Свободное 159 57,8 7,0 12,6 (58,0) (7,0) (12,9) С э
-сн-сн,—
Свободное 156 основание
Свободное 185- 57, 1 6,7 13, 1 (57, 1) (6,7) (13,3) симальной степени изменения давления в левом желудочке от исходного ДЛЖ при .введении испытываемого соединения используют дифференцнатор. Испытываемое соединение, растворенное в инерт- 5 ном растворителе, вводят инъекцией в бедренную вену. Максимальная степень изменения давления в левом желудочке (dp/dt ц„ ) является мерой максимального процентного увеличения 10 силы сокращения сердечной мышцы (силы сокращаемости сердца), достигаемой введением испытываемого соединения.
Поскольку для каждой собаки возможно изменение степени ее реакции на 15
57 8 кардиостимулятор, каждый полученный результат следует сопоставлять с результатом, полученным для той же самой .собаки в случае использования известного кардиостимулятора, т.е °
4-(4-(3-н-бутилуреидо)-пиперидино)-6,7-диметоксихиназолица — букинерана. Известный кардиостимулятор в приемлемом растворителе также вводят в бедренную вену по меньшей мере
В за 30 мин до введения испытываемого соединения.
Результаты испытаний представлены в табл. 3.
58,6 7,2 12,5 (58,9) (7,2) (12,5) 1194257
Продолжение табл.1
Свободное основание
Сольват с 131- 54,5 6,6 15,0 (54,2) (6,7) (15,0) Ионогидрат 179 54,6 6,5 16,6 (54,1) (6 5) ()6,6) 10
Свободное 130 54,9 б,б 16,3 (55, 1) (6, 7) (16, 1) Ионогидрат 135 54, 7 7,0 14, 3 (54,9) (7,3) (14,5) 13
Свободное 186- 54,3 Ь,б 16,8 (54,1) (6,5) (16,6) Свободное 197- 55,1 6,8 15,8 (55,1) (6,7) (16,1) 15
Свободное, 180 55,4 Ь,б 15,9 (55,2) (6,7) (16,1) БОг
V — СН;Я «Н
502
-СН СН;„N 1ЧЕ
СН3 р
-СН-Ж NH
14 4 30
1 — СН вЂ” N NH
© 3
-СНСИ-Ь W
53,2 6,2 (53,1) (6,2) 17,1 (17,2) 12
1194257
Продолжение табл.1
S 02 — си(с н )-м мн
19
$02
21
16 ЖЗ ЯО
-CHCH - - ЪН
2 ( о
-сн;си; н сн, -сн,сн;я ин
С З
-СН вЂ” NH
СН
$02
-сн„сн-и щ сн, СН3
-снсн;н "ин сн, Свободное 162- 55,9 6,9 15,9 (56,1) (6,9) { 15,6) Свободное 210 55,8 6,7 15,7 (56,1) (6,9) (15,6) Свободное 183- 55,0 6,8 -16,1 (55, 1) (б, 7) (16, 1) Свободное 169- 54,9 6,8 16,0 (55,1) (6,7) (1б,i) Свободное 220- 54,9 6,8 16,1 (55,1) (6,7) (16,1) Свободное 182- 55у9 бу8 15р5 (56,1) (6,9) (15,6)
Свободное 90-93 56,0 7,0 15,1 (56,1) (7,0) (15,6) 13
1194257
Таблица 2
При мер
Эл емент ный ан али з (вычисленные данные)
Выделенна форма
50z
-снсн,сн-и- - ян сн, 5)е9 6ь8 13,1
Моногидро- 128хлорид мо- -131 ногидрат (51.,9) (7,2) (13,2) С1 3
-сн,сн-ж- н сн, 27
Таблица 3 мальное увеличение силы сокращения .сердечной мьппцы, ызванное введением соединения
Соед приме стного при дозировке
0,25 мг/кг агаемого при соответющей дозировке, мг/кг
27
29
43
35
10
42
43 при 0,25
21
20
46 при 0 25
ill при 0,25
56 при 0,25
70 при 0,25
46 при 0 05
85 при 0,25
108 при 0,25
25 при 0,25
48 при 0,25
65 при 0,25
76 при 0,25
120 при 0,25
Полугидрат 206- 55,9 7,2 14,5 (55,9) (7,2) (14,8) 15
16 1194257
Продолжение табл.3
70 при 0,25
125 при 0,25
96 при 0,25
29 при 0 05
18 при 0,05
15
16
17
18
19
32 при 0,05
38
94 при 0,25
46 при 0,05
46 при 0,05
21
25
37 при 0 05
67 при 0 25
23
58
76 при 0 05
33 при 0,05
19 при 0 ° 05
25 при 0,05
28
23
25
Составитель M. Борин
Редактор О. Юрковецкая Техред О. Ващишина Корректор М. Демчик
Тираж 721 Подписное .
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д, 4/5
Заказ 7328/62
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4