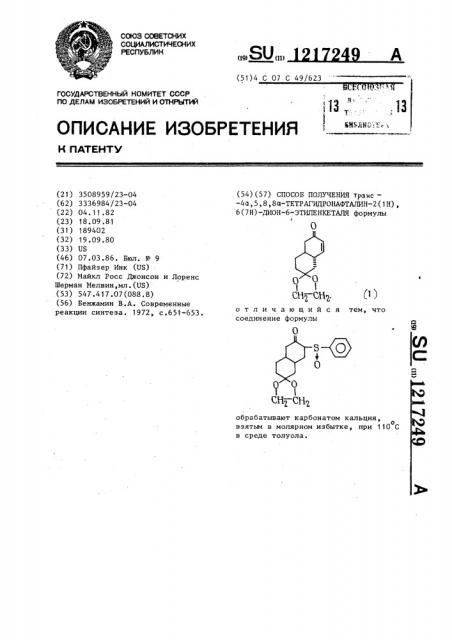
Способ получения транс-4а-5,8,8а-татрагидронафталин-2 ( @ ), 6 (7 @ )-дион-6-этиленкеталя
Иллюстрации
Показать всеРеферат
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК (19) (11) (51)4 С 07 С 49/623
l l3,,.13 Яьд11(ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
0 сн-,сн . C> ) 0
s--Qp
1 сн сн
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЬ1ТИЙ (21) 3508959/23-04 (62) 3336984/23-04 (22) 04. 11 ° 82 (23) 18.09.81 (31) 189402 (32) 19.09.80 (33) US (46) 07.03.86. Бюл. Р 9 (71) Пфайэер Инк (VS) (72) Майкл Росс Джонсон и Лоренс
Шерман Мелвин,мл.(US) (53) 547.417.07(088.8) (56) Бенжамин В.А. Современные реакции синтеза. 1972, с.651-653. (54) (57) СПОСОБ ПОЛУЧЕНИЯ транс—
-4а,5,8,8а-ТЕТРАГИДРОНАФТАЛИН-2(1Н), 6(7Н)-ДИОН-6-ЭТИЛЕНКЕТАЛЯ формулы
0 отличающийся тем, что соединение формулы обрабатывают карбонатом кальция, о взятым в молярном избытке, при 110 С в среде толуола.
1217249 2
Изобретение относится к способу получения нового тра с -4а, 5, 8, 8ч-тетрагидронафталин-2-(1Н)-6 (?Н)—
-дион-6-этиленкеталя формулы являющегося промежуточным продуктом в синтезе новых 4-(2-окси)-«-(замещенных) фенил (нафталин) — 2(1Н)-онов или -2-слов, которые в свою очередь являются биологически активными соединениями, действующими на центральную нервную систему.
Цель изобретения — изыскание способа получения новых промежуточных соединений, для создания производных, обладающих более выраженной анальгетической активностью.
Пример. транс -4а,5,8,8а-Тетрагидронафталин-2(IÍ),б(7Н)—
-дион-б-этиленкеталь, А. З-а-Фенилтиодекагидро-2,6-нафталиндион-б-моноэтиленкеталь. о
В охлажденный до -78 С раствор
3,08 мл (22 ммоль) диизопропиламина в 22 мл тетрагидрофурана добавляют
8,4 мл (21 ммоль) 2,5М раствора
Н-бутиллития в гексане. Образовавшийся раствор в течение 30 мин перео мешивают при -78 С. Затем постепенно добавляют раствор 2,10 r (10 ммоль) декагидро-2,б-нафталиндионмоноэтиленкеталя в 5 мл тетрагидрофурана. Конечный раствор перемешивают в течение 30 мин при
-78 С, после чего перемешивание о, продолжают в течение 30 мин при комнатной температуре. Далее реако ционный раствор охлаждают до О С и быстро добавляют в него раствор 4,79 г (22 ммоль) дифенилдисульфида. После этого реакционный раствор подогревают до комнатной температуры, перемешивают в течение 1 ч с последующим быстрым выпиванием в смесь 250 мл диэтилового эфира с
250 мл насыщенного раствора хлорис.— того натрия, Органический экстракт сушат над сульфатом магния и выпаривают с получением маслоподоб5 tG
7/i
50 ного остатка. Этот сырой маслоподобный продукт очищают хроматографической обработкой в колонке с гексаном, в результате чего получают
947 мг (после перекристаллизации из диизопропилового эфира) (303-ный выход) 3 †-изомера целевого соеди— нения. Температура плавления 127о
130 С (в диизопропиловом эфире).
Данные 3-с -изомера целевого соединения.
ITNP-спектрограмма (CDC1 ),о
0,95-2,4 (m), 2,95 (m, осевой метин
1,3 к осевому атому серы), 3,70 (m, метин-ot, к атому серы), 4,00 (S этиленкеталь) и 7,30 (m, фенил-Н).
Хасс-спектрограмма (m/е): 3 18(Х ) с
20о 181 125; 109; 99 и 86.
ИК-спектрограмма (хлороформ):
1 706, 1 600 и 1 582 см
В, 3- 0 -Фенилсульфенилдекагидро-2,6-нафталиндион-б-моноэтиленкеталь. о
В охлажденный до О С раствор
912 мг (2,87 ммоль) 3-Ф;фенилтиодекагидро-2,6-нафталиндион-б-моноэтиленкеталя в 50 мл дихлорметана постепенно добавляют раствор 494 мг (2,87 ммоль) и -хлорпероксибензойной кислоты в 20 мл дихлорметана. Образовавшуюся смесь перемешивают в течение 2 ч при температуре от О до
20 С, после чего ее выливают в смесь 250 мл диэтилового эфира с
250 мл 10Х.-ного раствора сульфата натрия. Органический экстракт дважды промывают 250-миллилитровыми порциями насьпценного бикарбоната натрия, сушат над сульфатом магния и выпаривают до образования маслоподобного остатка.
Сырой маслоподобный остаток очищают кроматографической обработкой в колонке с 50 г силикагеля, элюируя диэтиловым эфиром, в результате чего в виде маслоподобной смеси диастереомеров получают 850 мг (877-ный выход) целевого соединения 1 данной стадии примера.
ПХР-спектрограмма (CDC1 )., g:
0,9-2,8 (ш); 3,46 (m, оа-метин к атому серы), 3,92 и 4,00 (S, этиленкеталь) и 7,55 (ш, фенил-Н} .
В охлажденную до 0 С суспензию 21,9 г (0,547 моль) гидрида .калия в 200 мл диметоксиэтана добавляют 43,2 r (0,277 моль) метилфенилсульфината. Затем в образовавшуюся
12172
3,19
1,46
13,4
40Н
1,24
4Н
0Н
2,3
0,55
40H
%ОН
4Н
3,22
6,9
L0H — — ОН
-Н(l
0,054
0,22
40Н
4СН ОН
СН,ОН
2,81
6,8
4ОН
1,44
5,6
<ОН смесь по каплям в течение 30-минутного периода добавляют раствор
49,6 r (0,236 моль) декагидро-2,6-нафталинмоноэтиленкеталя в 150 мл диметоксиэтана. Далее реакционную 5 смесь перемешивают в течение 1 ч при
О С, после чего реакцию прекращают о постепенным добавлением 9 мл (0,5 моль) воды. После этого реакционную смесь выливают в смесь 150 мл 10 диэтилового эфира со 150 мл дихлорметана, 125 мл 6 н. соляной кислоты и 375 мл насыщенного раствора хлористого натрия. Водную фазу подвергают экстракционной обработке l5 дополнительной 150-миллилитровой порцией дихлорметана. Объединенный органический экстракт сушат над сульфатом магния и выпаривают с получением полутвердого остатка. Пос- 20 ледний можно очистить хроматографической обработкой в колонке аналогично изложенному.
Однако полутвердый остаток объединенного органического экстракта 25 можно также использовать при осуществ-. .лении последующей стадии С. транс-4ч,5,8,8с»-Тетрагидронафталин-2(1H), 6(7Н)-дион-б-этиленкеталь.
Сырой продукт, полученный по 30 варианту раздела В, смешивают с
26,8 г (0,268 моль) карбоната кальция в 1 л толуола в течение 30 мин при 110 С. Затем реакционную смесь охлаждают > фильтруют через сульфат магния и фильтрат выпаривают в роторном испарителе с получением маслоподобного остатка, который очищают хроматографической обработкой в
49 4 колонке с 500 г силикагеля, элюируя смесью 39Е-ного диэтилового эфира с гексанам, в результате чего получают 40 г (817 †н выход) целевого соединения данной стадии примера, о
Температура плавления 58-59 С (в диизопропиловом эфире).
ИК-спектрограмма (хлороформ):
1 681, 1 658 (плечо) и 1 613 см
ПМР-спектрограмма (100 МгГц, ЭСЕэ) о : :1,32-2,62 (m), 4,0 (S, этиленкеталь), 5,97 (dd, Е = 10 и 3 Hz, олефин) и 6,71 (dd,I = 10 и 2Hz, олефин), HR-масс-спектрограмма (»и/е):
208, 1099 (М+), 180, 179; 172; 170;
153 и 99 (1007) .
Данные элементного анализа
С„Н„О,.
Вычислено,7: С 69,21, Н 7,74.
Найдено,X С 69,11, Н 7,49.
Анальгетические свойства активных соединений, полученных иэ предлагаемого соединения, определяют путем проведения испытаний с использованием болевых раздражителей.
Для сравнения используют известный анальгетик-морфин МРЕ5 которого для PBQ = 0,9 мг/кг, для
RTC = 17,8 мг/кг.
Данные анальгетического действия предлагаемого соединения при введении его в организм подкожно приведены в таблице.
Как видно из таблицы, предлагаемое соединение позволяет получить производные нафталинолов, проявляющие более выраженную анальгетическую активность, чем морфин. !
1217249
Продолжение таблицы сн он
4сн он
0,018
40Н
0,06
40Н
1,58
П р и м е ч а н и е: (а) Чистый знантиомер А, (Ь) Чистый энантиомер В; (с) Анальгетическое действие при введении в организм через рот: РВЯ-0,25 мг/кг; ЙТС-0,7 мг/кг;
PBg — болевые корчи, вызванные фенилбензохиноном РТС вЂ” зажим хвоста крысы.
Составитель Г. Мирошниченко
Редактор И. Дербак Техред З.Палий Корректор M. Самборская
Заказ 1007/62 Тираж 379 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5 (a)
---Н
„(Ъ) Филиал ППП "Патент", г. Ужгород, ул . Проектная, 4