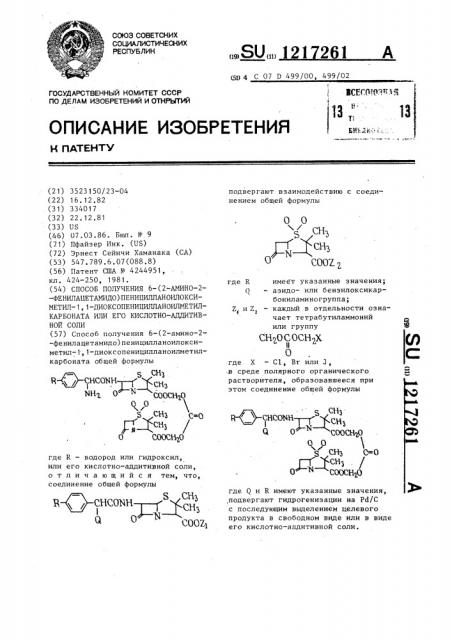
Способ получения 6-(2-амино-2-фенилацетамидо) пеницилланоилоксиметил-1,1- диоксопеницилланоилметилкарбоната или его кислотно- аддитивной соли
Иллюстрации
Показать всеРеферат
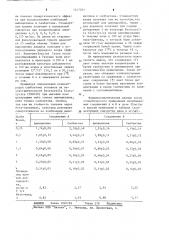
Способ получения 6-(2-амино-2- -фенилацетамидо)пеницилланоилоксиметил-Т,1-диоксопеницилланоилметилкарбоната общей формулы СНг Я-4/-СНСО 1Н-р Y -tiHl 0 СНз о / соосн о С-0 где R - водород или гидроксил, или его кислотно-аддитивной соли, отличающийся тем, что, соединение общей формулы i о S./CH3 , COOZi подвергают взаимодействию с соединением общей формулы О о / S о л СН-г V М рсня .-N-k COOZ где R (} Z, и Z, указанные значения; азидоили бензилоксикарбониламиногруппа; каждый в отдельности означает тетрабутиламмоний или группу СН20СОСН2Х О . где X - С1, Вг или О, S среде полярного органического, растворителя, образовавшееся при этом соединение общей формулы с (б (/) CHCOl H S Нз соосн о ххО ггЧ оД-с, СНз СНз / COOCHiO где Q и R имеют указанные значения, .подвергают гидрогенизации на Pd/C с последующим вьщелением целевого продукта в свободном виде или в виде его кислотно-аддитивной соли.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
„„SU 121 261 аи 4 С 07 В 499/00, 499/02
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К IlATEHTY
О 0
СН
3 Г сн
0 СООХ z
О,О сн /
О СООСН,О
СНСОЪН СН
СООСН,О сн, c=o
О СООСН,0
ГОСУДАРСТВЕННЬ Й КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3523 150/23-04 (22) 16. 12.82 (31) 334017 (32) 22. 12. 81 (33) US (46) 07. 03. 86. Бюл. № 9 (7.1) Пфайзер Инк. (US) (72) Эрнест Сейичи Хаманака (СА) (53) 547.789.6.07(088.8) (56) Патент США № 4244951, кл. 424-250, 198 1. (54) СПОСОБ ПОЛУЧЕНИЯ 6-(2-АМИНО-2— ФЕНИЛАЦЕТАМИДО)ПЕНИЦИЛЛАНОИЛОКСИМЕТИЛ-1, 1-ДИОКСОПЕНИЦИЛЛАНОИЛМЕТИЛКАРБОНАТА ИЛИ ЕГО КИСЛОТНО-АДДИТИВНОЙ СОЛИ (57) Способ получения 6-(2-амино-2-фенилацетамидо)пеницилланоилоксиметил-1,1-диоксопеницилланоилметилкарбоната общей формулы
S CH3
R Г СНСа НГ СН
СООСН,О где К вЂ” водород или гидроксил, или его кислотно-аддитивной соли, отличающийся тем, что, соединение общей формулы
S CH
В x i CHCONH
1 3
Q О подвергают взаимодействию с соединением общей формулы где R имеет указанные значения; (1 — азидо- или бензилоксикарбониламиногруппа;
Z u Z — каждый в отдельности озна(2 чает тетрабутиламмоний или группу
СН О С ОСН Х
ll
О где X — С1, Вг или 3, .в среде полярного органического растворителя, образовавшееся при этом соединение общей формулы где Q u R имеют указанные значения, подвергают гидрогенизации на РЙ/С с последующим выделением целевого продукта в свободном виде или в виде его кислотно-аддитивной соли.
121
Изобретение относится к способу получения новых сложных бис-эфиров пенициллановой кислоты общей формулы
HCONH ° CHü о соосн,о где К вЂ” водород или Гидроксил, или их кислотно-аддитивных солей, обладающих антибактериальными свой-, ствами.
Цель изобретения — создание на основе известных методов способа получения новых соединений, обладающих ценными фармакологическими свойствами.
Пример 1. бис-Йодметилкар% бонат. а. В раствор 10 7 мп (15 9 г, 0,1 моль) бис(хлорметил)карбоната в 400 мл ацетона вводят 75 г (О 5 моль) йодистого натрия. Смесь нагревают с обратным холодильником в течение 2 ч в атмосфере азота, saтем ее оставляют на ночь при комнатной температуре. Смесь фильтруют, фильтрат выпаривают в вакууме. К полученному продукту выпаривания добавляют хлористый метилен (500мл) и образующуюся смесь фильтруют. Фильтрат выпаривают до получения объема примерно 200 мл, добавляют 200 мп воды, и величину рН водной фазы доводят до 7,5. Добавляют водный раствор тиосульфата натрия, удаляя йод, органическую фазу отделяют и высушивают над сульфатом натрия. Высушен" ный раствор хлористого метилена выпаривают в вакууме до получения мас. ла, которое при выстаивании темнеет.
Этот маслянистый продукт подвергают обработке смесью, состоящей из 35мп гексана и 6 мл диэтилового эфира, при О С, образующиеся кристаллы отфильтровывают, промывают гексаном и высушивают, в результате получают
10,0 r (29X) желтоватого кристаллического продукта с температурой плавления 49-51 С. Спектр Н-ЯИР (CDC1 ), ч./мпн. (о): 5,94 синглет; инфракрасный спектр (Nu)OL), см : 1756, 1775.
7261
2 в. Йодометил-б fD-(2-азидо-2-фенил-. ацетамидо)) -пеницилланоииоксиметилкарбонат. о
В охлажденный до 0 С раствор
2,43 г (7,1 ммоль) бис-йодометилкарбоната в хлороформе (16 мл) вводят по каплям раствор 2, 19 r (3,5 ммоль) тетрабутиламмоний-6-tD-(2-азидо-2-фенилацетамидо) пеницилланата в
1Î 10 мл хлороформа. После прекращения этого добавления реакционную смесь нагревают до комнатной температуры и выдерживают при ней в течение ночи. Растворитель выпаривают в вакууме, остаточный продукт выпаривания подвергается хроматографическому разделению на силикапеле, при элюировании смесью хлористого метилена с этилацетатом в объемном отношении
2О 3:1, в результате чего получается
322 мг (40X) продукта. Спектр
Н-ЯИР (CDClç), ч,/млн, (9): 1,52 (S, 3Н); 1,65 (S, ЗН); 4,45 (S, 1Н);
5,04 (S, 1H); 5,65 (m, 4Н); 5,92
25 (Б, 2H); (S, 5H); инфракрасный спектр (СНС1,): 1770 см
С. б- Э-(2-Азидо-2-фенилацетамидо)— пеницилланоилоксиметил-1,1-диоксопеницилланоилоксиметилкарбонат.
Б раствор 622 мг (1 4 ммоль) йодметил-6-(В-(2-азидо-2-фенилацетамидо) пеницилланоилоксиметилкарбоната в 30 мп хлороформа вводят по каплям при комнатной температуре раствор
1,33 r (2,8 ммоль) тетрабутиламмоний-1,1-диоксопеницилланата в 30 мл хлороформа. Реакционную смесь пере- мешивают при комнатной температуре в течение ночи, выпаривают в вакууме и подвергают хроматографическому
4О разделению на силикагеле. Элюирование осуществляют смесью хлористого метилена с этилацетатом в объемном отношении 9.: 1, и в результате получается 0,51 г продукта (выход
52,61). Спектр Н-ЯМР (CDC1,), ч./млн (3): 1,4 (S, 3H); 1,5 ($, 3H); 1,6 (S, 3H); 1,64 (S, ЗН); 3,42 (d, .7 =
3 Гц, 2Н); 4,4 (S, 1Н); 4,44 (S; iH);
4 6 (t,,J = 3 Гц, 1Н); 5,04 (S, 1Н); 5,44-6,0 (р, 6Н); 7,35 (S, 5H); инфракрасный спектр (СНС1,): 1775 см . Я. 6-jD(2-Амино-2-фенилацетамидо)) -пеницилланоилоксиметил-1, 1-диаксопеницилланоилоксиметилкарбонат.
Раствор 1,49 г 6-(О-(2-азидо-2-фенилацетамидо)) -пеницилланоилоксиметил-1,1-диоксопеницилланоилокси*метилкарбоната в 40 мп хлористого ме3 12 тилена и 20 мл изопропанола подвергают гидрированию при давлении
60 psi (4,2 кг/см ) в присутствии
1,5 г 10Х-ного Pd/Ñ .в течение
30 мин. После этого добавляют порцию катализатора 1,5 г и гидрирование продолжают еще в течение 30 мин. 3атем катализатор отфильтровывают и фильтрат выпаривают, получая белый твердый остаточный продукт выпаривания. Этот продукт растворяют в смеси тетрагидрофуран/вода (в соотношении
1: 1), полученный раствор охлаждают до О С, величину рН этого раствора о доводят до 2,5 путем добавления
О, 1 н.соляной кислоты. Тетрагидрофуран выпаривают в вакууме, образующийся водный раствор высушивают при темо пературе ниже О С, в результате чего получается 680 мг (453) продукта в виде белого твердого вещества. Спектр
" Н-ЯМР (CDC1 + CD OD), ч./млн. (Ю):
1,42 (S, 6Н); 1,5 (S, ЗН); 1,6 (S, ЗН); 3,46 (m, 2Н); 4,4 (S, 1H); 4,43 (S, 1Н); 4,72 (m, 1Н); 5у2 (S, 1Н);
5,48 (g Õ = 4 Гцэ 2Н) 5э82 (S+gý
J = 6 Гц, 4H); 7,44 (S, 3Н); инфракрасный спектр (Nujol) 1775 см 1.
Пример 4. 6-(Э-(2-Бензилоксикарбониламино)-2-(пара-оксифенил)-ацетамидо1-пеницилланоилоксиметил-1, 1-диоксопеницилланоилоксиметилкарбонат. а. К 7,40 г (0,010 моль) тетрабутиламмоний-6-fD-(2-бензилоксикарбониламино) -2-(пара-оксифенил) -ацетамидо1пеницилланата и 3,81 г (0,010 моль) бромметил-1, 1-диоксопеницилланоилоксиметилкарбоната добавляют 50 мп диметилформамида, смесь перемешивают 4 ч. Добавляют этилацетат (500 мл) и смесь промывают поочередно солевым растврром, водой, снова солевым раствором и высушивают над безводным сульфатом натрия.
После выпаривания растворителя в вакууме получается сырой. продукт, который может быть очищен путем хроматографического разделения на силикагеле. б) 6-fD-(2-Амино-2-/пара-оксифенил/-ацетамидо))пеницилланоилоксиметил-1,1-диоксопеницилланоилоксиметилкарбонат.
Смесь 2,0 г 6-(П-(2-(бензилоксикарбониламино/-2-/пара-оксифенил/ацетамидо)) пеницилланоилоксиметил-1.,1-диоксопеницилланоилоксиметилкарбоната, 50 мл дихлорметана, 50 мп.
17261 4 изопропанола и 2,0 г 107.-ного палладия — на углероде подвергается гидрированию при давлении 3-4 атмосферы (3,5 — 4,0 кг/см ) до тех пор, пока не прекращается поглощение водорода.
Вводится дополнительно 2 г катализатора и гидрование продолжается в течение 30 мин. Катализатор удаляют путем фильтрации, и фильтрат выпаривают в вакууме, в результате получается продукт, который может быть очищен путем хроматографического разделения на Sephadex LH20.
Полученные соединения (Х) или их фармацевтически приемлемые соли проявляют in vivo антибактериальную активность, которая может быть проиллюстрирована известными способами, принятыми для пенициллиновых соеди10
15 не ний.
Фармакокинетические исследования.
В результате фармакокинетических исследований ценногоингибитора беталактамазы, салбактама установлено, 25 что он слабо абсорбируется у крыс при стоматическом применении. Так стоматические дозы в 10 мг/кг, примененные к крысам, давали максимальное содержание в крови только 0,1 мкг/мл.
30 Соединение () при стоматичес ком применении к крысам в дозе 20 мг/кг давало максимальное содержание в крови салбактама 2,18+0,49 мкг/мл через
0,25 ч, максимальное содержание в крови ампициллина через 0,5 ч сос35 тавляло 1,83+0,13 мкг/мп.
Сравнительные значения для салтамициллина. также приведены для сравнения. Все результаты представлены
40 в таблице.
Процедура. Фармакокинетические данные были получены с использованием крыс Спрак-Доули весом 80-100 г;
Испытываемые соединения применялись стоматически (5 крыс на каждое
45 соединение) в виде водной суспензии (0,5 мл), содержащей 20 мкг/кг препарата.
Пробы крови брались в указанное время и подвергались дифференциальному биоанализу с целью определения содержания ампициллина и салбактама.
При биоанализе на ампициллин используется культура Sarcina lutea (АТСС
9341), которая восриимчива к ампициллину, но не чувствительна к салбактаму при концентрации 100 мг/мл, так что он не содержит бета-лактамазу. Таким образом, этот организм
1217261 циллина и салбактама. Стандартную криву получают тем же способом,что используют для ампициллйна. Чашки для анализов получают при помощи добавления 1 мл культуры Pasteurella histolytica после инкубирования в течение ночи в 100 мл агара Мюллера-Хинтона, к которой были добав1п лены 50 г/мл ампициллина и 57 стерн стерильной бычей крови. Чашки инкубируются при 37 С в течение 18 ч, после чего измеряются размеры зон.
Из приведенных результатов можно
15 сделать вывод, что соединение (T) дает очень высокую концентрацию в крови салбактама и ампициллина при стоматическом применении. Таким образом, оно обладает отличительными
2О свойствами по сравнению с салбактамом: соединение (f) дает более высокие и более быстрые максимумы концентрации в крови салбактама по сравнению с салтамициллином.
25 ) Фармакокинетические данные после стоматического применения испытываемых соединений А и В в дозе 20 мг/кг к крысам приведены в таблице (конЗО центрация сыворотки дана в мг/мл).
Соединение А
Соединение В
Проба
Время, ч
Ампициллин
Ампициллин
0,25
2, 18+0,. 49
1,44+0, iЗ
0)83 -0,07
0,5
0)56+0,07
1,5.0,36+0, 05
О, 21+0, 02
0, 16+0, 02 4
Площадь под кривой для сыворотки, мг/мл.ч
Т 1/2
Бета-яаза, ч
2,95
2,25
2,57
2,92
0,86
1,01
0,83
ВНИИПИ Заказ 1007/62 Тираж 379 Подписное,Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4 . не показал синергетического эффекта при использовании комбинаций ампициллина и салбактама. Стандартную кривую получают в нормальной сыворотке при концентрациях ампициллина 4,2,1; 0,5; 0,25 и
0,125 мг/мл. На диски из стерильной фильтровальной бумаги наносятся 25 ламбда объема. Чашки для выполнения анализа получают с использованием зернового агара (Дифко) . Культура Sarcina lutea после инкубирования в течение ночи разбавляется в пропорции 1:100 и 1 мл разбавленной культуры добавляется в 100 мп агара в пластиковых чашках размером 12" /12" (30,5 см х 30,5 см)
-о
Затем чашки инкубируются при 37 С в течение 8 ч и замеряются размеры зон.
Процедура определения концентрации салбактама основана на нечувствительности Pasteurella histolytica (59В010) при высоких концентрациях либо только ампициллина, либо только салбактама. Однако, так как их стойкость связана через бета-лактамазу, культуры реагируют синергетически на комбинации ампиi, 74+0, 09
1, ЕЗ+0,1З t,30+0,08
0,84+0,06
0,46+0,05
0 20+0 02
0,11+0,01
1,91+0, 16
1, 89+0, 1 1
1, 23+0, 07
0)80+0)05
0,46+0,04
0)21+0,О2
О, 11+0,02
1, 19+0, 14
1, 31+0,12
0,80+0,10
0,53+0,05
0,37+0,04
0,22+0,03
0,14+0,02