Способ получения производных 2.4-диамино-5-бензилпиримидина
Иллюстрации
Показать всеРеферат
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ПАТЕНТУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3632065/23-04 (22) 11.08.83 (31) 2604/82 (32) 13.08,82 (33) HU (46) 30,03, 86. Бюл. У )2 (71 ) Эдьт Дьедьсерведьесети . Дьяр (Н)1) (72) Иван Бек, Янош Эгри, Элемер Якфалви, Дьердьи Кованьи, Ева Фурдига и Иштван Шимоньи (HU) (53) 547.853.7.07(088.8) (56) Патент Великобритании Ф 1413454, кл. С 2 С, 1978.
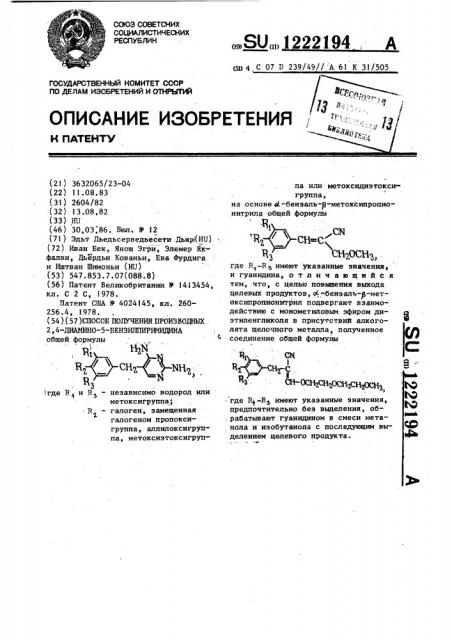
Патент США В 4024145, кл. 260256.4, 1978 ° (54).(57) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ, 2, 4-ДИАИИНО-5-БЕНЗИЛПИРИМИДИНА общей формулы нг
В / СНЪ / Ъня
Я
)где Н 1 и Н вЂ” независимо водород или метоксигруппа;
R — галоген эамещенная
7.
У галогеном пропоксигруппа, аллилоксигруппа, метоксиэтоксигруп,.SUÄÄ 1222194 А
« ц 4 С 07 D 239/49// А 61 K 31/505 па или метоксидиэтокси группа, на основе а).-бензаль-Б-метоксипропионитрила общей формулы
Я
R„cBc ñN 3 Свг0 въ где R„-Вэ имеют указанные значения, и гуанидина, отличающийся тем, что, с целью повышения выхода целевых продуктов, 4--бенэаль-8-метоксипропионитрил подвергают взаимодействию с монометиповым эфиром диэтнленгликоля в присутствий алкоголята щелочного металла, полученное соединение общей формулы
Я1 . Щ
l н -с
Я
«Н 0С) )2СК20СНЮ Н2).)СН3
> где R -Нэ имеют указанные значения, предпочтительно без выделения, об; рабатывают гуанидином в смеси метанола и иэобутанола с последующим выделением целевого продукта. со льдом и три раза экстрагируют хло роформом порциями по 50 мл. Затем органическую фазу упаривают. Полученный маслообразный продукт, окрашенный в красно-коричневый цвет (6,17 r), (/
1З фракционируют, получают 2-(4 -бромбензил) -3-метоксидиэтоксиакрилонитрила с т.пл. 63-75 C/0,06 мм рт.ст. и, = 1,6761.
ИК-спектр (KBr): 2250 (C=N), 1650
20 (СОС), 1490 (С=С), 1125 и 1110 (COC), 1075 (СОС), 1010 (Br) 930 (=СН) см .
ЯИР (СРС1 )6: 7,05 (S, IH, =СН), 7,1-6,8 (q, 4Н, ароматические протоны), 3,45 (bs, 8Н, (ОСН СН ),д ),3,22 (S, 3H, СН О), 2,8 (bs, 2Н, СН ).
10 r (О,029 моль) 2-(4 -бромбензил)-3-метоксидиэтоксиакрилонитрила растворяют в смеси из 15 мл изобутилового спирта и 5 мл метилового спирта. К этому раствору прибавляют
9,86 г (0,1 моль) гидрохлорида гуанидина и 5,83 r (0,11 моль) метилата натрия. Реакционную смесь кипятят
8 ч, после чего охлаждают до комнат35 ной температуры. Выделившуюся в осадок неорганическую соль отфильтровывают и промывают изобутиловым спиртом. Выделившийся в осадок из охлажденного фильтрата и окрашенный в
/ п. 40 желтый цвет 2,4-диамино-5-(4 -бромбензил)-пиримидин отфильтровывают, получают продукт с т.пл. 225-228 С.
В результате обработки маточного раствора дополнительно получают про45 дукт с т.пл. 224-227 С. Общий выход 93Х.
ИК-спектр (KBr): 3420 (NH>), 3320 и 1630 (NH ), 1600, 1570, 1460, 1010 .:(Вг), 800 (НН ) см ".
50 ЯМР (ДМСО-й )6 7,2-6,9 (q, 4Н, ароматические протоны), 7,22 (S IH, NH), 5,45 и 5,8 ($, 4Н, кислотные протоны), 3,45 (S, 2Н, СН g) .
Пример 2. 2,4-Диамино-5t
- (4 -6 ромбе из ил ) -пи римнди; .
1,1 г (0,004 моль) 2-(4 -бромбензаль)-3-метоксипропионитрила, по-. лученного, как указано в примере IA, 1 122219
Изобретение относится к улучшенному способу получения производных
2,4-диамиио-5-бензилпиримидина, обладающих антимикробной активностью.
Цель изобретения - повышение вы- 5 хода целевых продуктов.
Изобретение иллюстрируется следующими примерами, I
Пример 1. 2,4-Диамино-5-(4 "-бромбензил)-пиримидин.
А. 2-(4 -Бромбензаль)-3-метоксипропионитрил.
К раствору 8,59 г (0,162 моль) акрилонитрила в 17 мл безводного метилового спирта прибавляют 15 г (0,081 моль) 4-бромбензальдегида., Смесь перемешивают при 30 С до полного растворения альдегида, затеи нао гревают до 60 С, после чего к полученному раствору прибавляют по каплям раствор 5,44 r (0,097 моль) гидроокиси калия в 49 мл безводного метнлового спирта. Реакционную смесь перемешивают 5 ч при 60-65 С, затем охлаждают до 30 С, после чего к, смеси 1,5 ч прибавляют раствор 5,18 r (0,092 моль) гидроокиси калия в 17мл метилового спирта. Реакционную смесь в течение последующих 12 ч перемео шивают при 30 С. Затем отгоняют избыток акрилонитрила и растворитель.
Полученный маслообразный продукт выливают в воду со льдом и три раза экстрагируют хлороформом (порциями до 100 мл). Полученное после упаривания органической фазы маслообразное вещество, окрашенное в краснокоричневый цвет, перегоняют. Получают 9,4 г (выход 46X) 2-(4 -бромбензаль)-3-метоксипропионитрила, с т.ки
130-136 С/0,4: мм рт.ст.
n 1,5543.
Вйчислено, 7.: С 52,41; Н 3,99;
N 5,56; В 31,69, C„|H„,ÐгИО:
Найдено, Ж: С 52,27; Н 4,27;
N 5,45; Br 31,07.
ИК-спектр (KBr): 3090 (=СН), 3060 и 3030 (=СН), 2830 (СОСН ), 2210 (CN), 1630 (С=С), 1590 и 1490 (С=С)
1145 и 1 100 (СОС), 1075 (СОС), 1010 (Br)>. 965 (-СН) см .
SIMP (ДМСО-d ): 7,4 (bs, 4Н, ароматические протоны), 7,2 (bs, IН, -СН=)-, 4,05 (S, 2Н,- CF! О), 3,25 (S, 3Н, СН О).
В. 2,4-Диамино-5-(4 -бромбензил)пиримидин.
4 2
3,68 г (0,015 моль) 2-(4 -бромбензил)-3-метоксипропионитрила рас г норяют в 11,92 г (0,099 моль) безводного монометилового эфира диэтиленгликоля, к раствору прибавляют
0,92 r (0,017 моль) метилата натрия, после чего смесь перемешивают в течение 6 ч при 75-77 С. После охлаждения смесь выливают в 50 мл воды
1222194 4 растворяют в 2,5 мл безводного монометилового эфира диэтиленгликоля.
После прибавления 0,2 r (0,0037моль) метилата натрия реакционную смесь перемешивают 6 ч при 75-76 С. После о охлаждения до 30 С к 1реакционной, смеси прибавляют 1 мл изобутилового спирта, 0,3 мл метилового спирта, 0,6 r (0,006 моль) гидрохлорида гуанидина и 0,35 r (0,004 моль) метилата натрия. Непосредственно после этого реакционную смесь кипятят 8 ч.
Образовавшийся после охлаждения смеси продукт отфильтровывают и промывают водой. В результате получают окрашенный в светло-желтый цвет
2,4-диамино-5-(4 -бромбензил)-пиримидин, т.пл. 224-226 С.
П р и.м е р 3. 2,4-Диамино-51
-(4 -аллилокси — 3 5 -диметоксибензил)-пиримидин.
А. 3,5-Диметокси-4-аллилоксибензальдегид.
40 r натриевой соли сиреневого альдегида растворяют в 300 мл воды и к раствору прибавляют 36,3 г алр лилбромида и 3 мл Triton В катализатора (неионное поверхностно-активное вещество, продукт взаимодействия октилфенола с окисью этилена).
После кипячения смеси 5 ч ее немного охлаждают, снова прибавляют к смеси 12 r аллилбромида и 2 г и гицроокиси натрия. кипятят еще в течение 5 ч. Непосредственно после этого смесь охлаждают и два раза экстрагируют 1,2-дихлорэтаном, используя каждый раз по 50 мл последнего. Дихлорэтановую фазу промывают 50 мл
2Х-ного водного раствора гидроокиси натрия, обрабатывают активированным углем и затем упаривают. Полученный остаток при охлаждении кристаллизуется. Кристаллический продукт растирают с холодной водой, отфильтровывают и сушат при комнатной температуре получают 3 5-диметокси-4-алУ Э
Р лилоксибензальдегид с т.пл. 46 47 С.
В. 2-(4 -Аллипокси-3,5 -днметоксибензаль)-3-метоксипропионитрил.
0,09 г (0,001 моль) гидроокиси калия растворяют в 6 мл безводного метилового спирта, после чего к приготовленному раствору прибавляют. по каплям при 35-38 С 2,3 r(0,04 моль акрилонитрила, затем реакционную смесь перемешивают в течение послео дующего часа при 40 С. К смеси при10
0,55 г (0,01 моль) метилата натрия прибавляют к раствору 2,64 г (0,009 моль) 2-(4 -аллилокси-3,5-диметоксибензаль)-3-метоксипропионит35 рила в 7 мп безводного монометилового эфира диэтиленгликоля, после чего реакционную смесь перемешивают 6 ч при 80-82 С. Затем смесь охлаждают до комнатной температуры, выпивают
40 в 15 мл воды со льдом и пять раз экстрагируют бензолом, используя каждый раз по 50 мл последнего. После упаривания органической фазы получают окрашенное в красно-коричневый цвет маслообразное вещество. Выход состав. лял 91Х от теоретического.
n = 1,6720.
ИК-спектр (KBr): 2250 и 2220 (CN), 1248 и 990 (СОС), 1465 и 1130 (СНБО) см 1
ЯМР (СПС1з ): 6,2 (ш, 1Н, =СН), 6,0-5,5 (m, 1Н, =СН), 5,3-4,8 (2Н,"
=СН), 4,3 (а, 2Н, СН О-), 3,7 (S, 6Н, СНЗО-), 3, 5 (bs, 8Н, (ОСН,СН ).р), 3,27 (S, ЗН, СНБО), 2,8 (m, .2Н;;
) 55 сй,-).
tl
Д. 2, 4-Днам но-5-(4 -аллилоксиФ t
-3,5 -диметоксибензил)-пиримидин.
30 бавляют 3,8 г (0,017 моль) 4-аллилокси-3,5-диметоксибензальдегида и после этого перемешивают 12 ч при о
60-65 С. После охлаждения реакционной смеси до комнатной температуры отгоняют избыток растворителя и акрилонитрила. Полученное маслообразное вещество выливают в 50 мл воды со льдом и три раза экстрагируют бенэолом, используя каждый раз по 50 мл последнего. После упаривания органической фазы получают 3,46 r окрашенного в желто-коричневый цвет маслообразного вещества. Выход 70Х от теоретического. п = 1,5599.
ИК-спектр (KBr): 3090 и 3010 (=СН), 2850 (СН 0), 22)0 (CN), 1630 и 1590 (C=C), 1510 (С=С), 1465, 1330 и 1130 (СН О), 1190 и 1100 (СОС), 1235 (СОС), 985 (СОС) см .
ЯМР (CDC1 )о : 6,79 (Ъз,ЭН, ароматические протоны и СН), 6,5-5,5 (m, 1Н, СН=), 5,.4-4,8 (m, 2Н, СН =), 4,4 (d, 2Н, СН -), 4,0 ($, 2Н, СН -), 3,7 ($, 6Н, СН О-), 3,3($, ЗН, СН О).
С ° 2-(4 -Аллилокси-3,5 -диметоксибензил)-3-метоксидиэтоксиакрило" нитрил.
)222)94
1,12 г (0,0!2 моль) гидрохлорида гуанидина, 0,66 г (0,013 моль) ме тилата натрйя и 1,13 г (Ор003 моль) !
2-(4 -аллилокси-3,5 -диметоксибен-. зил)-3-метоксидиэтоксиакрилонитрила перемешивают в смеси 2 мл изобутилового спирта и 1 мл метилового спирта. Суспензию перемешивают в течео ние часа при 35-40 С, после чего на- !О гревают до 90-92 С и выдерживают при указанной температуре в течение
18 ч. Затем смесь охлаждают до комнатной температуры, выделившийся в осадок хлористый натрий отфильтровы- !5 вают, фильтрат обрабатывают активированным углем, фильтруют и кристаллический продукт, который выделяется в осадок при охлаждении водой со льдом, отфильтровывают и сушат. По- 20 лучают соединение с т.пл . 188-190 С, выход 93Х от теоретического.
ИК-спектр (KBr): 3480, 3835 и
3200 ()))Н ), 1670, 1645 и 1610 (1))Н, и С=С), 1,470 и 1130 (СНзО), 1240 25 и 1005 (СОС) см ".
ЯМР (ДМСО-de): 7,2 (S 1Н, =N), 6,37 (S, 2Н, ароматические протоны), 5,8, 5,4 (bs 7Н, NH и СН =СН-), 4,2 (d, 2Н, -С!40), 3,68 (S, 6Н, . СНЗО-(,3,4)S, 2Н, -CH ) .
Пример 4. 2,4-Диамино-5I
-(4 -метоксидиэтокси-3,5 -диметоксибензил)-пиримидин.
А. 4-Метоксидиэтокси-3,5-диметоксибензальдегид.
40,80 r (0,2 моль) натриевой соли сиреневого альдегида растворяют в 300 мл воды и к приготовленнному раствору прибавляют по каплям 28 r 40 (0,2 моль) метоксиэтоксиэтилхлорида.
Реакционную смесь кипятят в течение 20 ч, затем охлаждают до комнатной температуры и три раза экстрагируют бензолом, используя каждый раэ 45 по 200 мл последнего. Органическую фазу два раза промывают 2Х-ным водным раствором гидроокиси натрия, используя каждый раэ по 100 мл указанного раствора до тех пор, пока промывная жидкость станет совершенно .светлой. После упаривания органической фазы получают окрашенное в крас.ный цвет маслообразное вещество (16 г), которое перемешивают в течение часа при комнатной температуре с раствором 16 г (0,17 моль) бисульфата натрия в 100 мл воды. Значение рН полученного раствора при охлажде нии доводят до 10 путем прибавления
20Х-ного водного раствора гидроокиси натрия, после чего образовавшийся маслообразный продукт три раза экстрагируют бензолом, используя каждый раз по 150 мл последнего. После упаривания органической фазы получают
27,8 r окрашенного в красный цвет маслообразного вещества. Выход 48,9Х от теоретического.
n = 1,6789.
ИК-спектр (KBr): 1695 (ОО), 1465, (СН О-), 1130 и 1330 (СН О), !230 (С-.О) см, ЯМР (CDC1 ): 9,46 (S, 1Н, -СНО), 6,8 (S, 2Н, ароматические протоны), 3,75 ($, 6Н, CH 0-), 4,1 (t5 2Н, -СНБО-),3,8-3,4 (m, 6Н, -СН -), 3,25 ($, ЗН, СН О-).
В. 2-(4 -Метоксидиэтокси-3,5-диметоксибензаль)-3-метоксипропионитцил °
К раствору 0,18 r (0,003 моль) гидроокиси калия в 18 мл безводного о метилового спирта при 35-40 С в течение 1,5 ч прибавляют по каплям
4,47 г (0,084 моль) акрилонитрила, после чего реакционную смесь в течение последующего часа перемешивают при 40 С. Затем к смеси прибавляют
12,5 г (0,044 моль) 4-метоксидиэтокси-3,4-диметоксибензальдегида и реакционную смесь в течение 12 ч нагре45 вают при 60-65 С. После этого реакционную смесь охлаждают до комнатной температуры, выливают ее в 100мл воды со льдом и четыре раза экстрагируют хлороформом, используя каждый раз по 50 мл последнего. После упаривания органической фазы получают 14,8 r окрашенного в красный цвет маслообразного вещества. Выход 95,5Х от теоретического.
n> = 1,6767.
ИК-спектр (KBr ): 2860 (СН О-), 2220 и 2260 (CN), 1625 (С=С), 1590 и 1510 (C=C), I 465 (CH О); 1335 и
1130 (Cl: О), 1250 (COC) 1100 (СОС) см- .
ЯМР (CDC1> ): 6, 75 ($, ЗН, ароматические протоны), 4,0 (t, 2H, -CH -), 3,98 (S, 2Н, -СН -), 3,7 (S, 6Н
СНзО-), 3,5 (t, 6Н, -СН g-), 3.25 (S, ЗН, CH 0-), 3,22 ($, ЗН; СН О -).
С. 2-(4 -Метоксидиэтокси-3,5 -диI. з, метоксибензил)-3-метоксидиэтоксиакри-. лонитоил
1222)94
10 г (0,028 моль) .2-(4 -метоксидиэтокси-3,5.-диметоксибензаль)-3-метоксипропиочитрила растворяют в
23 мл безводного монометилового эфира диэтиленгликоля, после чего к приготовленному раствору прибавляют
1,76 г (0,033 моль) метилата натрия. Реакционную смесь перемешивают в течение 6 ч при 75-77 С, затем ох- 1Ц лаждают до комнатной температуры, выливают в 100 мл воды со льдом и экстрагируют три раза хлороформом, используя каждый раз по 100 мл последнего. Объединенные органические 15 фазы упаривают. Остаток еще содержит монометиловый эфир диэтиленгли коля, который отгоняют при 40-489С и давлении 0,1 мм рт.ст. Выход продукта 95Х от .теоретического. 20
n> = l,6772.
ИК-спектр (KBr): 2250 (CN), 1630 (С=С), 1590 и 1500 (С;С), 1460 (СН ) ,1330 и 1120 (СН ), 1240 и 1195 (СОС)
lll0 и 1040 (СОС) см ". 25
ЯИР (CDC1 ): 6,8 (S, 2Н, ароматические протоны), 6,15 (S, )Н, -Сн-), 4,0 (t, 2Н-, СНА-), 3,7 (S, 6Н, CH O-), 3,6 (S, 2Н -СН ), 3,5 (t» !ОН, -СН,-), 3,25 (Я, 6Н, СНБО). 30
Д. 2,4-Диамино-5-(4 -метоксидиФ в этокси-3,5 -диметоксибенэил)-пиримидин.
Готовят раствор метилата натрия путем прибавления 1,24 г(0,054 моль) металлического натрия к 20 мл безводного метилового спирта, после чего к приготовленному раствору прибавляют 4,87 г (0,05) моль) гидро= хлорида гуанидина. Реакционную смесь в течение 20 мин перемешивают при комнатной температуре и отфильтровывают затем выделившийся в осадок хлористый натрий (3,)2 г). K раствору полученного гуанидинового основания прибавляют 6,5 r (0,0)5 моль)
2-(4 -метоксидиэтокси-.3,5 -диметI f оксибензил) -3 метоксидиэтоксиакрилонитрила и 8 мл изобутилового спирта. Реакционную смесь кипятят в течение 24 .ч, затем охлаждают до комнатной температуры и упаривают.
Полученное в виде остатка маслообразное вещество, окрашенное в коричневый цвет. растворяют в 100 мл воды и три раза экстрагируют этилацетатом, используя каждый раэ по 50мл последнего. После упаривания органической фазы получают маслообразный продукт, который отфильтровывают и промывают диэтиловым эфиром.
Полученный слабоокрашенный порошкообразный продукт представляет собой соединение с т.пл. 120-123 С. Выход
937. от теоретически рассчитанного значения.
ИК-спектр (KBr) 3450 (NH ), 3330 и 3160 (NH ), 1635 (NH ), 1590 и
)560 (БН, ), 1450 (СН 0), 1325 и 1120 (СН О), 1230 (СОС) см яиц (лмсо-а,) : 7,ã (s, )н, -N-), 6,25 (S, 2Е, ароматические протоны), 5 6, 5,4 (S, 4H, -НН ), 3 56 (8, 6Н, СН О-), 3,36 (S, ЗН, СН 0-), 3,12 (я, гн, -сн -).
Пример 5. 2,4-Диамино-5-(4 -)3 -хлорпропокси(-3 5 -диметоксибензил)-пиримидин.
А. 3,5-Диметокси-4-(3 -хлорпропoYcH)-бензальдегид.
20,4 г (0,1 моль) натриевой соли сиреневого альдегида растворяют в
150 мл воды при нагревании, после чего к приготовленному раствору прибавляют по каплям сначала 1 5,8 г (0,1 моль) 1,3-хлорбромпропана и saтем 2 мл Triton В. После кипячения смеси в течение 8 часов, к ней вновь прибавляют по каплям 15,8 r(0,1 моль)
1,3-хлорбромпропана и ) мл Triton В, после чего реакционную смесь в течение последующих 8 ч кипятят с обратным холодильником. После завершения взаимодействия смесь охлаждают до комнатной температуры и три раза экстрагируют ),2-днхлорэтаном, применяя каждый раз по 150 мл последнего. 3атем органическую фазу три раза промывают 2Ж-ным водным раствором гидроокиси натрия, применяя каждый pas, по 100 мл указанного раствора, после чего органическую фазу упаривают. В результате получают 11,12 г окрашенного в коричневый цвет маслообраэного вещества. Выход продукта 43Х от теоретического.
n = 1,5558.
ИК-спектр (KBr): 1695 (С=О), 1465 (СН 0-), 1330 и l)30 (СНзО), 1235 (СОС ), )020 (СОС) см .
ЯМР (CDCl ): 9,42 (S, 1Н, -СНО), 6,8 (8, 2Н, ароматические протоны), 4,00 (t, 2Н, СН О-), 3,71 (S, 6Н, СН О-), 3,65 (С, 2Н, Сl-), 2,01 (m, 2Н, СНз-).
1222194
В. 2-(4 -((3 -Хлорпропокси) — 3 5 —
-диметоксибензаль)-3-метоксипропионитрил.
0,17 г (0,003 моль) гидроокиси калия растворяют в ll мл безводного метипового спирта, после чего к пригоа товленному раствору при 30-38 С прибавляют bio каплям 3,84 r (0,073 моль) акрилонитрила. Затем реакционную смесь перемешивают в течение последуо ющего часа при 40 С, после чего к ней прибавляют 7,38 г (0,029 моль)
3,5-диметокси-. 4-3 -хлорпропоксибенз(. альдегида. После этого реакционную смесь выдерживают 12 ч при 60-65 С, 2 затем выливают в 50 мл воды со льдом и три раза экстрагируют хлороформом, применяя каждый раз по 40 мл последнего. После упаривания органической фазы получают 6,7 r окрашенного в светло-желтый цвет маслообразного вещества. Выход продукта 72Х от теоретического.
35 Щ
4 г (0,012 моль) 2- 4(-(3"-хлорпропокси)-3,5 -диметоксибензаль)-3-метоксипропионитрила растворяют в 10 мл безводного монометилового эфира диэтиленгликоля, после чего к приготовленному раствору прибавля ют 0,74 r (0,014 моль) метилата натрия. Реакционную смесь 6 ч перемешивают при 75-77 С, затем охлаждают до комнатной температуры, выпивают в 50 мл воды со льдом и три раза экстрагируют хлороформом, применяя .каждый раз по 50 мл последнего. Органическую фазу упаривают, в результате чего получают 4,08.г окрашенного в красный цвет маслообраэного вещества. Выход продукта 80Х от теоретического.
n = 1 5579.
ИК-спектр (KBr): 3010 (тСН), 2850 (СН 0-); 2220 (CN), 1600 (С=С), 1585 (С=С), 1505 и 1420 (С=С), 1465 (CHs)
1303 и 1130 (СН ), 1240 (СОС), 1020 (ССС), 830 (СН= см 4.
ЯНР (CDC1 ): 6,8 (S, ЗН, ароматические протоны), 4,0 (t, 2Н, -CH -), 3,3 (S, ЗН, СН 0-), 4,0 (t, 2Н, -CHIO-), 3,71 (S, 58, СН вЂ”, СН 0-), 2,1 (ш, 2Н, -СН(3-).
С. 2™(4 -(3 -Хлорпропокси)-3,5—
-диметоксибензил1-3-метоксидиэтоксиакрилонитрил.
n = 1,5090.
HK-спектр (KBr): 2250 (CN), 1585 и 1505 (С=С), 1460 (CH ), 1330 и
1130 (СН ), 1240 (СОС), 1030 (СОС), 1645 (С=С), 930 (СН=), 850 (СН=) см
ЯИР (CDC1 ): 6,8 (S, 2Н, ароматические протоны), 6,15 (S, 1Н, -GH-), 4,0 (4, 2Н, -СН -), 3,75 (S, 6Н, СНЭО-), 3,71 (S, 2Н, -СН4-), 3,6 (S, 2Н, ™мСН. -), 3,5 (С, 8Н, -CH -), 3,3 (S, 3H, Сй 0), 2,1 (m, 2Н, СН ).
Д. 2,4-Диамино-5-(4 -(3 -хлор1/ пропокси) -3,5 диметоксибензил1-пиримидин.
Процесс осуществляют аналогично примеру 1Д. В результате получают соединение с т.пл. 163-164 С. Выход продукта 89Х от теоретического.
Пример 6. 2,4-Диамино-5-(4 -метоксиэтокси-3,5 -диметокси» бензнл)-пиримидин.
А. Сиреневый альдегид.
К 1500 мл концентрированной серной кислоты при перемешивании прибавляют 300 г 3,4,5-триметоксибенэальдегида. Во время растворения аль
О дегида смесь нагревается до 35-40 С, после чего полученный раствор черногр цвета перемешивают в течение 15 ч при 40-42 С. Деметилирование в положении 4 завершается в течение этого времени проведения реакции, что подтверждается тонкослойной хроматографией (1 мл реакционной смеси смешивают с 3 r льда и 2 мл 1,2™дихлорэтана, после чего 2-3 мл органической фазы наносят на пластину с силикагелем; элюирующая смесь состоит из хлороформа, ацетона и.ледяной уксусной кислоты в соотношении 60:,"
:30:10). Если смесь еще содержит исходный альдегид, процесс продолжают.
Если 3,4,5-триметоксибензальдегид более не обнаруживается в реакционной смеси, то последнюю охлаждают до
20 С и прибавляют к ней 4 кг льда .и 2000 мл 1,2-дихлорэтана. Нижнюю водную фазу отделяют, а верхнюю органическую фазу промывают 1000 мл воды.
Теперь фазы обмениваются местами, причем нижняя органическая фаза содержит сиреневый альдегид. Эту фазу упаривают, после чего к полученному остатку прибавляют 125 г бисульфита натрия, которые предварительно растворяют в 2000 мл воды. Смесь переме1222194
10 шивают в течение 2 ч при 35-40 С и после седиментации раствор декантацией отделяют от смолы, затем раствор обрабатывают 20 г активированного угля и фильтруют. К фильтрату по кап.лям прибавляют 407.-ный раствор гидроокиси натрия до прекращения образования осадка. Полученную суспензию охлаждают до температуры ниже 10 С, фильтруют и промывают холодной водой.
Влажную соль при перемешивании . растворяют в десятикратном количестве воды и раствор подкисляют прибавлением концентрированной соляной кис- 15 лоты до рН 2. Выделившийся в осадок сиреневый альдегид отфильтровывают, промывают водой и сушат. В результате получают от 120 до 140 г сиреневого альдегида с т.пл. 111-114 С. По 20 данным хроматографии в тонком слое продукт является однородным.
В. Метоксиэтилхлорид.
76 мл хлористого тионила в течение 3 ч при 30 С прибавляют пб каплям к 76 г метоксиэтилового спирта, после чего реакционную смесь перемео шивают 20 ч при 30-35 С. Образовавшийся метоксиэтилхлорид перегоняют с помощью колонки длиной 50 см. Ос- 30 новная фракция имеет т.кип ° 90-91 С.
В результате получают 68 г метоксиэтилхлорида.
n = 1,4090.
С. 3,5-Диметокси-4-метоксиэтоксибензальдегид.
200 r натриевой соли сиреневого альдегида растворяют в 1500 мл воды, к приготовленному раствору прибавляют 90 г метоксиэтилхлорида, после чего реакционную смесь кипятят в течение 16 ч. После прибавления еще
60 г метоксиэтилхлорида и 20 г гидроокиси натрия реакционную смесь кипятят 16 ч. Затем реакционную смесь охлаждают и два раза экстрагируют бенэолом, применяя каждый раз по
500 мл последнего. Органический экст ракт дважды промывают 2Х-ным водным раствором гидроокиси натрия, применяют каждый раз по 250 мл указанного раствора, затем органическую фазу обрабатывают активированным углем, фильтруют и упаривают. В результате получают 150 r маслообразного вещества, которые растворяют в 600 мл
207-ного раствора бисульфита натрия.
Полученный раствор обрабатывают активированным углем, фильтруют, после чего фильтрат доводят до рН 9-10 пуо тем прибавления при 0-3 С раствора гидроокиси натрия. Осадок отфильтровывают на холоду и сушат. В резуль тате получают 125 r указанного в заголовке соединения с т.пл. 29-33 С, а чистота полученного соединения составляет 97-987 (на основании определения альдегида). По данным хроматографического анализа в тонком слое продукт является однородным (элюирующая смесь растворителей состоит из хлороформа, этилацетата и бензола в соотношении 40:40:20).
Д. 2,4-Диамино-5-(4 -метокси! I этокси-3,5 -диметоксибензил)-пиримидин.
1,5 г гидроокиси калия растворяют в 100 мл метилового спирта и к приготовленному раствору прибавляют в течение 3 ч 45 г акрилонитрила.
Затем реакционную смесь дополнительно перемешивают в течение часа при
40-42 С и прибавляют к ней 100 r
3,5-диметокси-4-метоксиэтоксибензальдегида. Реакционную смесь перемешивают в течение 8 ч при 60-62 С, после чего от нее отгоняют метиловый спирт и избыточное количество метоксипропионитрила. Полученный остаток растворяют в смеси, состоящей из 400 мл воды и 400 мл бензола,у и производят разделение фаз. Органическую фазу промывают водой и упаривают. Полученный в виде остатка неочищенный маслообразный продукт растворяют в 250 мл безводного монометилового эфира диэтиленгликоля, после чего к приготовленному раствору прибавляют 200 г порошкообразной гидроокиси натрия. Реакционную смесь нагревают до 75-76 С и перемешивают при указанной температуре
6 ч. После охлаждения смеси до 30 С к ней прибавляют 100 мл иэобутилового спирта, 30 мл метилового спирта, 60 г гидрохлорида гуанидина и 35- г порошкообразного метилата натрия.
Реакционную смесь кипятят 8 ч, после чего от нее при слегка понижейном давлении отгоняют 110 мл смеси растворителей. Полученный остаток разбавляют метиловым спиртом и раствор охлаждают. Постепенно происходит кристаллизация продукта. Его отфиль ровывают, промывают небольшим колиl3
14
1222194
10
20
30
55 чеством метилового спирта и перекристаллизовывают из пятикратного количества горячей воды. Полученный о продукт имеет т.пл. 158-160 С. Выход продукта 91Х от теоретического.
Пример 7, 2,4-Диамино-51 1
-(4 -метоксиэтокси-3,5 -диметоксибензил)-пиримидин.
А. 2-(4-Метоксиэтокси-5-диметоксибензаль ) -З-метоксипропионитрил.
К раствору 0,7 r гидроокиси калия в 50 мл безводного метилового спирта при 35-40 С прибавляют в течение 3 ч
22 г акрилонитрила. Реакционную смесь о перемешивают в течение часа при 40 С после чего к смеси прибавляют 49 r
4»метоксиэтокси-3,5-диметоксибензальдегида, который получают в соответствии с примером 6,С.Реакционную, о смесь перемешивают 8 ч при 60-62 С.
Целевой продукт может быть определен с помощью хроматографии в тонком слое. Элюирующая смесь растворителей состоит из хлороформа, этилацетата и бензола в соотношении 40:40:20.
После завершения реакции от реакционной смеси при слегка пониженном давлении отгоняют метиловый спирт и избыточное количество метоксипропионитрила. Полученный остаток растворяют в смеси 200 мл воды и 200 мл бензола. Затем фазы разделяют. Органическую фазу промывают водой и затем упаривают. Полученный в виде остатка неочищенный маслообразный продукт подвергают фракционной перегонке при
192-195 С/0,05 мм рт.ст. В результате получают окрашенное в светло-желтьпу цвет маслообразное вещество.
n - =1,5498.
?> 1
В. 2-(4 -Иетоксиэтокси-3,5 -диметоксибензил)-3-метоксидиэтоксиакрилонитрил.
Смесь 50 мл безводного монометилового эфира диэтиленгликоля, 20 г
2-(4 -метоксиэтокси-3,5 -диметокси, бензаль) -3-метоксипропионитрила и 4 r порошкообразного метилата натрия нагревают до 75-77 С, после чего смесь в течение 6 ч перемешивают при укаэанной температуре (целевой продукт может быть определен с помощью хроматографии в тонком слое; элюирующая смесь растворителей состоит из ксилола и метилгликоля в соотношении 90:10). После завершения изомериэации смесь охлаждают и смешивают с 200 мл бензола и 500 мл воды. После разделения органическую фазу двал ды промывают водой, используя каждый раз по 200 мл последней, и затем упаривают. Полученный остаток подвергают фракционной перегонке при
180-185 /0,02 мм рт.ст. В результате получают окрашенное в светло-желтый цвет маслообраэное вещество ° Выход продукта 857 от теоретического. и го
1,5510.
С. 2,4-Диамино-5-(4 -метоксиэтокси-3,5 -диметоксибензил) — пиримидин.
К смеси 15 мл изобутилового спирта, 4 мл метилового спирта, 8,5 мл гидрохлорида гаунидина и 5 г порошкообразного метилата натрия прибавляют 10 г 2-(4 -метоксизтокси-3,5 / lg диметоксибензил)-3-метоксидиэтоксиакрилонитрила, после чего реакционную смесь кипятят 7 ч. Затем от реакционной смеси отгоняют 15 мл смеси растворителей. Полученный остаток представляет вязкое маслообразное вещество, которое медленно кристаллизуется. Остаток перемешивают с
20 мл метилового спирта, полученную суспензию кристаллического вещества фильтруют, кристаллический продукт растворяют в 25 мл горячей воды и раствор обрабатывают активированным углем. После охлаждения раствора получают в виде белого кристаллического
1»
35 вещества 2,4-диамино-5-(4 -метокси1 1 этокси-3,5 -диметоксибензил)-пирими,дин с т.пл. 158-160 С. Выход продук та 897 от теоретического.
Пример 8. 2,4-Диаиино-5-!
-(4 -аллилокси-3,5 -диметоксибензил)-пиримидин.
22 г акрилонитрила при 35-38 С прибавляют по каплям к раствору 0,9г гидроокиси калия в 50 мл метилового спирта. Реакционную смесь перемешио вают в течение часа при 40 С. Затем к смеси прибавляют 36 г 4-аллилокси-3,5-диметоксибензальдегида. РеакциЬнную смесь в течение 12 ч перемешивают при 60-65 С, затем охлаждают, после чего к смеси прибавляют 300 мл воды и 200 мл бензола. Органическую фазу отделяют, промывают водой и упа-. ривают. Полученный остаток растворяют в 40 мл безводного монометилового эфира диэтиленгликоля, к приготовленному раствору прибавляют 6 г порошкообразного метилата натрия, посl5!
1222194
Составитель А. Орлов
Редактор М. Недолуженко Техред!Г.Гербер Корректор А. Зимокосов
Заказ 1623/61 Тираж 379 Подписное
ВНИИПИ .Государственного комитета СССР по делам изобретений и открытий
113035, Москва, 3-35, Раушская наб., д. 4/5
:c
Филиал IIHII "Патент", г . Ужгород, ул. Проектная, 4 ле чего реакционную смесь в течение б ч перемешивают при 80-82 С. К охо лажденной до 30 С смеси прибавляют 60 мл изобутилового спирта, 15 мл метилового спирта, 30 г гидрохлорида гуанидина и 28 г порошкообразного метнлата натрия. Непосредственно после этого реакционную смесь перемешивают в течение часа при 35-40 С, затем в течение 18 ч нагревают смесь при 90-92 С. После завершения взаимодействия при слегка пониженном давлении от реакционной смеси отго-. няют изобутиловый и метиловый спирты. Остаток представляет собой маслообразное вещество, которое кристал лизуется очень медленно. Маслообразное вещество кристаллизуют путем прибавления воды на холоду.
Полученный неочищенный продукт перекристаллизовывают из 503-ного водного этилового спирта. Полученный
2,4-диамино-5-(4 -аллилокси-3,5 -диметоксибензил)-пиримидин имеет т.пл.
188-190 С и идентичен продукту; по, лученному в примере 3.