Способ получения производных бензофенонгидразонов
Иллюстрации
Показать всеРеферат
СОЮЗ СО8ЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
„„SU„„22 842
; -э
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К IlATEHTY 3 ., О,0 3 С 1, ГОСУДАРСТ8ЕННЫИ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 2745703/23 — 04 (22) 28.02.79 (31) 8002/78; 8003/78 (32) 01.03.78. (33) GB (46) 07,04.86. Бюл. ¹ 13 (71) Дзе Бутс Компани Лимитед (GB) (72) Леонард Джордж Коппинг, Джон Сесил
Керри, Томас Исвел Ваткинс, Роберт Джон
Виллис и Брайан Харпер Палмер (GB) (53) 547541.07(088.8) (56) Вейганд-Хильгетаг. Методы эксперимента в органической химии. М.:, Химия, с. 474—
476. (54) (57) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОЛ
НЫХ БЕНЗОФЕНОНГИДРАЗОНОВ ОБЩЕЙ
ФОРМУЛЫ 1 где Я вЂ” галоид;
Яа — метил или трифторметил;
R — водород, группа R ОСΠ—, где
ЯЧ вЂ” неэамешенный или галоидзамешенный алкил с 1 — 4 атомами углерода,или группа R — СΠ—, где Rg — водород или Я, (51) 4 С 07 С 143/68// А 01 N 41/04 о т л и ч а ю ш и и с я тем, что бенэофенон обшей формулы 11
825020 СО / 3 В у где Я„и R имеют указанные выше значения подвергают взаимодействию с гидразином общей формулы 111
R3NH " а где R> имеет указанные выше значения, в среде низшего алифатического спирта или ароматического углеводорода, такого как толуол или ксилол, в присутствии каталитического количества кислотного катализатора, такого как уксусная, л-толуолсульфо- или пирндинтрифторметансульфокислота или пиридингидрохлорид, при кипячении с последующим в случае необходимости ацнлированием полученного соединения формулы 1, где
R — водород, соединением общей формулы
IV, V или Vl, соответственно
Я 1 ОДНОЕ)Я вЂ”.СОЛили(Я вЂ” СО)20) где R, и R имеют укаэанные выше знач
4 ния:
Z — галоид, или соединения формулы 1, где R — СНО, уксусномуравьиным ангидридом в присутствии органического основания при 0 — 100 С.
23842
I l2
Изобретение относится к способу получения новых производных бензофенонгидразонов формулы
1ч 1чн 3 о l 3 (/ ц где R„— галоид;
R q — метил или трифторметил;
R — водород, группа R OC0 —, где
 — незамещенный или галоидзамещенный алкил с 1 — 4 атомами углерода, или группа R — CO —, где R5- — водород или R, которые проявляют инсектицидную активность и могут быть использованы в сельском хозяйстве.
Целью изобретения является разработка способа получения новых соединений из класса бензофенонгидразонов, которые бы обладали высокой инсектицидной активностью.
Пример 1. Пояснение схемы 1.
Фенол подвергают реакции с и-хлорбензоил-хлоридом согласно реакции Фридель — Крафтса в присутствии хлористого алюминия, что дает
4-хлор-4 -оксибензофенон, 179 — )88 С (A), К раствору этого соединения (5 г) в пиридине (6 MJI) добавляют метансульфонилхлорид (2,5 г) при комнатной температуре.
Реагирующие вещества нагревают на паровой бане 1 — 1/2 ч и жидкий продукт реакции выливают в разбавленную хлористоводородную кислоту. Выделившееся в осадок твердое ве-щество отфильтровывают и высушивают на воздухе. Это твердое вещество перекристаллизовывают из технического этилового спирта, денатурированного метанолом, что дает 4-хлор-4 -метилсульфонилоксибензофенил, температура плавления 120 — 121о С (В). Раствор 9,4 r этого продукта и этилкарбазата (7,8 г) в "ледяной" уксусной кислоте (8 мл) и этаноле (200 мл) нагревают при действии обратного холодильника 48 ч, затем выпаривают в вакууме досуха. Остаток экстрагируют метиленхлоридом (250 мл) и экстракт промывают водой, водным раствором гидрата окиси натрия (2,5 н.) и водой, после чего высушивают и упаривают досуха, Получают 4-хлор-4--метилсульфонилоксибензофенон этоксикарбонилзидразол, температура плавления 1325 140 С (С)
Пример 2. Пояснение к схеме 2. К раствору (В) по примеру 1 (9,35 г) в этаноле (200 мл) добавляют гидразин гидрат (3 мл), затем "ледяную" уксусную кислоту (1,5 мл). Смесь нагревают при действии обратного холодильника при перемешива нии 17 ч. Растворитель выпаривают при
1Î
3S
46
45 пониженном давлении, что дает масло, которое экстрагируют хлороформом. Экстракт промывают водой, водным раствором гидрата окиси натрия и водой, далее высушивают над сульфатом магния. Растворитель выпаривают при уменьшенном давлении, что дает 4-хлор-4 -метил-сульфонилоксибензофеион гидразон, температура плавления 70-110 С (D). о
Пример 3. Пояснение к схеме 3.
Раствор пропионил-хлорида (2 г) в эфире (15 мл) добавляют по каплям при перемешивании к раствору (D) по примеру 2 (2,62 .г) в пиридине (20 мл) при 0 до 5 С в течение 30 мин. Палее смесь перемешивают при комнатной температуре 1 — 1/2 ч и подвергают резкому охлаждению посредством воды (1 л). Отфильтровывают твердое веще™м ство, промывают разбавленной хлористоводородной кислотой и водой, затем высушивают в вакууме при 60 С в течение 1 — l/2 ч, что дает 4-хлор-4 -метилсульфонилоксибензофенон пропионил гидразон, температура плавления 128 — 144 С (С) .
Продукты, указанные выше и в последу-, ющих примерах, получаются обычно в виде смесей геометрических изомеров. Соотношение между двумя измерами изменяется от одного продукта к другому.
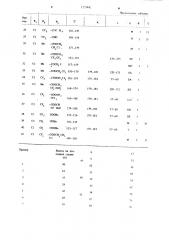
II р и м е р 4 — 41. Соединения, показан-. ные в таблице, получают по одной из приведенных схем по предлагаемому способу.
Физические показатели (температура плавления в С, если отсутствуют другие указао ния) приведены в колонке t для целевых, окончательных продуктов. Соответственно в колонке К указан исходный материал, и колонке L — промежуточный продукт.
При работе по схеме 3 исходным материалом служит продукт по предыдущему примеру. Исходный материал (колонка К) типа
A,и*спользуют для схем 1 или 2. Промежуточ чный продукт (колонка L) т гча В применяют для схем или 2. В колонке, озаглавленной А, показан тип ацилируюшего средства или производного гидразина.
Ацилиру ащие агенты:
М вЂ” Галоидный ацил
И вЂ” Уксусно-муравьиный ангидрид
МС вЂ” Этил фторацетат
Производные гидразина:
Б — Этилкарбазат
Т вЂ” Метипкарбазат
/ "" — 2,2,2-Трихлорэтил карбазат
У У вЂ” 1Н, IH — Гелтафторбутилкарбазат
SA — 2,2,2 — Трифторэтилкарбазат
S D — 2„2,3,3-Тетрафторпропилкарбазат
SE -трет-Бутилкарбазат
Аналогично проводят реакции, но при этом этанол заменили группой растворителей, ) ) кае 4 кагачнэаторов, включанпцих и-толуолсуньф.кислоту, пирипинтрнфторметансулъфонат, и ниридингипрохлорид; реакцию апио
:) лнрования провели нри 0 С и 100 С, а нирндин заменили рядом основа.
5 ний, включаюших триметиламин и тризтиламин. е
1
Пример В„
А В С
К
4 Br Ме — COOEt 151.5 — 158 187.5 — 191
5 F Ме — COOEt 167.5 — 169 169.5 — 171
6 С l Ме — COPr 138 — 154
7 С l Ме — COBu 115 — 147
8 C l Ме — СОМе 148 — 159
9 С l Ме — COOP h 127 — 145
135 — 136.5
110-111
10 С) Ме — COP
147 — 149
Н 130 — ) 13 187.5 — 19) 14 Br Me
135 — 136.5
15 Br Me — COPr
16 Br Ме — COBu
17 С l Ме — СООВ
154 — 157.5
140-144
121-125
18 C l Me — СОСНС1
19 С l CF — COOEt
20 С l Ме — COBu
21 С l Ме — СООВ
22 С l Ме — СНО
23 С l Ме — СОС F
)79-18) 57 — 60
М 3 2
М 3 2
М 3 2
М 3
) 79-18) 57-60
М ее
27 включаюших толуол (температура кипения с обратным холодильником ))1 С), ксилол (температура кипения 138 C), пропан- -ол
О 1. (температура кипения с обратным холодильником 82 С) и бутан-1-ол (температура кио пения с обратным холодильником 1!7 С); уксусную кислоту заменили рядом кислотных
11 С l Ме -СОВ 145 — 151
12 С l Ме — COOPr 150 — 185
13 С l Ме — СОСНС1Ме 145 — 147
139-141
94 — 122
115 — 132
105 — 127
197 †1
) 03 — 106
24 Cl Me — СОСН Cl 124 — 126
25 Сl Ме — COCF 115 — 115.5
C) CF -Н 84-99
C) ГГ --COC Н т 137 — 143
3 т
S 1
$ )
М 3 2
М 3 2
М 3 2
М 3 2
М 3 2
М 3 2
М 3 2
M . 3 2
М 3 34
М 3 34
М 3 2
М 3 2
$1
М 3 2
М 3 2!
1!к лолжеиие зеницы л в с
2S C1 CF — СОС Н
М 3 !!
-СНО
N 3 !1 — СООСН снс!.
177 — 179
М 3
31 С! Ме — СООСН
133-135
32 Cl Mc —.СОСН, МС 3 2
33 Сl Ме — СООСН CF> 150 — 170
34 Сl СЕз СООСН С 156 159
179 — 18 !! 20 — 121
179-! 81
57-60
35 С l Me
-СООСН
СЕ СНЕ
164-174
179-181
36 Cl CF
-СООСН
СС1
57 — 60 Ы
1 66 — 168
179 — 181
37 CI CF — СООСН
CF CHF
l 19 — 180
57-60
38 C I CF COOBu
57 — 60
М 3 26
39 Cl CF
40 C l CF
СООМе
179 — 181
57 — 60 — СООСН СН
Cl 148-150
41 С l CF
М 3 !!
Пример
Выход иа последней стадии (%) !
45
90
37
62
47
36
7!
I
Пример .!
29 С! CF
30 Cl Ме! 42-145
130- !34
152-153
157-159
122 !26
141 — 145
1!3 — 1!7
179 — 181
179-181
SA
$А !
120 121 SD 1
S0 1
$Е !
1223842
17!
19
20
41
23
Пример
Пример 1 О ю (ч/мин) 1.ойдо (ч/мин) 24
13
19
20 2
22
45
14
16
28
24
320
36
110
25
30.
6
33
26
10.
43
32
33
29
83
34
35 10
13
31
65
27
16
32
12
40
33
13
34
14
35
37
45 15
40
23
16
29
17
38
50
22
55 . 20
Пример 42. Этот пример характеризует активное действие соединений по изобретению в отношении личинок моли капустной (P1ute11a macu1ipennis).
10 личинок помешают в трубку совместно с кусочком капустного листа, который предварительно погружают в раствор испьпуемого соединения и оставляют до высыхания. Спустя 24 ч добавляют необработанный кусочек капустного листа в качестве пиши и спустя дополнительно 24 ч производят оценку смертности личинок.
Для каждого испытуемого соединения проводили по 2 повторных опыта. Испьпуемые растворы различной концентрации исполь10 зовали таким образом, чтобы можно было вычислить показатель.
Для соединений по примерам 1 — 41 показатель LO» является следующим,