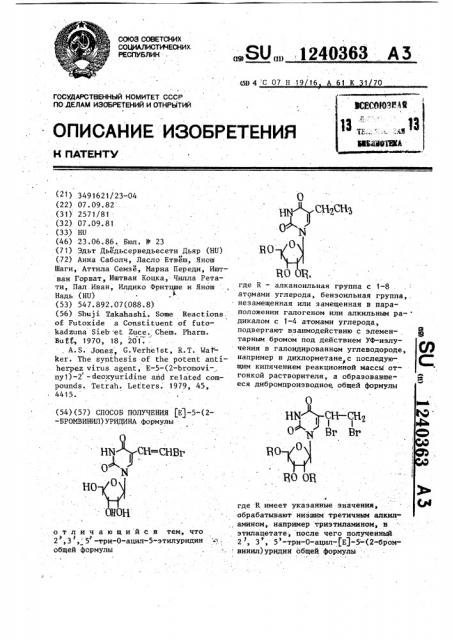
Способ получения ( @ )-5-(2-бромвинил)уридина
Иллюстрации
Показать всеРеферат
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ПАТЕНТЪГ
О сн сн
R0 ОЯ, О
HN сн — kg
0 Br Вг
Н
ЯО
Ro ОЯ
НО
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР пО.делАм изОБРеТений и ОтнРытий (2i) 3491621/23-04 (22) 07.09.82 (31) 2571/81 (32) 07 . 09. 81 (33) HU (46) 23.06.86. Бюл. Ф 23 (71) Эдьт Дьедьсерведьесети Дьяр (HU) (72) Анна Саболч, Ласло Етвеш, Янош
Шаги, Аттила Семзе, Мариа Переди, Иштван Горват, Иштван Коцка, Чилла Ретати, Пал.Иван, Илдико Фритцше и Янош
Надь (НП) (53) 547.892.07(088.8) (56) Shuji Takahashi. Бове Reactions.
of. Futoxide à Constituent of futokadzuna БiеЬ et Zuce. Chem. Pharm.
Ви И 1970, 18, 201 .. . A. S. Jonez, G.Verhe1st, К. Т. Walk err. The synthesis of the potent antiherpez virus agent Е-5-(2-bromovi-, ny1)"2 -deoxyuridine and related compounds. Tetrah. Letters. 1979, 45, 4415. (54) (57) СПОСОБ ПОЛУЧЕНИЯ (Е)-5-(2-БРОМВИНИЛ) УРИДИНА формулы .
ОНОК отличающийся тем, что
2,3, 5 -три-0-ацил-5-этилуридин н с общей формулы,SU„„1240363 А 3.сЮ4 С 07 Н 19 16 А 61 К 1 70 где R — алканоильная группа с 1-8 атомами. углерода, бензоильная группа,. незамещенная или замещенная в параположении галогеном или алкильным ра- дикалом с 1-4 атомами углерода, подвергают взаимодействию с элементарным бромом под действием УФ-излучения в галоидированном углеводороде, например в дихлорметане с последуюУ щим кипячением реакционной массы отгонкой растворителя, а образовавшееся дибромпроизводное, общей формулы где R имеет указанные значения, обрабатывают низшим третичным алкил,. амином, например триэтиламином, в этилацетате, после чего полученный
2, 3, 5 -три-0-ацил-(Е)-5 -(2-бром винил)уридин общей формулы
1240363
R0 си=снвг о „
10
Н0
Изобретение относится к химии нуклеозидов, а именно к способу полу- . .чения нового соединения (Е)-5-(2-бромвинил)уридина формулы
НО OH . 15
Целью изобретения. является разработка способа получения рибонуклеози- . да формулы 1,.обладающего антигерпес-, кой активностью и более низкой токсичностью, чем структурный аналог20
-2 -деэоксинуклеозид )Ej-5-(2-бромвинил)урацила.
Пример 1. 2, 3, 5 -три-О-бензоил-(Е1-5. †(2-бромвинил)уридин (IV,R-бензоил).
56:,О r (0,095 моль) 2, 3,. 5 -три-О-бензоил-5-этилуридина при слабом нагревании. растворяют в 400 мл безводного дихлорметана. Нагревание прекращают. В токе азота и при УФоблучении в течение 20-25 мин к раст-. вору. прибавляют 34,15 .г (11 мл) брома. После .завершения прибавления брома отключают источник УФ-излучения и реакционную смесь 30-40.мин кипятят 35 с обратным холодильником. Затем от-гоняют растворитель и образовавшийся бромистый водород в вакууме. Оставшийся сироп бледно-желтого цвета разбавляют 20 мл безводного дихлорметана 40 и снова выпаривают. Затем остаток растворяют в 200 мл безводного этилацетата, раствор при постоянном geгде R имеет указанные значения, непосредственно или после отделения и растворения в спирте с 1-4 атомами углерода дезацилируют алкоголятом щелочного металла с 1-4 атомами углерода. ремешивании обрабатывают 15 мл при-. бавляемого rio каплям триэтиламына, отфильтровывают выделившийся гидро.бромид триэтиламина и фильтр промывают 2 х 20 мл этилацетата. Фильтрат объединяют с промывными водами и. выпаривают под разряжением. В качестве остатка от выпаривания получают
63,0 г жесткой пены.. Выход 100Х. После затирания с этиловым спиртом получают.белые кристаллы, плавящиеся при 160-170 С. Процукт, если жела-тельно, можно деацилировать непосред-, ственно.
2, 3, 5 -три-О-бензоил-5-зтил> т, у» уридин, используемый в качестве исходного, может быть получен следующим образом: а) 2,4-бис-(О-триметилсилил)-5-.. -этилурацил.
К 40 г (0,285.моль) предварительно высушенного под разряжением при о
150 С этилурацила прибавляют 80.мл ,(0,5 моль) 1, 1, 1 3,3,3-гексаметилдисилазана.
Реакционную смесь кипятят с обратным.холодильником в течение 24 ч в отсутствии влаги. Полученный прозрач- . ный раствор выпаривают при атмосферном давлении. В качестве остатка от выпаривания получают густой сироп, который подвергают перегонке под разряжением., Выход 78,95 r (97X)..
Т.кип. 134"С (1733 Па). в) 1-0-ацетил-2,3,5-три-О-бензоил-Д-рибоза
60 г (0,4 моль) Д-рибоэы растворяют в 1280 мл абсолютного метанола.
К раствору прибавляют 34 мл 11,2Х-ного метанольного раствора соляной кислоты. Реакционную смесь выдерживают
24 ч при 20 С в условиях, исключаюE щих попадание влаги. Затем смесь ней.Пример
Продукт и
2,3, 5 -три-О-ацетил- $E)-5-(2-бромь у ь винил) уридин
Т. пл, 145,50С
2, 3, 5 -три-О-(р-хлорбензоил) — (Р)-
-5- (2-бромвинил) —.уридин пл. 187 188оC.
2,3,5 -три-0-октаноил- (Ej-5-(2y > 7 . -бромвинил)уридин
Т.кия. 98-1.05 С (133,3 Па) 2 ., 3,5 -три-О-(п-метилбензоил)-5т э (2-бромвинил}уридин
Т.кип. 209 С
1240 трализуют 120 мл пиридина и выпаривают в вакууме .при 30- 40 С.
Остаток обрабатывают еще 120 мл пирндина и опять выпаривают. Полученный вязкий сироп слабо-желтого цвета . растворяют в смеси 304 мл пиридина и 320 мл хлороформа. Смесь при охлаждении льдом обрабатывают 233,8 мл свежеперегнанного бензоилхлорида и зазатем оставляют на ночь в холодильни-1О
- ке.На другой день смесь выливают на лед и разлагают таким образом избыточный хлористый бензоил. Затем pasделяют фазы. Водную фазу экстрагируют
2х160 мл хлороформа, хлороформенные
-, вытяжки объединяют., промывают 200 мл воды, высушивают над безводным сульфатом натрия и выпаривают при 30—
40 С в вакууме. Прибавляют 100 мл толуола и снова выпаривают. После уда.ления следов растворйтеля получают масло красного цвета. Его растворяют смесью 96 мл ледяной уксусной кислоты и 224 мл уксусного ангйдрида, раствор при интенсивном перемешивании и охлаждении льдом медленно (в течение
2-3 ч) обрабатывают 32 мл,95 97Х-ной серной кислоты и затем на ночь оставляют в холодильнике. На следующий день смесь выливают на лед, и от выИсходные продукты для примеров 25 получены путем, описанным в примере 1.
П р и,м е р 6. Е1 -5-(2-бромвинил)уридин (1)
К 65 5 г (О 11 иоль) 2, 3, 5 три-0;б ен з оил- )E) -5- (2-бромвинил) уридина -,неочищенный продукт примера 1) прибавляют 250 мп 0,5 н..метилата натрия и 250 мл абсолютного метанола. ,; Реакционную смесь перемешивают 3 ч
363 4 делившихся кристаллов отделяют декантацией воду. Кристаллы перемешивают с 500 мл воды, жидкость снова декан тируют, затем снова перемешивают с
200 мл 50-80Х-ного метанола. и затем фильтруют. Неочищенный продукт -пере-. кристаллизовывают из 2,5 л метанола., Получают 128,5. г (60%) продукта, ко- торый Ä 13 1 С. о с) 2,3,5 - три-0-бензоил-5-этил .
Ф уридин
48,1 r (0,095 моль) 1-О-ацетил-2,3,5-три-О-бензоил -ц-рибозы раст- воряют в 1690 мл дихлорметана. Раствор при перемешивании обрабатывают
33, 7 г (0,1 18 моль) 2, 4-бис-(О-триметилсилил)-5-этилурацила и 14 мл хлорного олова (IU) в 110 мл дихлорметана.
Реакционную смесь перемешивают 2-3 ч и затем выдерживают 24 ч при 20 C. о
Затем смесь .встряхивают с 2300 мл насыщенного водного раствора бикарбоната калия. Органический слой отцеляют, высушивают и выпаривают под раэряжением. Белый кристаллический остаток перекристаллизовывают из 250 мл этанола. Выход 53,5 г (95X). T. пл. 155
156 С.
Продукты,.полученные « примерам . 5,представлены в табл.1.
Таблица .1 при: 20 С. Если. осадок выделяется, его отфильтровывают, рН прозрачного раствора устанавливают равным 5"6 при, помощи;ионообменной смолы Domex 50Н затем смолу отделяют фипьтрацией и;,-, промывают 2z100 мл метанола. Фильт" рат и промывные воды объединяют и затем выпаривают под разряжением.
Остаток обрабатывают этанолом и бенэолом. После, затирания остатка с эфи... ром получают 33 ч. неочищенного про1240363
Таблица3!
Соединение формулы
Штаммы вирусов
++++ .О 0
8,9
С СН(ОСН )СН Br
4,45
3,44 45
3,72
С СН(ОСН ) СН Н Br
С СН(ОСН )СН Н Br
Соединение общеи ом.лы 1
Контроль
1og TC/D (0,1 мл) 7, 5,8
С Н
3,26 осн
3,23
6,0
2,77
2,5
3.33
5,83
5 75
3,25
2,5
6,0
3,0
3,0
I дукта, который перекристаллизовывают из воды и затеМ из этанола, Выход
28 г (71,7%). Т. пл. 165-167 С.
Пример 7, Подтверждение об разования 5-(1,2-дибромэтил).-2,3
5 -три-О-(и-хлорбензоил)уридина как промежуточного продукта в процессе с! бромирования 2,3,:5 -три-0-(-хлорбензоил)-5-этилуридина.
2,3, 5 -три-О-(ч-хлорбензоил)— †.5-этилурйдин бромируют как описано в примере 1, после окончания реакции растворитель упаривают, к оставшемуся . с.. 15 сиропообразному .продукту прибавляют безводный:метиловй спирт. Реакционную смесь выдерживают в течение 10-15 мин .при комнатной температуре, метанол упаривают в вакууме при комнатной темI. >20 пературе.Остаток хроматографируют на колонке, заполненной селикагелем 60 (размер частиц 70-350 мкм,диаметр ко-лонки 2 см, высота загрузки 50 см, элюент -хлороформ), Полученный после упаривания хлоро-. форма остаток подвергали ЯМР-исследо ваниям, Спектр ЯМР снимают на спектрофотометре типа Varian Х - 100-VFT, частота 100, 1 Мгц, в .качестве раст-. ворителя используют дейтерохлороформ, 3О
, в качестве внутреннего стандарта— тетраметилсилан.
Результаты ЯИР-спектрометрирования приведены в табл . 2.
Таблица 2 35
Полученные данные однозначно под.тверждают, что в результате реакции с метанолом образуется 5- ((1-метокси -2-бром)этил)-2 .,3,5"-три-О-(й-хлор- 55 бензоил)уридин. Данное соединение мо" жет .образоваться лишь в том случае, агда атом брома в положении. этильно" го радикала 5-(1,2-дибромэтил)-2,3!, 5 -три-о-(п-хлорбензоил)уридина, образовавшегося при бромировании, заме".: няется при обработке метанолом на метоксильную группу.
Представленные данные однозначно доказывают, что при бромировании производных 5-этилуридина в условиях примера 1 образуется промежуточный продукт — производное 5-(1,2-дибром .этил)уридина., Активируемую активность соединения формулы I оценивают следующим образом: вначале определяют концентрацию вещества в жидкости культуры ткани, не вызывающую повреждение клеток, которое может быть замечено илй измерено.
Эту концентрацию обозначают СТО. Соединение является вырусоспецифичным, т.е. пригодно для лечения,в том случае, если оно в концентрации.СТд ил еще меньшей уже .тормозит размножение вирусов в ткани.
Эффективность действия соединения общей формулы 1 против вирусов показана в табл.1 и.2.
Действие аналогов нуклеозида на размножение вирусов в культурах клеток при СТо концентрациях приведено в табл.1.
Herpes Adeno Rube- Inf1ua) simp1 о1а enza4
Тормозящее действие соединения формулы 1 на размножение вирусов приведено в табл.2 !..
Та блица 4
1og ТС/П,, d1og ТС/П„ (0,1 мл) . (0,1 мл) 1240363. $E) 5 (2 бромвинил)уридин отлича ется от известных антивирусных нуклеозидов тем, что цитотоксическое дей", 5 ствие его на культуру ткани относи" тельно невелико. табл,4
2,5
3,0
2,33
3,16
3,0
3, 17
5,66 6, 0
5,5
Средние значения
2,66
3,16
5 82
Соединение, фор мулы
27 21 26 20
Та блица 6
Соотношение умерших (обработанных). Соединение формулы 1
Вид применения Доза, г/кг
Внутривенно
300
О/5
Внутрибрюшинно1000
4/5
0/5
750
500 О/5
Орально 1000
О/5
1500
О/5
+ »
Исследование токсичности х.U. ограничено из-sa растворимости в .воде. соединения. фМ
Водные суспензия соединения,.приготовленные с папиоксиэтиленсорбитол-монолеатом (Tween 80) и карбоксиметилцеллюлозой.
2,6 2,0 2,7
Ф
Ф
Для эксперимента с Herpes 31шр1ех -25
ТууХ в Heha-культуре клеток для (EJ-5-(2-бромвин@п)-уридина получено соотношение между лечебной и вредной дозой лекарства: 10 63, из величины, показывающей 50Х-ное подавляю- 30 щее действие по.. отношению к . контролю.
Значения концентрации 50Х-ной цито-. токсичности (СТ ) и нетоксичной кон- .
50 центрации (СТо) соединения формулы 1, определенные на различных культурах клеток, выраженные в 1og рj./ìë, приведены в табл. 5. . Таблица 5
Незначительная токсичность для ткани fEj-.5-(2-бромвинил)-уридина также подтверждается опытами, проведенными на мышах ля определЕния острой токсичности (LD ) ° ю
Острая токсичность на мышах (раст- воритель:вода, содержащая20Х димети11-. формамидачерез 24ч приведена.в табл.б.
1240363
Составитель И.Корсакова техред В-К дар Корректор M.самборская
Редактор В.Иванова
Заказ 3416/60 Тираж 343 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, r.Óæãîðîä, ул.Проектная,4 .
Лекарственные препараты, приготовленные известным путем с fE) 5-(2-бромвинил)-уридином в качестве биологически активного вещества, типа растворов для инъекций, мазей, таблеток и т.д., могут применяться,, против заболеваний, вызываемых Нег рез 51мр8ех тип 1, не только ло5 кально, но .и стстематичесКи,в