Способ получения 2-замещенных 4-амино-6,7- диметоксихинолинов или их фармацевтически приемлемых солей
Иллюстрации
Показать всеРеферат
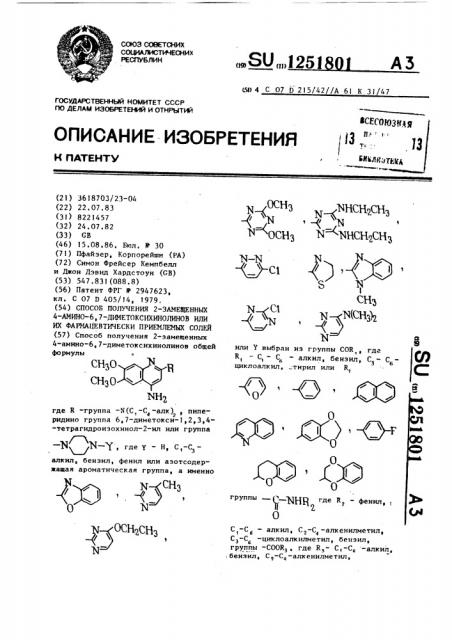
Способ получения 2-заме1ценных А-амино-6,7-диметоксихинолинов общей формулы° CHjOv V VR СНзО 1SH2 .НСН,СНз 3 - - Т НСН2СНз -N-N « или Y выбран из группы COR,, где R, - С, - Cg - алкил, бензил, С - циклоалкил, тирил или R -Л) 0/ где R -группа -N() , пиперидино группа 6,7-диметокси-1,2,3,4- -тетрагидроизохинол-2-нл или группа . где у - Н, С,-Сзалкил , бензил, фенил или азотсодержащая ароматическая группа, а именно .чЗ N о 0 группы - с-TSIHFI Д« R - фенил, , О - алкил, Cj-C -алкенилметил, Cj-C -циклоалкилметил, бензил, группы -COORj, где Я,- -алкил, .бензил, С,-С;,-алкенилметил, см
СОЮЗ СОЕЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
„SU „„125) СЕСОЮЩ у
ОПИСАНИЕ ИЗОБРЕТЕНИЯ иЬД1)„д )(д
К ПАТЕНТУ
N — 1Я ñ>
0 X
Ж
СН3 ксн, /
СНЗО
ЬН2
/ X F
ОСН2СНЗ
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3618703/23-04 (22) 22.07.83 (31) 8221457 (32) 24.07.82 (33) GB (46) 15.08.86. Бюл, 1)- 30 (71) Пфайзер, Корпорейшн (РА) (72) Симон Фрейсер Кемпбелл и Д кон Дэвид Хардстоун (GB) (53) 547.831 (088.8) (56) Патент ФРГ 11 2947623, кл. С 07 D 405/14, 1979. (54) СПОСОБ ПОЛУЧЕНИЯ 2-ЗАИЕЩЕННЫХ
4-АИИНО-6,7-ДИИЕТОКСИХИНОЛИНОВ ИЛИ
ИХ ФАРИАЦЕВТИЧЕСКИ ПРИЕИЛЕИЫХ СОЛЕЙ (57) Способ получения 2-замещенных
4-амико-6,7-диметоксихинолинов общей формулы о
СИР R где R -группа -N(C, — Ñ -алк), пипе-. ридино группа 6,7-диметокси-1,2,3,4-тетрагидроиэохинол-2-ил или группа
N N — f где Y — Н, С,-С—
Г алкил, бенэил, фенил или азотсодермащая ароматическая группа, а именно (51) 4 С 07 D 215/42//А 61 К 31 47 <ОС% НСН2СН, -< н С"
1 оснз м жнсн,сн, или У выбран из группы CQR, где
R — С вЂ” С вЂ” алкил бенэил С - С6 3 цикл оалк ил, тирил или R г р уппы — яя ц где Š— фенил, 1) 2
С -С вЂ” алкил С -С -алкенилметил, 1 6 2
С -С -циклоалкилметил, бенэил, 3 6 группы -C00R, где К, — С,-С, -алкил,,бензил, С -С -алкенилметил, !
251801
) г я сн
СИ
М(СН )
С1
N сно
10 где R — группа -N(C -С алк)2, пипери дино, группа Ь, 7 — диметокси— 1 2
3,4-тетрагидроиэохинол-2-ил или
Г, Г1 группа
20 группы С - где R — фения, 2.
О
С вЂ” С -алкил С -С -алкенилметил, 1 6 2 4
30 6
С -С -циклоалкилметил, бенэил, группы — СООКз, где R — С,-C. алкил, бензил, С вЂ” С вЂ” алкенилметил, или их фармацевтически приемлемых солей, о т л и ч а ю.шийся тем, что соединение формулы
Ф
Изобретение относится к способу получения новых 2 — замешенных 4-амино-6,7-диметоксихинолинов общей формулы сио R где Y — Н, С, -С -алкил, бенэил, фенил или азотсодержащая ароматическая группа, а именно сн, 0
om,ж ОС 4
gi N ос 3 .ЪНСН СН н
N — нсн,си м
СН3 где R имеет указанные значения, подвергают взаимодействию с ЕпС1 нли литийдиизопропиламидом и далее, если необходимо, полученное соединение обрабатывают водородом в присутствии Pd/Ñ с последующим выделением целевого продукта в свободном виде или в виде фармацевтически приемлемых солей, или Y выбран иэ группы:
COR „, где R1 — С1 -Са - алкил, бенэил С -С вЂ” циклоалкил, стирил или, В
9 3 6
Г i,, /1
А3 ХО или их фармацевтически приемлемых солей, обладающих противогипертоническими свойствами, / 1 -СБН, сн>о снбо
NH> сн,о с 3 ън, Таблица 1
Пример
Вьщеленная форма, т.пл., С н и
58,9
6,9
НС1
139 l
272-275 (59,3)
НС1; 1/2 Н 0 53 8
285-288 . (53,3) (6, 9) (13,0) 6 3
14,6 (6, 5) (14, 4) 2НС1 . l/2 Н 0 47,8 6,0
l5 l
260
3 12
Цель изобретения — получение новых соединений, обладающих ценными свойствами.
Изобретение иллюстрируется следующими примерами.
Пример I. снз 1 % c6HsMA
СНЗО
СН
N-1 (- (4-фенилпиперазин-1-ил) этилиден)-2-циано-4, 5-диметоксианилин (2,5 г) в тетрагидрофуране (35 мл) добавляли к перемешиваемому раствору литийдиизопропиламида (из Н -бутиллития 1.3М в гексане и диизопропиламина (1,44 мл) в тетрагидрофуране (5 мл) при 70 С. Полученный в результате раствор перемешивали при — 70 r в течение 4 ч, затем оставляли на ночь. Смесь выливали в ледяную воду (100 мл), экстрагировали хлороформом (Зх200 мл), объединенные экстракты б
51801 4 промывали водой, суп или (Na SO„ ) и упаривали в вакууме. Остаток растворяли в смеси хлороформа и метанола, обрабатывали эфирным раствором хлористого водорода и перекристаллизовывали из метанола, Получали 4-амино-6,7-диметокси-2(4-фенилпиперазин-1-ил1— хинолин в виде полугидрата дигидрохлорида (0,82 г), т,пл. 288-290"С.
1О Найдено,Ж: С 56,,9; h 6,0; N !2,7.
С 1Н „N 0 2НС1, I /2Н,О
Вычислено, 7: С 56,5; Н 6,1;
N 12,6.
Пример ы,2-4. Следующие coef5 динения приготавливали аналогично примеру 1, используя соответствующее замеШенное этилиденовое соединение, эа исключением того, что в примере 3 реакция завершалась при подогреве на паровой бане. В примерах 2 и 4 про- дукт очищали путем хроматографии на колонке.
Результаты приведены в табл.l.
Анализ, Х (в скобках теоретический) (47,5) (6,4) (14,8) 1251801
Пример 5
СН О > p гЫСН2СбН5 Х ПС1
Н ll MA сн,с,н, сн,о
mqo
25 снЮ
С11 С СН3
CN CM, сн, Х-У
N-1 f(4-Г>ензилпипераэин-1-ил) этилиден)2-циано-4,5-диметоксианилин (13,5 г) и хлористый цинк (4,86 г) в диметилацетамиде (90 мл) перемешивали при нагревании с обратным холо-1 дильником в течение 2,5 ч, затем соответственно через 0,5 ч и 1,5 ч добавляли дополнительно хлористый цинк (0,5, 0,2 г). Смесь охлаждали, обрабатывали простым эфиром (700 мл, 2х100 мл ) и верхний слой каждый раз отделяли. Остаточный деготь затем обра1
Гатывали раствором гидроокиси натрия (2 н. 100 мл) и метиленхлоридом (1 00 мл) и смесь перемешивали при комнатной температуре в течение 5 мин, Органический слой отделяли, водную фазу зкстрагировали метиленхлоридом, и общие органические экстракты промывали водой, Высушенные сульфатом натрия экстракты упаривали в вакууме и коричневый остаток (примерно 13 г) очищали с помощью хроматографии на силикагеле (Иерк 9385, 250 г) с элюированием смесью хлороформа и метанола (100:088:12), Образец чистого продукта (6,95 г) растворяли в этаноле, обрабатывали эфирным раствором хлористого водорода и упаривали в вакууме. Остаток перекристаллиэовывали иэ метанола, Получали сесквигидрат дигидрохлорида 4-амино-6,7-диметокси-2(4-бензилпиперазин-1 èë)-хинолина, т.пл. 260-263 С, Найдено, Ж: С 54,9; Н 5,9; N 11,5.
С,, Н К О 2НС1. 1,5Н О
Вычислено, 7.: С 55,2; Н 6,5;
Н 1197.
Пример 6. 4-Амино-6,7-диметокси-2- (6,7-диметокси-l,2,3,4-тетрагидроизохинол-2-ил)хинолин, т.пл,226-227 С, приготавливали по примеру 5 с использованием соответствующего !†(6,7-диметокси-1,2,3,4-тетрагидроизохинол-2-ил!зтилиденового соединения эа исключением того, что продукт перекристаллизовывали иэ иэопропанола.
Найдено, 7: С 66,0; Н 6 3;
N 10,9.
Cq H N 04
Вычислено, Е: С 66,8; Н 6,4;
N l0,6.
Пример ы 7-37. Следующие
40 соединения могут быть получены ана,логично примеру 1 или 5, исходя иэ соответствующего соединения формулы (см,табл,2), 1251801
Таблица 2
Пример
56,7
13,5
5,5 (5„6) (13, 2) (56,7) I/2 гидрат 60,2 5,7 12,7 гидрохлорида
301 (60,3) (6,0) (12,8) 14,1
6,5
НС1 . 1,4 Н 0 52)1 (6,7) (14,2) 215-220 (51,8) НС1
292
11
12,0
6,0
61,8 (12,1) (6, 1) (62, 1) НС1.0,5 Н О 64,3 5,8 11,6 г
II
>300
НС1. 1,5 Н О 59,3 5,4 13,9 г
238-239 (59,2) (5,8), (13,8) 13
5,4 11,6
57,2
l2 3
58,5
5,7
Г) г
НС1
15 (5,4) (12,5) (59, 1) 274
II
СН3
ll
О.
Ж
С
II
Вьделенная форма и т . нл., С
1/4 Гидрат гидрохлор»да
270
НС1 0)5 Н О
240-241
НС1.0,5
300-301
Аналиэ ) 7. (в скобках теоретический) !
С 1 kl i N
59,8 7,0 13,5 (59) 9) (6) 9) (13 ° 3) (64, 0) (5,8) (1 1, 5) (57,3) (5,4) (11,6) 1251801
Продол:кение табл. 2
1При" мер н ) II,2
5,9
59,6
16 (1 1,1) (6, 2) (59,7) I 1,0
5,4
57,7
НС1. Н 0
17 (11) 1) (5,8) (57)1) 201
55,1
2НС1 (55, О) 235
С NH-СИ СН2 3 НС1 1 5 Н 0
200
54,0
6,8
16,7
19 (54,5) (7, О) (l6,7) 2о ) NH — CHgCgH>
О
269-270
59,8 (60,3) 21 — CN H— - СН (:Н= СН2 Нр 0
II
178-181
58,3
6,7
17,8 (58,6) (7,0) (l8,0) НС1.0,5 Н 0 55,6 6,5
16,4
220-223 (55,7) (6,8) (16,3) 23
НС1.2 Н 0
27I
5,8 17,2
51,7
ЧНС И5
С
И
ОсН сн
2) (N
Вьделенная форма н т.пл., С
HC1. H 0
251-252
НС1.2 Н 0
267-?69 налиэ, 7. (в скобках теоретический) 5,7 14,7 (5, 7) (14,6) 6,1 14,9 (6, 2) (15, 3) 55 6 5)5 14)2 (55,3) (5,9) (14,7) (52,2) (6,5) (17,4) 12
1251801. Продолжение табЛ.2
Пример с (н ) в
2НС1. I 5 Н 0 45,2
5,1 18,5
266-268
2НС1.,1,5 Н 0 47,8 6,2 22,5
247-248 (47,7) (6,6) (22,8) Н 0
262-266 dec (54,5) (5,5) (20,1) 15,8
5,2
49,2
2НС1
29 (5, 2) (15,8) (48, 7) 244-247
5,5 14,8
50 3
5,5
20,2
55,2
3l (20,5) (55,7) (5,4) Мсн 1g г
5,8 18,9
48,4
6,2 !2,7
54,8
gi )(S
С 3 — СОО-СН С
I си
Вьделеиная форма и т.пн., С
HCl СН ОН
282-283
2НС1 3 НО
245-252
0,5 H 0
245-247
2НС1,2 Н 0
260-263
HCl,Í 0
244-245
Анализ, А (в скобках теоретический) (45,5) (5,7) (18,6)
54,3 5,2 19,9
51,7 6,1 17,8 (52,0) (6,2) (17,3) (50,6) (6,3) (15,4) (48)7) (6,4) (18,9) (54,5) (6,6) (12, 7) 14
1251801
Продолжение табл. 2
Выделенная форма и т.лл., С
Пример
Анализ, Х (в скобках теоретический) с н и — СОΠ— СН2СН
НС1,0 5 Н.,О 53 5 6,3 13 8
278-279 (53,3) (6)5) (13,8) 35 СОО Г нс1
56,9 5,2 12,1 (57,1) (5,2) (12,1) 285
36 СОО Д 1 нс1,1,5 н,о 57,2 5,8
204-206 (56,8) (6,2) (разложение) l2 О (11,5) 37 -соо-сН сн(сн,) НС1.1,5 Н,О 52,8 6,9 (93, 2) (7, 1) (12, 4) 254-256
Пример 38 °
СиэО си,о
NH2
2 Ь сн,о
50
4-Амино-6, 7-диметокси-2- (4-бенэилпиперазин-1-ил)хинолин (6,2 г) в зтаноле (300 мл) с катализатором палладий на угле (Pd/С) перемешивали при 50 С в атмосфере водорода (50 фунт. на кв.дюйм
3,515 кг/см ) в течение 20 ч. Смесь .охлаждали, добавляли хлороформ (!00 мл), при этом раствор фильтровали через "Солкафлок". Твердое вещество промывали смесью хлороформа и метанола (1:I, 4х!00 мл) и объединенные фильтрат упаривали в вакууме. Остаток распределялся между хлороформнатрийкарбонатным раствором (I 0X) органический слой удаляли, водную фазу насьицали солью и далее экстрагировали хлороформом. Объединенные органические экстракты промывали солевым раствором, сушили сульфатом натрия и упаривали, Получали
4-амино-6,7-диметокси-2-(пиперазин-I-ил)хинолин (2,42 г). Спектроскопия показала, что полученный продукт аналогичен продукту по примеру 4.
Испытания на противогипертони ческую активность.
1251801
19
25
Не испытьг вали
15 12
lO
14
13
16
25
19
20
Таблица 3
21
22
Соединение согласно примеру
Снижение кровяного давления, Е
35 32
23
lO
l3
22
26
45
19
25
21
Не испытывали
50 30
31
l5
24
l3
12
Были применены группы иэ пяти крыс-самцов Okamoto со спонтанной гипертонией, систолитическим кровяным давлением более 200 мм рт.ст. (по сравнению с 130 мм рт.ст ° у нормальных крыс), Кровяное давление измеряли посредством манжеты для нагнетания, надеваемой на хвост животного, и преобразователя переменной емкости для определения пульса систолитического давления, животных помещали в нагретый ящик при 33 С в
У течение 20-30 мин перед измерением кровяного давления с целью облегчения точного определения пульса. После контрольной регистрации кровяного давления и сердечного ритма животным давали орально испытуемые соединения в дозах 3 мг/кг и определяли кровяное давление через 1,5 и через 4 ч после приема испытуемого соединения. Результаты выражены в виде максимального зарегистриро" ванного падения кровяного давления в процентах от среднего кровяного давления у пяти крыс до получения испытуемого соединения.
Результаты приведены в табл.3, Продолжение табл..3 (2
) 25180I!
Продолжение табл.3.
Продолжение табл.3
34
13
I0
1О 36
Доксаэосин
37
Праэосин
33
Составитель H. Подхалюэина
Техред Л. Сердюкова . Корректор М. Самборская
i åäàêтор М. Недолуженко
Тираж 379 Подписное
ВНИИПИ Государственного комитета СССР по делам иэобретений и открытий
113035, Москва, Ж-35, Раушская наб., д.4/5
Закаэ 4429/60
Производственно-полиграфическое предприятие, r. Ужгород, ул. Проектная, 4