Способ оценки активаторного действия стрептокиназы на фибринолитическую систему
Иллюстрации
Показать всеРеферат
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК (5g 4 С 12 0 9/40, G 01 N 33/86
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPCHOMV СВИДЕТЕЛЬСТВУ (54) (57) СПОСОБ ОЦЕНКИ АКТИВАТОРНОГО
ДЕЙСТВИЯ СТРЕПТОКИНАЗЫ НА ФИБРИНОЛИТИЧЕСКУЮ СИСТЕМУ путем получения оксалатной плазмы, инкубации и последующей колориметрии, о т л и ч а— ю шийся тем, что, с целью повышения точности и упрощения способа, в плазму добавляют раствор хлористого кальция, а расчет ведут по.кинетике светорассеяния. б,бд
f 2 . 3
4 8 Я 7
У т/у мин
Фиа 1
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3750751/28-14 (22) 06.06.84 (46) 15.09.86. Бюл. И 34 (71) Белорусский ордена Трудового
Красного Знамени научно-исследовательский институт эпидемиологии и микробиологии (72) В.Н.Никандров и С.Г.Цыманович (53) 615.355:577.152.344.07(088.8) (56) Методы исследования фибринолитической системы крови. М.: МГУ, 1981, с.36-39.
Детские капельные инфекции. Л., 1953, с.47-59.
„„SU„„1257088 А 1
1 257088
Изобретение относится к прикладной биохимии и может быть использовано для оценки специфического действия тромболитических препаратов при их экспериментальном изучении на биологических моделях.
Целью изобретения является повышение точности и упрощение способа.
Способ осуществляется следующим образом.
Пример 1. Кролику однократно внутривенно вводят стрептокиназу (авелизин) в дозе 60 тыс. ед./кг.
Через 30 мин после введения у кролика берут крово получают оксалатную плазму. Затем в кювету фотоэлектроколориметра, снабженного термостатирующим устройством, вносят 0,7 мл
0,025 И раствора хлористого кальция и 0,7 мл аксалатной плазмы. Измеряют через каждые 30 с изменения светорассеяния при длине волны 360-400 нм, температуре 37,0 + 0,2 С против смеси
0,7 мл физиологического раствора хлористого натрия и 0,7 мл оксалатной плазмы.
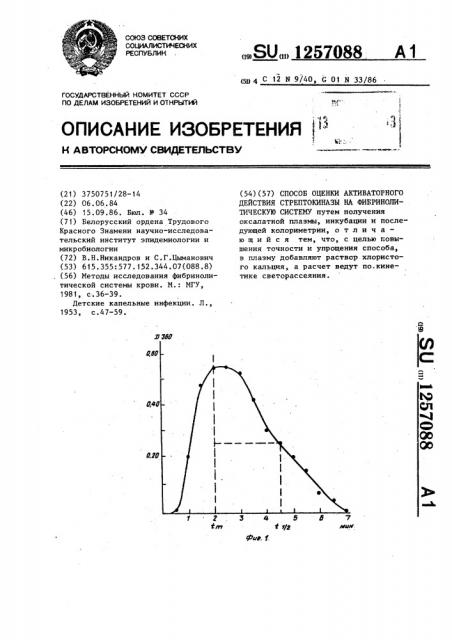
Как видно из фиг.1, светорассеяние увеличивается при образовании фибринового геля и достигает своей максимальной величины 0,560 в промежуток времени (с ), равный 2 мин., Затем происходит уменьшение светорассеяния геля до полного исчезновения рассеивающего эффекта в связи с разрушением гелевой структуры. Исходя из представленной на фиг.1 кинетики светорассеяния, отражающей образование и разрушение фибринового геля, определяют время достюкения полоьины максимальной величины светорассеяния, отражающее полупревращение сгустка ("., ) и равное 4,5 мин. Далее определяют разность между t(l2 и -щв.кото рая составляет 2,5 мин. Эта величина является оценкой действия стрептокиназы в организме, учитывающей как активацию фибринолиза, так и ее взаимодействие с уровнем ингибиторов.
Преобразование (в ) убыпи сгустка, определяемого также по мутности среды, осуществляют следующим образом (фиг.2).
За 100Х (т.е. полный сгусток) принимают максимальную мутность сгустка, т.е. оптическую плотность 0,560. Эта величина максимальной мутности достигается к 2 мин. Замеряют мутность сгустка еще 2 мин, т.е. всего через
5
4 мин. Значение мутности среды в это время составляет 0,300, или 547 от исходного (т.е. от 100X). Таким образом, доля растворенного геля составляет 467 — величина, являющаяся оценкой активаторного действия данной дозы стрептокиназы через
30 мин после введения в организм.
П р и M e p 2. Кроликам однократно внутривенно вводят стрептокиназу в дозах 30 и 60 тыс, ед./кг. До введения и через 10, 30, 60 и 120 мин после введения у животных берут кровь для получения оксалатной плазмы.
Оценку действия стрептокиназы проводят, как описано в примере 1. Образцы плазмы до и через 10, 30, 60 и
120 мин исследуют раздельно. Предлагаемый способ сопоставлялся с известным способом оценки, основанным на определении процента убыли содержания фибриногена колориметрическим методом Лазара.
Результаты испытаний сведены в табл. 1.
Как видно из табл. 1, по предлагаемому способу, так же как и по известному, выявляется динамика фибринолиза, зависящая от дозы стрептокиназы и времени после ее введения.
Как видно из табл. 1 и кривых I
4 на фиг.3 зависимости фибринолитического потенциала плазмы крови от времени после введения стрептокиназы в дозах 30 тыс. ед./кг (кривая 3), 60 тыс. ед./кг (кривые 2,4), по ,предлагаемому способу (кривые 3,4) так же, как и по известному (кривые
1,2) выявляется динамика фибринолиза, зависящая от дозы стрептокиназы и времени после ее введения. Однако данный способ позволяет это сделать нетрудоемко и быстро (в расчете на .
1 пробу за 10-20 мин вместо 1-2 сут).
Пример 3. При,моделировании состояния гиперфибринолиза на живот" ных необходимо поддержание высокой фибринолитической активности плазмы крови у лабораторных животных.
Образец стрептокиназы неизвестной активности (предположительно
600 тыс.ед./мл) вводят кролику неоднократно предположительно в дозе
60 тыс. ед./кг. По предлагаемому способу аналогично примеру 2. выявлена динамика фибринолиза плазмы крови. Результаты определения по заявляемому способу фибринолитической актив7088 4 тельном введении необходимого количества стрептокиназы.
Данный способ позволяет на такой
125 модели экспрессно определить состояние фибринолиза и скорректировать его, что невозможно по известному способу.
Кроме того, предлагаемый способ позволяет избежать изолирования иэ плазмы крови отдельных фракций, т.е. дает возможность оценивать многостороннюю характеристику не только состояния фибринолиза, но и его ингибиторов, не разделяя плазму крови искусственно на компоненты.
Та блица 1
Стрептокиназа (60 тыс.ед./кг) Стрептокиназа (30 тыс.ед./кг) Фибринолитический потенциал плазмы крови, 7
До введения
Через мин после введения
До введения
Через мин после введения
10 30 60 120
10 30 60 120
По известному способу (Лазара) 5 45 69 . 55 54
23 21 15 3
По предлагаемому способу
2 50 59 34 29
33 20 8 6
Через мин после введения
4,5 5,0 5,5 9,0
Таблица 2
Время после введения, мин
i 0 30 60 120
До введения со
Фибринолитическая активность
4,0 5,1 5 8 11,0
3 ности плазмы крови кролика после введения стрептокиназы в дозе предположительно 60 тыс. ед,/кг представлены в табл.2.
Выявленные изменения были характерны для дозы стрептокиназы
30 тыс.ед./кг, т.е. активность образца соответствовала 300 тыс.ед./мл.
Исследуемая активность была подтверждена контрольным определением по методу in Vitro и составила
300 тыс.ед./мл.
На основании полученных результатов принимается решение о дополни1
3,5 2,5 3,5 5,0
1 257088 б0 мин
zo
ro so
Составитель Л.Шилина
Редактор H. Швыдкая Техред M. Ходанич Корректор M,11аксимишинец
Заказ 4882/20 Тираж 490 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Иосква, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г.ужгород, ул.Проектная, 4