Способ получения сложных эфиров 1,1-диоксид-2 @ -метилпенам- 2 @ ,3 @ -дикарбоновой кислоты
Иллюстрации
Показать всеРеферат
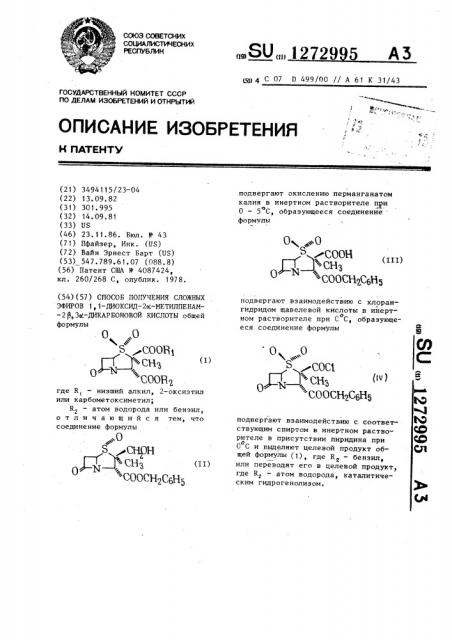
СПОСОБ ПОЛУЧЕНИЯ СЛ ЭФИРОВ 1,1-ДИОКСИД-2о -МЕТИЛП -2|,Зо6-ДИКАРБОНОВОЙ КИСЛОТЫ формулы Ч/ S COORi П CH-j N-Ч COOR2 где R, - низший алкил, 2-окс или карбометоксиметил; Rg - атом водорода или б отличающийся тем соединение формулы . -О O N-«. СООСН2СбН подвергают окислению перманганатом калия в инертном растворителе при О - , образующееся соединение ормулы Оч..0 Д.. .f .- ff , СООСН СбНз подвергают взаимодействию с хлорангидридом щавелевой кислоты в инертном растворителе при С С, образующееся соединение формулы vS- COCl . СООСН2СбН5 подвергают взаимодействию с соответствующим спиртом в инертном растворителе в присутствии пиридина при О С и вьзделяют целевой продукт общей формулы
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
PECrlySilHH
OllHCAHHE ИЗОБРЕТЕНИЯ
К ПАТЕНТУ (III) (pf
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
110 ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3494115/23-04 (22) 13.09.82 (31) 301. 995 (32) 14. 09. 81 (33) US (46) 23. 11. 86. Бюл. К 43 (71) Пфайзер, Инк. (US) (72) Вайн Эрнест Барт (US) (53) 547.789.61.07 (088.8) (56) Патент CIIIA Ф 4087424, кл. 260/268 С, опублик. 1978. (54) (57) СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЪ|Х
ЭФИРОВ t, 1-ДИОКСИД-2о -МЕТИЛПЕНАМ-2 P,Ço!-ДИКАРБОНОВОЙ КИСЛОТЫ общей формулы
О „0
s AC0081
Ф Сн
"СООБЩА где R — низший алкил, 2-оксиэтил или карбометоксиметил;
К вЂ” атом водорода или бензил, отличающийся тем, что соединение формулы
„«О Т .сн, СООСН2С@15
„,SU„„12729 5 А3 (д1) 4 С 07 D 499/00 // A 61 К 31/43 подвергают окислению перманганатом калия в инертном растворителе при
Π— 5 С, образующееся соединение формулы о, «;.о СООН "=сн
0 -Соосн2сбн5 подвергают взаимодействию с клорангидридом щавелевой кислоты в инертном растворителе при С С, образующееся соединение формулы
0 «О C0Ñ1 ,Ц, сн, СООСнгСБН подвергают взаимодействию с соответствующим спиртом в инертном растворителе в присутствии пиридина при о
G С и выделяют целевой продукт общей формулы (1), где R — бензил, 2 или переводят его в целевой продукт, где R — атом водорода, каталитическим гидрогенолизом, Смесь перемешивают еще в течение
50 ч, а затем выливают в смесь воды (800 мл) и этилацетата (300 мл). По0лученную смесь охлаждают до 15 С и добавляют раствор бисупьфита натрия при рН 2,5 до тех пор, пока не растворится коричневый осадок двуокиси марганца. Затем значение рН доводят до 1, 6 с помощьк 2 н.НС1. Этилацетатную фазу удаляют и водную фазу экстрагируют дополнительно этилацетатом (300 мл); Этилацетатыые фазы смешивают, промывают рассолом (2x100 мл) и сушат (Naz БО). Выпаривание под пониженным давленн и (аспнратор) да45
Ф 12729
Изобретение относится к способу получения новых производных пенициллина, а именно сложных эфиров 1„1—
-диоксид-2 -метилпенам-2,3с -дикарбоновой кислоты, которые обладают свойством усиливать эффективность действия антибиотиков пенициллинового и цефалоспоринового ряда.
Цель изобретения — получение новых соединений, повышающих эффектив- 10 ность действия антибиотиков пенициллинового и цефалоспоринового ряца.
Спектры инфракрасного поглощения измерены на дисках из бромистого калия (диски KBr), а характеристи- 15 ческие полосы поглощения указаны в волновых числах. Спектры ядерного магнитного резонанса (ЯМР) измерены при 60 мГц для растворов в
1дейтерированном хлороформе (CDC1) 20 или в пердейтеродиметилсульфоксиде (DMSO ), и положения пиков выражены в частях на миллион по убыванию поля от тетраметилсипана.
Пример 1. Бензиловый эфир
1, 1-диоксид-2Р-карбокси — 2o!-метил— — (5R)-пенам-Зо — карбоновой кислоты.
Порошковый перманганат калия (17,96 г) добавляют по порциям к раствору бензилового эфира ? -оксиметил-2 -метил †(5R) †пен-3 †карбоновой кислоты (5,82 г) в ацетоне (100 мл) — воде (60 мл), охлажденных до 0-5 С в ледяной бане. После добавления каждой порции перманганата 35 видимое значение рН смеси доводят до 3,0 путем добавления 25%-ной фосфорной кислоты. Смесь перемешивают в течение 30 мин при 0 — 5 С после окончания добавления перманганата и 40 удаляют охлаждающую баню. Периодически регулируют рН поддерживая его значение, равное 3,0.
95 ет смолистое твердое вещество, которое поглощают в смеси этилацетата (50 мл) и воды (25 мл) и значение рН доводят до 8,5 с помощью 5%-ного водного NaOH. Фазы разделяют и водную фазу экстрагируют еще раз этилацетатом (25 мл). Значение рН водной фазы доводят до 1,6 с помощью 2 н.
НС1, а затем ее экстрагируют этилацетатом (50 мп). Этилацетатный экстракт промывают рассолом (2х20 мл), сушат (Na S04 ) и выпаривают под вакуумом, получая 2,1 г названного продукта в виде твердого вещества.
Перекристаллизация из смеси этилацетата и простого эфира дает аналитический образец: т.пл. 122- 124 С (разложение).
Найдено, %: С 50 82; Н 4 35;
N 3,99.
Вычислено, %: С 50,98; Н 28;
N 3,96.
ЯМ1 (СВС1,, + DMCO — а,). б: 1.58 (ЗН,S) 3,48 (2Н,m) 4,84 (1Н,dd I=
2,4 Гц); 5,22 (2H,S); 5,46 (?Й,Б);
7,33 (5H S), Пример 2 ° Бензиловый эфир ,1,1-диоксид-2Р-хлоркарбонил-2к-метил — (SR) †пен-Ъ -карбоновой кислоты.
Хлористый оксалил (0,37 мл) добав» ляют при перемешива нии к раствору бензилового эфира 1,1-диоксид-2р-карбокси-2 -метил-(5R)-пенам-Зм-карбоновой кислоты (1,25 г) в хлороформе (12 мл) при 0 С в атмосфере азота. Сразу же добавляют диизопропилэтиламин (0,68 мл) в виде одной порции. Полученную коричневую пенящуюо.. ся смесь затем нагревают до 50 С на водяной бане и перемешивают в течение 30 мин. Полученный таким образом неочищенный хлорангидрид используют без дальнейшей очистки.
ЯМР (CDCI ), Е: 1,70 (ЗН, S), 3,57 (2H,m); 4,78 (18 dd, I = 2,4 Гц);
5,23 (2Н, АВ q, I = 12 Гц); 5,47 (1Н, S); 7, 34 (5Н, S), Пример 3. Бензиловый эфир
1, 1-диок сид- 2Р; кар ODMeтокси -2o4-метил- (5R) -пенам-Зо -кар боновой кислоты.
Пиридин (10 капель) и метанол (8 капель) добавляк т к 0,1 ммоль бензилового эфира 1,1-диоксид-2Р12729
I
-хлоркарбонил-2g-метил- (5R)-пенам—
-З с-карбоновой кислоты (продукт примера 2) в атмосфере азота при охлаждении на ледяной бане и смесь перемешивают в течение 90 мин. 3атем ее распределяют между этилацетатом (20 мл) и водой (20 мл) и значение рН доводят до 3,0. Этилацетатный слой отделяют, промывают водой (10 мл) при рН 3,0, затем рассолом (20 мл), после чего сушат (Иа БО ).
Удаление этилацетата под вакуумом дает 35 кг названного продукта.
Его очищают тонкослойной хроматографией на силикагеле, используя в качестве элюанта смесь 2: 1 гексана и этилацетата. Rf = 0,25.
ЯМР (CDC1 ), Р: 1,52 (ÇH, S);
Зу50 (2H,m); 3,86 (ЗН,S); 4,63 (1Н,m); 5,22 (2Н,S) 5,54 (!Н,S);
7137 (5Нэ$)
Пример 4. 1,1-Диоксид-2Р-карбометокси-206-метил- (5R)-пенам-Зд -карбоновая кислота.
Раствор бензилового эфира 1,1-диоксид-28-карбометокси-2 -метилвЂ(5R)-пенам-Зе -карбоновой кислоты (44 мг) в метаноле (20 мл) и воде (5 мл) подвергают гидрогенолизу в аппарате Паара над tOX палладированным углем (200 мг) при давлении водорода 3,52 кг/см в течение г
20 мин при комнатной температуре.
Катализатор удаляют фильтрованием и промывают смесью метанола и воды.
Фильтрат выпаривают под вакуумом, чтобы удалить метанол и водный остаток экстрагируют этилацетатом при рН t,6 (2х20 мл). Смешанные этилацетатные экстракты сушат (ХагБО4) и 4О выпаривают под вакуумом, чтобы полу,чить стекловидный остаток. Продукт медленно кристаллизуют из дейтерохлороформа.
ЯИР (CDClg),3 : 1,75 (ЗН,S); 45
3 ° 53 (2Нэm); Çь90 (ÇHэS); 4,68 (tH,m);
5,49 (1H S) . .Пример 5. Бензиловый эфир
1,1-диоксид-2Р-карбэтокси-2Ж-метилвЂ(5R)-пенам-ЗЫ-карбоновой кислоты.
Пиридин (0,091 мл) и этанол (0,065 мл) добавляют к 0,283 ммоль бензилового эфира 1,1-диоксид-2Р,- хлоркарбонил-2Ы-метил-(5R)-пенам-ЗК-карбоновой кислоты (полученного по примеру 2, но с .использованием в качестве растворителя СН С1 вместо хлороформа) в хлористомАетилене
95 4 (3 мл) в атмосфере азота при 0 С, 6 смесь перемешивают в течение 30 мин.
Затем ее нагревают до комнатной тем пературы и хлористый метилен удаляют под вакуумом. Остаток распределяют между этилацетатом (15 мл) и водой (15 мл) при рН 3,0. Этилацетатную фазу отделяют и промывают последовательной водой (15 мл) при рН 3,0 водой (10 мл) без доводки значения рН, водой (15 мл) при рН 8,5 рассолом (15 мл) и сушат (Na
ЯМР (CDC1 ),B : 1,26 (ÇH,t, I
= 7 Гц); 1,54 (ЗН,S); 3,49 (2й,ш);
4,31 (2Н,q, I = 7 Гц); 4,58 (1Н,m)
5э17 (2H Abq); 5 ° 48 (1Н ° S)ф 7 ° 30 (5Н,S).
Пример 6. 1,1-Диоксид-2/ -карбэтокси-2к,-метил-(SR)-пенам-Зк-карбоновая кислота.
Смесь бензилового эфира 1,1-диоксид-2Р-карбэтокси-2 -метил-(5R)-пенам-Зк-карбоновой кислоты (160 мг)., тетрагидрофурана (25 мл) воды (10мп) и 5Х Pd/CàÑÎ (300 мг) подвергают гидрогенолизу в аппарате Паара при давлении водорода 3,37 кг/см в тег чение 15 мин при комнатной температу. ре. Затем катализатор удаляют фильтрованием и промывают смесью тетрагидрофурана (15 мл) и воды (6 мл).
Фильтрат выпаривают под вакуумом, чтобы удалить тетрагидрофуран. Эфир (20 кп) добавляют к водному остатку (рН 7,8), смесь тщательно перемеши,вают и фазы разделяют. Водную фазу подкисляют до рН 1,6 (2 н. НС1) и экстрагируют этилацетатом (30 мл) ° .
Экстракт сушат (Na SO< ) и выпаривают под вакуумом до прозрачного амар ного остатка. Остаток поглощают в этилацетате (5 мл) и выпаривают под вакуумом. Эту стадию повторяют еще раэ. Чтобы удалить следы этил-. ацетата, к остатку добавляют хлороформ (5 мл), а затем его удаляют выпариванием под вакуумом. Добавление и удаление хлороформа повторяют еще pas> получая 100 мг названного продукта в виде прозрачной аморфной массы (стекло).
ЯМР (CDClg), : 1,33 (ÇH,t, I= 7 Гц); 1,74 (ЗН,Я); 3,50 (2Н,ш);
4,34 (2Н,q, I =7,Гц); 4,65 (1H,S)
5,48 (1Н, S) .
1 7?995
Катализатор удаляют фильтрованием, промывают тетрагидрофураном (20 мл) и водой (10 мл), смешанные фильтрат и промывку выпаривают под вакуумом, чтобы удалить большую часть тетрагидрофурана, оставив водный раствор. К водному остатку добавляют этилацетат (20 мл) и значение рН доводят до 8,0. Фазы смешивают,а затем разделяют. К водной фазе добавляют свежий этилацетат (20 мл) и значение рН доводят до 1,6. После тщательного перемешивания отделяют этилацетатную фазу, промывают рассолом (10 мл) и сушат (Na
t остатку добавляют хлороформ (5 мл) .
Выпарив хлороформ под вакуумом, получают 15 мг названного продукта в виде стекла, которое кристаллизуется при стоянии.
ЯМР (ацетон-d<), 3: 1,74 (ÇH,S);
1,90 (ЗН,S)3 3,58 (4Н,Ш)1 4,32 (2H, I = 5,6 Гц); 4,68 (2Н, широкий);
4,97 (1Н, dd Е = 2,4 Гц); 5,47 (1Н,S) .
Пример 7. Бензиловый эфир
1,1-диоксид-2В-(2-оксиэтоксикарбонил) — 2 .— ìåòèë — (5R) -пенам З -карбоновой кислоты.
Раствор бензилового эфира 1, 1—
-диоксид-2 -хлоркабонил-2 -метил-(5R)-пенам-Зе -карбоновой кислоты (0,53 ммоль) в хлороформе (2,5 мл) добавляют при хорошем перемешивании к раствору этиленгликоля (1,1 мл) и пиридина (0,3 мл) в хлористом о метилене (3 мл) при О С в атмосфере азота. Смесь перемешивают в течение
1 ч при О С, а затем оставляют нагреваться до комнатной температуры.
К смеси добавляют этилацетат (20мл) и воду (10 мл), значение рН доводят до 2,5 путем добавления 2 н.фосфорной кислоты и смесь тщательно перемешивают. Фазы разделяют и этилацетатную фазу промывают водой (10 мл) при рН 2,5. Затем ее отделяют, промывают водой (4x10 мл), рассолом (15 мл) и сушат (Na
ЯМР (CDClg),8: 1,53 (3H ° S)
2 ° 94 (1H широкий S); 3,50 (2Н>m);
3,76 (2Н,m) 4,33 (2Н,т); 4,66 (1Н m); 5ъ21 (2НвS); 5@52 (fH„S);
7,35 (5H,S) °
25 за
55 б
П р и и е р B. 1, 1-Диоксид-2Г1 †(2-оксиэтоксикарбонил)-2с -метилвЂ(5К) †пен-3p(, карбононая кислота
Бензиловый эфир 1,1-диоксид-2Р(2-оксиэтоксикарбонил)-2 -метилвЂ(5R)-пенам-З -карбоновой кислоты (192 мг) подвергают гидрогенолизу в тетрагидрофуране (30 мл) и воде (5 мл) над 107 Pd/Ñ (300 мг) при Z давлении водорода 3, 37 кг/см при комнатной температуре в аппарате
Паара в течение 20 мин. Катализатор удалявт фильтрованием, промывают смесь этилацетата (30 мл) и воды (10 мп) и смешанные фильтрат и промывочный раствор охлаждают в ледяной бане. Значение рН доводят до 1,6, фазы смешивают, а затем разделяют.
Водную фазу экстрагируют этилацетатом (30 мл) и смешанные этилацетатные экстракты промывают рассолом (20 мл), . а затем сушат (Na
ЯМР (ацетон-d<),Я : 1,79 (ЗН,Б);
3,36 (1Н, dd, I = 2, 17 Гц); 3,77 (1Н, dd, I = 4,17 Гц); 3,80 (2Н,t;,I = — 5 Гц) 4ч35 (2H, " I = 5 Гц)
4,98 (1Н, dd, I = 2,4 Гц); 5,46 (1Н, S) 6,93 (2Н, широкий)
Пример 9. Бензиловый эфир
1, 1-диоксид-2Я-(2-карбометоксикарбонил)-2 -метил-(5Н) -пенам-З -кар-, боновой кислоты.
Раствор пиридина (0,3 мл) и метилового эфира гликолевой кислоты (О, 391 мл) в хлористом метилене (1 мл) добавляют к раствору бензилового эфира 1,1-диоксид-2Р-хлоркарбонил †2с †м-(Ж)-пенам-Зр †карбоновой кислоты (0,53 ммоль) в дейтерохлороформе (продукт примера 2)при о
О С в атмосфере азота. Смесь перемео шивают при О С в течение I ч, а затем при комнатной температуре в течение 1 ч. Реакционную смесь обрабать вают по примеру 9, получая 256 мг названного соединения в виде масла.
ЯМР (CDCI,,), 3: 1,63 (ÇH, S);
3,49 (2Н.m): 3,73 (ЗН,S); 4,70 (ÇH,m);
5,21 (2Н,S); 5,53 (1Н,S); 7,32 (5H,S).
Пример 10. 1, 1-Диоксид-2fl†(2-карбометоксиметоксикарбонил)-2а-метил-(5R)-пенам-ЗИ.-карбоновая кислота.
Следуя методике примера 10, но используя смесь ацетона и воды (5:1) в качестве раствори ..еля и 400 мг 10X
272995 8 пициллином или цефазолином, взятыми в равных массовых количествах, существенно усиливает антибактериальную активность ампициллина или цефаэолина против некоторых патогенных микpOOpFaHH9MOB °
В таблице приведены результаты испытаний смесей в сопоставлении с активностью ампициллина и цефазолина против тех же микроорганизмов.
Организм
Соединение (1) (формула (1), где
R = ОСН,; К, = Н) Цефаэолин
Ампициллин
Эффект соединение + - Эффект + (I) ампицил- цефазолин лин
0,78+
6,25+ ЗС
3,21+ 0
Staph. aureus 01А400 >200
51А266 0200
51А129 )200
E. col i
12, 5+
Е.cali
25+
ЗС
100+
Ps. aeruginosa 52А104 >200
12,5+ ЗС
Kleb,pneumo-
nial
1,56+ 0
50 1,56
53А079 200 12,5+ С
Serr. marces12,5+ ЗС 200 >200
12,5+ 3С 100 )200
63А095 ю200
6,25+ ЗС
6,25+ 3С
cens
Enter. cloacal 67В009 >200,morg.morgansis 97А001 >200 1,56+ ЗС
12 у 5+ ЗС 100 100
Примечание. ЗС вЂ” значительный синергиэм; С вЂ” синергиэм; 0 — отсутствие эффекта.
Составитель З,Латыпова
Редактор В.Петраш Техред И.Попович Корректор И. Минска
Заказ 6353/59 Тираж 379 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д.4/5
Производственно-полиграфическое предприятие, г.Ужгород, ул.Проектная,4
7 1
Pd/Ñ, из бензилового эфира 1,1-диоксид-2 -(2-карбометоксиметоксикарбонил)- К-метил-(5R)-пенам-Зк-карбо1 новой кислоты получают названное соединение (130 мг).
ЯМР (СРС11), S 1,82 (ÇHу S)
3 ° 55 (2Нв m); Зв80 (ÇHэ S); 4у84 (ЗН, m); 5 50 (1Н, S).
Соединение (I) (формула (1), где
R> 0CH, Кь = Н) в сочетании с ам0 100 0 78
3, 12 1,56
ЗС ) 200 200
С 200 %200