Способ определения глутаматоксалацетаттрансаминазы или глутаматпируваттрансаминазы
Иллюстрации
Показать всеРеферат
Изобретение относится к клинической биохимии и предназначено для определения глутаматоксалацетаттрансаминазы и глутаматпируваттрансаминазы и реагента для их определения. Цель изобретения - ускорение способа . К глутамату добавляют пируват и )-аминобутират. При этом буферный раствор имеет рН 7,0-9,0. В реакционную смесь вносят аминобутираттрансаминазу и семиальдегид - дегидрогеназу . Производят фотометриро вание. Затем рассчитывают активность глутаматпируваттрансаминазы. 4 табл,.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (5D 4 С 01 N 33 48
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
H ПАТЕНТУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 2793851/28-14 (22) 06.08.79 (3!) Р 2834706.0 (32) 08.08.78 (33) DE (46) 07.12.86. Бюл. Ф 45 (71) Берингер Маннхайм ГмбХ (DE) (72) Ульферт Денеке, Петер Шталь и Вальтер Шнайдер (РЕ) (53) 61 6 . 07 (088 .8) (56) Clin Chim. Acta, 28, 1970, 431-437.
Biochimic Clinica, 2, 197!, 25-36. (54) СПОСОБ ОПРЕДЕЛЕИЬЧ ГЛУТАМАТОКСАЛАЦЕТАТТРАИСАМИ!!АЗЫ ИЛИ ГЛУТАМАТПИРУВАТТРАНСАМИИАЗЫ (57) Изобретение относится к клинической биохимии и предназначено для определения глутаматоксалацетаттрансаминазы и глутаматпируваттрансаминазы и реагента для их определения.
Цель изобретения — ускорение способа. К глутамату добавляют пируват и
$-аминобутират. При этом буферный раствор имеет рН 7,0-9,0, В реакционную смесь вносят аминобутираrтрансаминазу и семиальдегид — дегидрогенаэу. Производят фотометриро вание. Затем рассчитывают активность глутаматпируваттрансаминаэы. 4 табл.
1276269
Изобретение относится к способам определения активности фермента глутаматоксалацетаттрансаминазы (GOT) и глутаматпируваттрансаминазы (СРТ), а также к реагентам, пригодным для проведения этого способа и может быть применено для определения названных ферментов в биологических жидкостях, таких как сыворотка, моча или в др.
Цель изобретения — ускорение анализа.
Определение глутаматоксалацетаттрансаминазы или глутаматпируваттрансаминазы осуществляют путем инкубации исследуемого фермента с глутаматом.в буферном растворе с последующим фотометрированием, для чего
50 ммоль/л глутамата предварительно вводят во взаимодействие с 0,1—50 ммоль/л оксаната или пирувата соответственно в буферном растворе с рН 7,0-9,0, далее в реакционную смесь вносят 10-300 ммоль/л « -аминобутирата с 500-2000 Ед/л аминобути — раттрансаминазы, затем добавляют семиальдегиддегидрагеназу, Полученный восстановленный NADP фотометрируют, Способ осуществляют следующим образом.
Комбинируют реакции по уравнениям
ГАВ-GT
cC-KG -аминобутират сук-. цинатсемиальдегид + -глутамат, где
GAB-GT-)-аминобутираттрансаминаза; ,сукцинатсемиальдегид + NADP
SS AI-ВН ф сукцинат + NADPH + H, где
SS -Af-ЭН сукцинатсемиальдегиддегидрогенаэа, и осуществляют реакцию, которую проводят с солью тетраэола в присутствии переносчика электронов для повторного окисления NADPH при одновременном образовании окрашенного формазана, который легко можно измерить в видимой части спектра. Это соответствует уравнению: ,+ диафораэа
NADpII+Мау+М == форма«ам«
+ NADP где MTT = 3-(4,5-диметилтиазолйп-2)-2,5-дифенилтетразолила бромид.
Способ проводят при рН 7-9,5.
При более высоких и более низких значениях рН происходит существенное замедление реакции с соответствующим удлинением времени, необходимого для проведения одного теста. Самые хорошие результаты получают при значениях рН в интервале 8-8,6.
Пригодная концентрация буфера лежит в интервале 5-0,5 моль/л, что
5 соответствует концентрации буферной соли в тесте 0,05-б . Предпочтительно использование буфера концентрацией 10-100 ммоль/л.
В качестве соли тетраэола исполь3yNT MTT.
Хорошие результаты получены с хлоридом нитроголубого тетразола (NBT) и хлоридом 2- (n-йодофенил) -3- (n-нитрофенил)-5-фенилтетраэола (Zm).
При измерении красителя формазана целесообразно добавлять поверхностно-. активные вещества, которые улучшают растворимость красителя.
В примерах используют сокращения:
GPT — глутаматпируваттрансаминаэа, GAB-GT — tt -аминобутираттрансаминаза:
SS-A1-DH — сукцинатсемиальдегид25 дегидрогеназа;
СОТ вЂ” глутаматоксалацетаттрансаминаза, NADp — никотинамидадениндинуклеотидфосфат;
ЗО NADPH — никотинамидадениндинуклеотидфосфат восстановленный;
MTT — 3-(4,5-диметилтиазолил-2)-2,5-дифенилтетразолила бромид;
Трис — трис(оксиметил)-аминометан;
Тритоí RX!00 — алкиларилполиэтиленгликолевый эфир.
Пример 1. Определение GPT.
Образование NADPH является сигналом измерения. Температура 25 С, длина волны 365 нм, тестовый объем 3 мл, 1-сантиметровая кювета.
Данные приведены в табл .l.
Исходный раствор перемешивают.
Начинают реакцию с 0,5 мл сыворотки
45 (GPT-обогащенная), перемешивают, 2 мин инкубируют, снимают показания
Е, через 1,2,3 и 4 мин точного времени, далее снимают показания Е у
Ез, Е4 и Eg.
На основании полученных данных рассчитывают значение Е/мин.
Активность GPT в пробе рассчитывают по формуле
И Ед/мл = — — — = Е « 1,714.
E 7
Я «
Пример 2. Определение GPT.
Образование формазана выбирают в!
276269. качестве сигнала измерения. Температура 25 С, длина волны 578 нм, тестовый объем 3 мл, кювета толщиной 1 см.
В кювету пипеткой вводят вещества, укаэанные в табл.2.
Исходный раствор перемешивают.
Начинают реакцию с 0,1 мл сыворотки (GPT — обогащенная), перемешивают, 2 мин инкубируют, снимают показание E через 1, 2, 3 и 4 мин точного времени. Далее снимают показания
Е2 Еъ, Е4 и Еэ на основании кото рых рассчитывают значение GPT.Å/ìèí.
Активность в пробе рассчитывают по следующей формуле:
Е Ч
Ед/мл = — — -- = дЕ ° 1,796
FV
Пример 3. Определение GPT.
Образование NADPH принято в качестве сигнала измерения. Температура измео рения 25 С, длина волны измерения
365 нм, тестовый объем 3 мл, кювета толщиной 1 см.
В кювету пипеткой вводят вещества, представленные в табл.3.
Исходный раствор перемешивают.
Реакцию начинают с 0,5 мл сыворотки (GOT-обогащенная), перемешивают, 2 мин инкубируют, снимают показание Е <, через 1, 2, 3 и 4 мин точного времени, далее снимают показания
Е, Е, Е, Е . На основании полученных данных рассчитывают дЕ/мин.
Активность GOT в пробе рассчитывают по формуле дЕ7- V
Ед/мл = — — =- = д Е - 1,717
g ""Ъ
Пример 4. Определение СОТ.
Образование формазана принято в качестве сигнала измерения. Темперао тура 25 С, длина волны измерения
578 нм, тестовый объем 3 мл, кюве,та толщиной 1 см.
Исходный раствор перемешивают.
Реакцию начинают с 0,05 мл сыворотки (GOT-обогащенная), перемешивают, 2 мин инкубируют, снимают показание
Е, через 1, 2, 3 и 4 мин точного времени, далее снимают показания
2 Е, Е!,и Еэ
Активность GOT в пробе рассчитывают по формуле дЕ-V
ЕД/мл = — — — — = дЕ 3 593. .,Т,т
ЗО
Формула изобретения
Способ определения глутаматоксалацетаттрансаминазы или глутаматпируваттрансаминазы путем инкубации исследуемого фермента с глутаматом в буферном растворе с последующим фотометрированием, о т л и ч а ю— шийся тем, что, с целью ускорения анализа, 50 ммоль/л глутамата предварительно вводят во взаимо-:- действие с 0,1-50 ммоль/л оксаната или пирувата соответственно в буферном растворе с рН 7,0 — 9,0, далее в реакционную смесь вносят .10— .300 ммоль/л -аминобутирата и 5002000 Ед/л аминобутираттрансаминазы, затем добавляют семиальдегиддегидрагенаэу; полученный восстановленный NADP фотометрируют.
50
5
Пример 5. Определение GPT на тестовой полосе.
Пригодную бумагу пропитывают раствором, содержащим все реагенты, приведенные в римере 2, осторожно сушат, укрепляют на п1!игодном носителе, запечатывают и разрезают на полосы. После погружения в сыворотку появляется красно-голубое ок— рашивание, интенсивность которого пропорциональна активности GPT в пробе. Оценку можно проводить сравнением с пригодной шкалой стандартного окрашивания, а также с помощью отражательного фотометра.
Пример 6, Определение GOT на тестовой полосе.
Пригодную бумагу пропитывают раствором реагентов, приготовленным по примеру 4, осторожно высушивают, укрепляют на пригодном носителе, при необходимости запечатывают и разрезают на полосы. После .погружения в сыворотку появляется красно-голубое окрашивание, интенсивность когорого пропорциональна GOT-активности в пробе. Оценку можно проводить сравнением с пригодной шкалой стандартной окраски, а также с помощью отражательного фотометра.. !276269
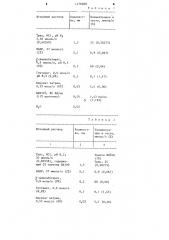
Количество, мм
Ов!
60 (0,06) 0,2
О,! (1,47) 0,5
5,4 (0,06) 0,03
0 05
0,02
Н О
Количество, мм
1,5
0,1
0,2
60 (0,06) 0 5
0,1 (1,47) 5,4 (0,06) 0 i 03
Исходный раствор
Трис, НС1, рН 8;
3,50 ммоль/л (0,6055%) МАВР, 27 ммоль/л (2%) -Аминобутират,,9 ммоль/л, рН 8,3 (9X) Глутамат, 0,6,моль/л рН 8,3 (9,8%) Пируват натрия, 0,55 моль/л (6%) GAB-GT, 86 ЕД/мл (11% протеина) Исходный раствор
Трис, НС1, рН 8,3;
50 ммоль/л (0,6055%), содержащий 2% тритона RX100
МАВР, 27 ммоль/л (2%) !! -Аминобутират, 0,9 моль/л (9%) Глутамат, 0,6 моль/л (8,8%) Пируват натрия, 0,55 моль/л (6%) Т а б л и и а 1
Концентрация в тесте, ммоль/л (%) 25 (О, 30275) 0,9 (0,067) 1,43 Ед/мл
3 (1,183) Та блица 2
Концентрация в тесте, ммоль/л (%) Тритон RX100 (1%)
Трис, 25 (0,30275) 0,9 (0,067) 1276269 8
Продолжение табл.2.
О,l (0,00414) 0,2
0,04
2,2 Ед/л
0,05 (0,1837) 0,01
0,26
Н20
Таблица 3
Количество, мм
1,5
NADP, 27 ммоль/л (2X) О, 1
90 (0,9) 0,3
60 (0,88) 0,3
0,65 (0,00917) 0,1
0,05
SS -Al-DH 133 Ед/мл (llX протеина) 0,05
0,1
Нг
МТТ, 1,5 моль/л (0,0621X) GAB-GT, 86 Ед/мл (11X протеина) l SS -Al-DH 133 Ед/мл .(117 протеина) Диафораза, 23 Ед/мл (0,57 протеина) Исходный раствор
Имидазол, НС1 рН 7,6
100 ммоль/л (6,8087) -Аминобутир ат, О, 9 моль/л рН 8, 3 (9X) Глул амат, 0,6ммоль/л рН 8,3 (8,8X) Оксалацетат, 20,8 ммоль/л (0,275X) GAB-GT, 86 Ед/л (ll протеина) (2
) з
1,43 Ед/мл (0,1837) 0,077 Ед/мл (0,00177) Концентрация в тесте, ммоль/л (Ж) 50 (3,404)
0,9 (0,067) 1,43 Ед/мл (0 183X) 2,22 Ед/мл (0 183X) !
1276269
Таблица 4
Количество
Исходный раствор
1,5
0,9 (0,067) NADP, 27. ммоль/л (2%) . O,l
0,3 90 (0,9) 0,3 60 (0,88) Оксалацетат, 20,8 ммоль/л (0,275%) 0,65 (0,00917) 0,1
0,2 0,1 (0,00414) GAB-GT, 86 Едlмл (11X протеина) 0,05 1,43 Ед/л (О,!83%) 0,05 2,22 Ед/мл (О 183%) Диафораза, 23 Ед/мл (0,5% протеина) 0,01 0,077 Ед/мл (0,0017%) 0,24
Н 0
Составитель Н.Хрусталева
Техред А.Кравчук Корректор Л.Пилипенко
Редактор Н.Яцола
Заказ 6586/60 Тираж 778 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Иосква, 1К-35, Раушская наб. д. 4/5,Производственно-полиграфическое предприятие, r.Óæãîðîä, ул.Проектная, 4
Имидазол, НСI, рН 7,6
100 ммоль/л (6,808%)
+3X тритона RXIOO
1(-Аминобутират, 0,9 ммоль/л, рН 8,3 (5%) Глутамат, 0,5 ммоль/л рН 8,3 (3,8%) MNT !,5 ммоль/л (0,0621%) I
SS -Al DÍ, 133 Ед/л (11% протеина) Концентрация в тесте, ммоль/л (%) Имидазол 50ммоль/л (0,302757.) тритон
RXI00 (1,5X)