Способ получения 1,1-диоксо-6-бром(или-6,6-дибром) пеницилланоилоксиметиловых эфиров 6-(2-азидо-2- фенилацетамидо)пенициллановой кислоты
Иллюстрации
Показать всеРеферат
СОЮЗ СОЕЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК
0% (И) 897 АЗ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н IlATEHTV
О О
3 НЗ
СН3
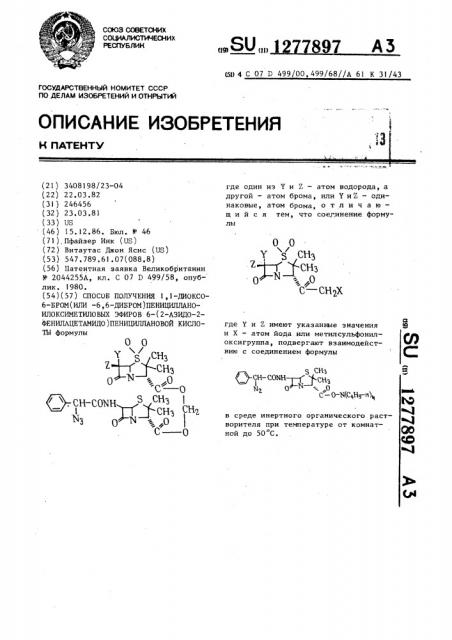
0 М Ъ,o с — сн х
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР по делАм изОБРетений и ОткРытий (21) 3408198/23-04 (22) 22.03,82 (3i) 246456 (32) 23.03.81 (33) US (46) 15.12.86. Бюл. Ф 46 (71),Пфайзер Инк (VS) (72) Витаутас Джон Ясис (US) (53) 547.789.61.07(088.8) (56) Патентная заявка Великобритании
N - 2044255А, кл. С 07 D 499/58, опублик. 1980. (54)(57) СПОСОБ ПОЛУЧЕНИЯ 1,1-ДИОКСО6-БРОМ(ИЛИ -6,6-ДИБРОМ)ПЕНИЦИЛЛАНОИЛОКСИМЕТИЛОВЫХ ЭФИРОВ 6-(2-АЗИДО-2ФЕНИЛАЦЕТАМИДО)ПЕНИЦИЛЛАНОВОИ КИСЛОТЫ формулы
0 0
СН3
СФ
0 Х: О . cH-C0YH
1 з g =,о 1
C 0 сю 4 С 07 D 499/00, 499/68//A 61 К 31/43 где один из Y u Z — - атом водорода, а другой — атом брома, или Y u Z — одинаковые, атом брома, о т л и ч а ю— шийся тем, что соединение формулы где Y u Z имеют указанные значения и Х вЂ” атом йода или метилсульфонилоксигруппа, подвергают взаимодействию с соединением формулы
s сн
CH CON H Сн., С" — О-К(С,Н -@„ в среде инертного органического растворителя при температуре от комнатной до 50 С.
1 127
Изобретение относится к спссобу получения новых соединений — 1,1-диоксо-б-бром(или-6,6-дибром)пеницилланоилоксиметиловых эфиров 6-(2-азидо-2-фенилацетамидо)пенициллановой кислоты, которые являются полупродуктами в синтезе Р -лактамных антибиотиков против бактерий, продуцирующих
Р-лактамазу.
Цель изорберения — упрощение процесса получения,б-лактамных антибиотиков.
Пример 1. I,l-диоксо-6,6дибромпеницилланоилоксиметиловый эфир 6-(D-2-азидо-2-фенилацетамидо) пенициллановой кислоты.
К смеси 0,232 г (0,37 ммоль) тетрабутиламмониевой соли 6-(D-2-азидо2-фенилацетамидо)пенициллановой кислоты и !0 мл ацетона добавляют 0,20 г (0,37 ммоль) йодметилового эфира
l,l-двуокиси 6,6-дибромпенициллановой кислоты и смесь перемешивают при комнатной температуре в течение
30 мин. Дополнительно добавляют 50 мг тетрабутиламмониевой соли D-(2-азидо-2-фенилацетамидо)пенициллановой кислоты и перемешивание продолжают в течение 30 мин. Реакционную смесь концентрируют досуха и остаток помещают в колонку силикагеля (50 r).
Элюирование осуществляют смесью 1".I (объем/объем) этилацетат/гексан, получив 7 мл фракции. Фракции 17-24 смешивают, выпаривают досуха, получив 0,14 г (497) целевого продукта в виде светло-желтого масла. Н-ЯМР (CDC1 ), ч на мпн (о): 1р4 (s, ЗН), l,5 (s, ЗН), 1,59 (s, 3Н), 1,62 (s, ЗН), 4,4 (s, llH), 4,5 (s, 1Н), 4,97 (s, IН), 5,04 (я, IН),; 5,4-5,70 (m, 2H), 5,85 (s, 2Н), 7,05 (d, !Н), 7,85 (я, 5Н); ИК-спектр (чистый), с;-л : 1810, 1775.
Те тр абутиламмониевую сол ь 6- (D-2азидо-фенилацетамидо ) пенициллановой кислоты получают следующим образом. Смешивают 1 г натриевой соли D-2азидо-2-фенилацетамидоненициллановой кислоты„ 50 мл этилацетата и 25 мл воды, значение рН доводят до 2,0 (2н. НС1). Органический слой отделяют, промывают рассолом (10 мл) и растворитель выпаривают под вакуумом.
Оставшуюся пену растворяют в 30 мл хлористого метилена, добавляют 15 мл воды и 40Х-ный раствор гидрата окиси тетрабутиламмония до тех пор, пока
7897 значение рН водной фазы не достигнет
8,0. Органический слой отделяют, вод— ный слой экстрагируют снова хлористым метиленом (2х20 мл) и смешанные экстракты сушат (,!а 80 ) и концентри— т руют досуха, получив твердую смолу.
Ее растирают с этилацетатом (2х!О мл) и этиловым эфиром (2х10 мл). Получен.ное беловатое твердое вещество сушат на воздухе, получив 1,25 г целевой тетрабутиламмониеной соли.
Пример 2„ I.l-диоксо-б-бета-бромпеницилланоилоксиметиловый эфир 6-(D-2-азидо-2-фенилацетамидо) пенициллановой кислоты.
К смеси 0,152 r (0,25 ммоль) тетрабутиламмониевой соли (D-2-азидо-215 фенилацетамидо)пенициллановой кислоты и 5 0 мл ацетона добавляют О,!4 г (0,25 MMoa»). йодметилового эфира
l,l äâóîêèñè 6-бета-бромпенициллановой кислоты. Полученную бесцветную смесь перемешивают при комнатной тем—
25 пературе в течение 30 мин, растворитель выпаривают под вакуумом, а остаток хроматографируют на колонке силикагеля (25 г), элюируя смесь 1:1 (объем/объем) этилацетат/гексан, Фракции по 6 мл собирают примерно через интервалы 30 с. Фракции 13-17 смешивают и концентрируют под вакуумом, получив 0,125 г целевого продукта в виде пены. Н-ЯМР (CDC1 ), ч. на млн (F)): 1,4 (э, ЗН) „1,5 (я, 35 ЗН), 1 6 (s,, ЗН), 1,65 (=-, ЗН), 4 42 (s 1Н), 4 5 (я, 1",), 4 75 (6, lH) 5 07 (s„ 1H) 5 3 (д lii)
5 4 5,75 (m, 2Н), 5 85 (s, широкий, 2Н), 7,1 (d, IH),,7,35 (s, 5Н,;
ИК-спектр (чистый), см : 1800, !775.
Пример 3. 1„1-диоксо-6-альфа-бромпеницилланоилоксиметиловый эфир 6-(D-2-азидо-2-фенилацетамидо) пенициллановой кислоты.
Смесь 0,308 г (0,5 ммоль) тетрабутиламмониевой соли (D-2-азидо-2фенилацетамидо)пенициллановой кислоты, 0,219 г (0,485 ммоль) йодметилового эфира 1,1 †двуоки 6-альфа-бромпенициллановой кислоты и 10 мл ацетона перемешивают в течение 30 мин при комнатной температуре. Растворитель выпаривают под вакуумом, а остаток хроматаграфируют на колонке 50 г силикагеля, элюируя смесью 1:1 (объем/ объем) этилацетат/гексан. Фракции, содержащие продукт, смешивают, растворитель выпаривают под вакуумом, Составитель 3. Латыпова
Техред И.Попович
Редактор М. Дылын
Корректор А. Тяско
Заказ 6766/60 Тираж 379
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Подписное
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
3 1277897 4 получив 0,125 г (387.) укаэанного сое- (s, 2H), 4,64 (d, 1Н), 5,05 (s, 1Н), динения в виде масла. IH-ЯМР (CDC1 ), 5,1 (а, IH), 5,4-5,7 (m, 2Н), 5,85 ч, на млн (о): 1,43 (s, ЗН), 1,5 (s, (s, 2Н), 7,08 (а, IH), 7,35 (s, 5Н);
ЗН), 1,6 (s, ЗН), 1,66 (s, ЗН), 4,4 HK-спектр (чистый), см : 1795, 1775.