Способ выделения катепсина в из ткани почки
Иллюстрации
Показать всеРеферат
Изобретение относится к биохимии , в частности к методам выделения биологически активных веществ. Целью является повьшение выхода катепсина В и одновременного вьщеления ингибитора катепсина. Образец ткани почки подвергают аутолизу в течение 20-25 ч при температуре 37 С, гомогенизируют , гомогенат обрабатывают 3-4 мМ дитиотреитолом, центрифугируют. Полученный экстракт ткани осаждают сульфатом аммония (0,4 от насыщения ), осадок отбрасывают, белки недоосадочной жидкости вновь осаждают сульфатом аммония (0,7 от насыщения). Белки, выпадающие в осадок при такой концентрации сульфата аммония, используют для выделения катепсина В, а надосадочную жидкость после диализа - для очистки эндогенного ингибитора цистеиновых протеиназ. Последующее применение афинной хроматографии на папаин-сефарозе позволяет очистить ингибитор в 1010 раз с выходом 46%. Степень очистки катепсина В в результате хроматографии на сефадексе G-75 в 247 раз с удельной активностью 155,6 ед/мг белка.2 табл. ko
СОЮЗ СОВЕтСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
А1 (19) (11) (51) 4 С 12 И 9/50
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМ,Ф СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР по делАм изОБРетений и ОткРытий (21) 3926890/28-14 (22) 21.05.85 (46) 30.01.87. Бюл. Р 4 (71) Витебский медицинский институт (72) И.Г. Щербак и Л.Н. Кирпиченок (53) 615.45 (088.8) .(56) Жлоба А.А. и др. Биохимия, 1979, т. 44, вып. 12, с. 2218-2226. (54) СПОСОБ ВЫДЕЛЕНИЯ КАТЕПСИНА. В ИЗ
ТКАНИ ПОЧКИ (57) Изобретение относится к биохимии, в частности к методам выделения биологически активных веществ.
Целью является повьппение выхода катепсина В и одновременного выделения иигибитора катепсина. Образец ткани почки подвергают аутолизу в течение о
20-25 ч при температуре 37 С, гомогенизируют, гомогенат обрабатывают
3-4 мИ дитиотреитолом, центрифугируют.
Полученный экстракт ткани осаждают сульфатом аммония (0,4 от насыщения), осадок отбрасывают, белки недоосадочной жидкости вновь осаждают сульфатом аммония (0,7 от насыщения).
Белки, выпадающие в осадок при такой концентрации сульфата аммония, ис пользуют для выделения катепсина В, а надосадочную жидкость после диализа — для очистки эндогенного ингибитора цистеиновых протеиназ. Последующее применение афинной хроматографии на папани-сефарозе позволяет очистить ингибитор в 1010 раз с выходом 467.. Степень очистки катепсина В в результате хроматографии на сефадексе G-75 в 247 раз с удельной активностью 155,6 ед/мг белка.2 табл.
1 1286626 2
Изобретение относится к биохимии, рожно перемешивают на шейкере 2 ч в частности к методам выделения био- при комнатной температуре. Для удалелогически активных веществ. ния избытка неспецифически адсорбиЦелью изобретения является повы- рованного белка проводят последовашение выхода катепсина В и одновре- 5 тельную отмывку геля 0,5 M NaC1 в менного выделения ингибитора катеп- О, 1 M бикарбонатном буфере, рН 8,3, сина. затем — 0,5 М NaC1 в 0,01 М ацетатСпособ осуществляют следующим об- ном буфере рН 4,0 и 20 мИ калий-фосразом. фатным буфером, рН 6,0. Пригодность
Пример 50 r структурирован- 10 папаин-сефарозы контролируют по ее ной (в цельном куске) ткани почки че- способности гидролизовать БАПНА, ловека подвергают аутолизу в течение Связывание ингибитора с лигандом а
24 ч при 37 С. Затем ткань гомогене- проводят статическим методом, несвязируют в 100 мл дистиллированной во- завшиеся белки элюируют 0,02 М фосды, в гомогенат добавляют дитиотре- фатным буфером, содержащим 0,5 M хлоитол в концентрации 4 ьИ, гомогенат рида натрия. Ингибитор элюируют помещают на 2 ч в термостат при 37 С, 10 мИ соляной кислотой, затем нейзатем центрифугируют при 1500 g трализуют 0,01 í NaOH до рН 6,0. Пас30 мин при 4 С. Полученный экстракт саж супернатанта после кислотного о ткани осаждают сульфатом аммония фракционирования через колонку с па(0,4 от насыщения), осадок отбрасы- паин-сефарозой проводят 3-4 раза (до вают, а белки надосадочной жидкости исчезновения в растворе ингибируювновь осаждают сульфатом аммон (0>7 щей активности). Полученный после от насыщения). Белки, выпадающие в афинной хроматографии раствор ингиосадок нри такой концентрации суль- битора подвергают концентрированию фата аммония, используют для выделе- в диализных мешочках на сухой сахания катепсина В, а надосадочную жид- розе. Ингибирующую активность в прокость после диализа (против 50-крат- цессе выделения определяют па ингиного объема дистиллированной воды) — бированию очищенного гель-фильтрадля очистки эндогенного ингибитора
30 цией на сефадексе G-75 папаина (К.Ф. цистеиновых протеиназ. После диализа 3.4.22.2). Единица ингибирования соотпроводят кислотное фракционирование: ветствует угнетению 1 мг фермента. термообработка 20 мин при рН 2,5 и Ферментативную активность папаина и температуре 85 С, нейтрализация раст- катепсина В измеряют по расщеплению вора О, 1 н NaOH и отделение осадка 35 р-нитроанилида oc--N-бензоил-L,Ä-аргицентрифугированием при 22500 g 30 мин. нина.
Полученную надосадочную жидкость подвергают афинной хроматографии на ко- При выделении катепсина В осадок лонке 2,3 ° 1,5 см с папаин-сефарозой. после фракционирования сульфатом амОбработку BrCN-активированной сефаро- мония (0,7 до насыщения) ресуспензизы проводят строго по рекомендации руют в 0,01 М фосфатном буфере рН 6,9 фирмы-изготовителя (Farmacia Fine с 10 мИ ЭДТА и наносят на колонку
Chemidi1s): 4,0 г ВгСИ-сефарозы отмы- 5бх2,3 см/с сефадексом С-75, уравновают 800,0 мл 1 мМ НС1 и оставляют вешанную этим же буфером. В резульнабухать 1 сут на фильтре из матиро- 45 тате хроматографии получают два пика ванного стекла. Приготовление папани- ферментативной активности: первый пик сефарозы проводят по способу (Komina- содержит нетиоловые гидролазы (не
mi Е., Wakamatsu М. Biochem. and ингибируются р-хлормеркурийбензоатомBiophys. Res Commun. 1981, 99, У 2, ПХМБ в концентрации 1 мИ), фракции р. 568-575). 100 мг папаина в 0,1 И 50 второго пика, чувствительные к ПХМБ, бикарбонатном буфере с 0,5 M NaCl объединяют и обозначают катепсином В. рН 8,3 смешивают с гелем на шейкере В используемой для выделения ин2 ч при комнатной температуре. Затем гибитора надосадочной жидкости удельнесвязавшийся папаин отмывают 0,1 М ная активность ингибитора в 19 раз бикарбонатным буфером с 0,5 M Nacl S5 выше, чем в исходном экстракте ткарН 8,3. Для блокирования оставшихся, ни, выход ингибитора на этом этапе активных групп в гель добавляют составляет 34Х. Применение последую100 мл 0,2 М глицина рН 8,0 и осто- щей афинной хроматографии на папаин1286626
Формула из обретения
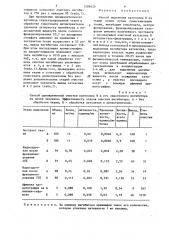
Таблица 1
Способ одновременной очистки катепсина В и его эндогенного ингибитора из почки человека. Эффективность этапов очистки ингибитора. А — без обработки ткани, Б — обработка аутолизом и дитиотреитолом.
Выход, Х
Активность, единиц/мг
АктивБелок, мг/мл
Объем, теЭтапы выделения дельная ктивень ность, всего чистки ость, диниц/мг елка единиц
Экстракт ткани А . 100 13
0,0046 6,0 100
0,06
Б 100 11
0,039 0,0036 3,9 100
Надосадочная после фракционирования
40Х
Оэ025 0 032 2 28 38
А 91 . 0,78
0,028 О, 112 2,55 65 31
Б 91 0 25
Надосадочная после фракционирования 707
0,087 2,04 34 19
Оэ 191 2в 156 55 53
А 98 0,24
Б 98 О 115
0 02
0,022
Афинная хроматография на папаин-сефарозе
1,22 0,54 9 265
Зэ 63 1 ° 79 46 1010
О, 108
0,358
А 5 О 088
Б 5 0,098
П р и м е ч а н и е. За единицу ингибитора принимали такое его количество, которое угнетало активность 1 мг папаина. сефарозе позволяет очистить ингибитор в 256 раз с выходом 97 (табл.1).
При проведении предварительного аутолиза структурированной ткани и обработке гомогената дитиотреитолом удельная активность ингибитора в надосадочной жидкости после солевого фракционирования (0,7 от насыщения сульфата .аммония) по сравнению с экстрактом ткани возрастает в 53 раза, выход ингибитора составляет 557.
При этом последующая хроматография на папани-сефарозе позволяет очистить ингибитор в 1010 раз с выходом
467, т.е. при такой обработке степень очистки ингибитора увеличивается в .4, а его выход — в 5 раз (табл. 1) . Кроме того, проведение аутолиза ткани в сочетании с обработкой гомогената дитиотреитолом без введения дополнительных стадий очистки позволяет увеличить выход катепсина
В в 2 раза (табл.2).
Способ выделения катепсина В из ткани почки путем гомогенизации ткани, инкубации гомогената, центри. фугирования, фракционирования сульфатом аммония полученного экстракта с последующей очисткой КВТЕНсННВ В методом гель-фильтрации, о т л и ч а10 ю шийся тем, что, с целью повышения выхода катепсина В и одновременного выделения ингибитора катепсина, предварительно участок ткани подвергают аутолизу в течение 20-25 часов при
15 физиологической температуре, гомогенат перед инкубацией обрабатывают дитиотреитолом в концентрации
3-4 мМ, для выделения ингибитора используют надосадочную
20 жидкость после осаждения катепсина, а очистку последнего ведут с помощью афннной хроматографии.
1286626
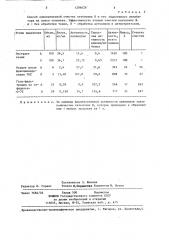
Таблица 2
Способ одновременной очистки кетепсина В и его эндогенного ингибитора из почки человека. Эффективность этапов очистки катепсина В. . А — без обработки ткани, Б — обработка аутолизом и дитиотреитолом.
Степень очистки
Белок, мг/мл
Активность, единиц/мл
АктивУдельная акВыход, 7
Объем, мл ность, всего единиц
100 36 5 14,6 0,4
Экстракт ткани
23, 12.0,63
Б 100 36 7
21,6
29,6
263
247
П р и м е ч а н и е. За единицу ферментативной активности принимали такое количество катепсина В, которое приводило к образованию 1 мкмоль продукта за 1 ч.
Составитель Л. Шилина
Техред JI.Cåðäîêîíà Корректор И. Муска
Редактор Н. Горват Заказ 7684/26
Тираж 500 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5,Производственно-полиграфическое предприятие, r. Ужгород, ул. Проектная,4
Этапы выделения
Осадок после А фракционирования 707 Б
Гель-филь трация на се- А фадексе;С-75 Б
6 2,6 57,2
5 11,48 161,8
25 0 09 9 9
29 0,158 24,7 тивность единиц/мг белка
107,2
155,6
1430 100
2312 100
343 24 54
809 35 47
248 17
717 31