Способ получения производных хинолинкарбоновой кислоты или их кислотно-аддитивных солей
Иллюстрации
Показать всеРеферат
Изобретение касается производных хинолинкарбоновых кислот (ХК), в частности соединений общей формулы I с о м (0)ORi «l3R .N(CH;) где X - Н, F, С1; ОН; или 2; R - И, С,.4-алкш1; R - С,.4 злкил, галоид- (С,. )-апкил; R, - Н; С . R4- Н, С,4-алкил; X+Rj-радикал -О-СН -СН(ОН) -, дополняющий вместе с атомами углерода и азота 1,4-оксазиновый цикл, или их кислотно-аддитивных солей, которые обладают актибактериальной активностью и могут быть использованы в медицине. Цель - создание более активных веществ указанного класса. ХК получают из соответствующих 7-бромацетила замещенного и тиоамида в среде растворителя (этанола и/или диметилформамида) при комнатной температуре. Полученный ХК (с переводят в кислоту кислотным гидролизом с последующим вьщелением целевого ХК в свободном виде или в виде кислотно-аддитивной соли с НС1. Испытания ХК показывают, что они обладают антибактериальной активностью в отношении грамположительных бактерий лучше известных веществ - эноксазина и нерфлоксазина. 2 табл. (У) : 4 х ел
СООЗ СОВЕТСНИХ
КСПУБЛИН
А3
Q9I (11) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИ1 (21) 3736502/23-04 (62) 3659626/23-04 (22) 03.05.84 (23) 03.11.83 (31) 522275 (32) 12.08.83 (33) US (46) 30.05.87, Бюл. II 20 (71) Варнер-Ламберт Компани (VS) (72) Таунли П.Кубертсон, Джон М.Домагала, Томас Ф.Мич и Джеффр Б.Николс (vs) (53) 547.789.1 831.9 867.07(088.8) (56) Патент CIUA У 4341784, кл.424256, опублик. 1982. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХИНОЛИНКАРБОНОВОЙ КИСЛОТЫ ИЛИ ИХ КИСЛОТНО-АПДИТИВНЫХ СОЛЕЙ (57) Изобретение касается производных хинолинкарбоновых кислот (ХК), в частности соединений общей формулы I -- г C(0) OR1
R.,Rq N(CHz)n б
СЮ 4С 07 D 413/10, 417/10, 498/06 // А 61 К 31/535 где Х вЂ” Н, Р, С1; ОН; п=1 или 2; К
Н, С -4 алкил; Р— С1-4 -алкил, галоид-(С, 4 )-алкил; R> — Н; С -алкил;.
Н4 Н С1- а алкил; X+R радикал
-О-СН -СН(ОНз) вЂ, дополняющий вместе с атомами углерода и азота 1,4-оксазиновый цикл, или их кислотно-аддитивных солей, которые обладают актибактериальной активностью и могут быть использованы в медицине. Цель— создание более активных веществ указанного класса. ХК получают из соответствующих 7-бромацетила замешенного и тиоамида в среде растворителя (этанола и/или диметилформамида) при комнатной температуре. Полученный ХК (с
R, — Ñ -алкил) переводят в кислоту кислотным гидролизом с последующим выделением целевого ХК в свободном виде или в виде кислотно-аддитивной соли с НС1. Испытания ХК показывают, что они обладают актибактериальной активностью в отношении грамположительных бактерий лучше известных веществ — эноксазина и нерфлоксазина.
2 табл.
1314954
Изобретение касается способа получения новых биологически активных химических соединений, а именно способа получения новых производных хинолинкарбоновой кислоты или их кислотноаддитивных солей, обладающих антибактериальной активностью. Указанное свойство предполагает воэможность применения этих соединений в медицине.
Цель изобретения — получение новых 1О
Р производных ряда хинолина, обладающих повышенной актинностью в отношении грамположительных бактерий.
Пример 1. 7- (2-(Аминометил)4-тиазолил) -1-этил-б-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота.
Суспензию 0,59 г (1,54 ммоль) этилового эфира 7-бромацетил-1-этил-6фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты в 4 мл N,N-диметил- 20 формамида обрабатывают 0,22 r (1,67 ммоль) ацетамидотиоацетамида.
После перемешинания н течение 3 ч смесь обрабатывают 0,22 мл (1,58 ммоль) триэтиламина, перемешинают 1 ч и вы25 ливают в 40 мл ледяной воды. Осадок отфильтровывают, промывают водой и сушат с получением 0,45 г сырого твердого вещества. Хроматография на колонке с 20 г силикагеля с помощью хлороформа и этанола (9:1) и кристаллизация из этанола дает 0,37 г этилового эфира 7-(?-(ацетамидометил)-4тиазолил1-1-этил-б-фтор-1,4-дигидро4-оксо-3-хинолинкарбоновой кислоты, 35 т. пл. 230-233 С (разл.).
Раствор О, 32 r (О, 76 ммоль) этиловогоо эфира 7- (2-(ацетамидометил)-4тиазолил1 — 1-этил-б-фтор-1,4-дигидро- 40
4-оксо-3-хинолинкарбоновой кислоты в 3 мл 6 н. хлористоводородной кислоты перемешивают при кипении с обратным холодильником н течение 3 ч.
Смесь упаринают до сухого остатка и 45 результирующее твердое вещество суспендируют в 5 мл воды и растворяют добавлением 1 н. гидроокиси натрия до рН 11. После фильтрования продукт осаждают добавлением 1 н. хлористоно- 5О дородной кислоты до рН 6,2, фильтруют, промывают водой и сушат с получением 0,22 г 7- (?-аминометил)-4-тиазолил) -1-этил-б-фтор-1,4-дигидро-4оксо-3-хинолинкарбоновой кислоты, т.пл, 249-254 С (разл.) .
Пример ". 7- (2-(метиламинометил)-4-тиазолил1 — 1-этил-б-фтор-1,4дигидро-4-оксо-3-хинолинкарбоновая кислота.
По методике примера 1 взаимодействие этилового эфира 7-бромацетил-1этил-б-фтор-1,4-дигидро-4-оксо-З-хинолинкарбоновой кислоты с 2-(N-ацетилN-метиламино) тиоацетамидом в этаноле дает этиловый эфир 1-этил-6-фтор-72-(N-ацетил-N-метиламинометил)-4тиазолил1 -1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты (т.пл. 173о
175 С), который затем.гидролиэуют н кипящей с обратным холодильником 6 н, хлористонодородной кислоте с получением целевого соединения т.пл. 230о
?34 С (разл.) .
Вычислено, 7: С 56,50; Н 4,46;
N 11,63.
C,,H„N,Ã0,S
Найдейо, 7.: С 56,26; Н 4,56;
N 11,40.
Пример 3. 7-(2-(Этиламинометил)-4-тиазолил1- 1-этил-б-фтор-1,4дигидро-4-оксо-3-хинолинкарбоновой кислоты гидрохлорид.
По методике примера 1 взаимодействие этилового эфира 7-бромацетил1-этил-б-фтор-t,4-дигидро-4-оксо-3хинолинкарбоновой кислоты с 2-(N-ацетил-N-этиламино) тиоацетамидом в этаноле дает этиловый эфир 1-этил7- (2- ((-ацетил-N-этиламино)метил 4-тиазолил1 †.б-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, о т. пл. 160-161 С, который затем гидролизуют н кипящей с обратным холодильником 6 н. хлористоводородной кислоте с получением целевого соединения, т.пл. 289-300 С (разл.).
Вычислено, 7.: С 51,81; Н 4,73;
N 10,07; С1 8 50.
С,ЬН, 11 С1ГО ЯО. ЗН О
Найдено, 7: С 51,81; Н 4,79;
N 10,09; С1 8,49.
Пример 4. 1-Этил-б-фтор-1,4дигидро-7-(2-(((2-гидроксиэтил) амино) метил) -4-тиазолил)-4 — оксо-3-хинолинкарбононой кислоты гидрохлорид.
По методике примера 1 взаимодействие этилового эфира 7-бром-ацетил1-этил-б-фтор-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты с 2- (М-(2ацетоксиэтил)-N-ацетиламино1тиоацетамида в этаноле дает этиловый эфир
1-этил-б-фтор-1, 4-дигидро-7- (2-(f N(2-ацетоксиэтил) -N-ацетиламино) метил) -4-тиазолил)-4-оксо-3-хинолинкаро боновой кислоты, т. пл. 148-152 С, 3 13149 повторно превращают в твердое вещество и плавят при 164-165 С, гидролизуют кипящей с обратным холодильником
6н.хлористоводородной кислотой с получением целевого соединения, т.пл.
290 С (разл.).
Вычислено, 7: С 50,76; Н 4,02;
N 9,87.
Е 3
Найдено, 7: С 50,36; Н 4,50; N9,66. !0
Пример 5. 7-2-(1-Аминоэтил)4-тиазолил-!-этил-б-фтор-1,4-дигидро4-оксо-3-хинолинкарбоновая кислота.
По методике примера 1 взаимодействие этилового эфира 7-бром-ацетил- !5
1-этил-б-фтор-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты с 2-(ацетиламино)-тиопропионамидом в этаноле дает этиловый эфир 7- (?-(1 †(N-ацетиламино)этила-4-тиазолил) — 1-этил-6- 20 фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, т. пл. 236-238 С, который гидролизуют кипящей с обратным холодильником 6 н.хлористоводородной кислотой с получением целевого 25 соединения, т. пл. 246-250 С (разл.).
Вычислено, 7.: С 55,94; Н 4,53;
N 11,51.
С Н ь ИзРО Б 0,2 НгО
Найдено, X: С 55,92; Н 4,51; 30
N 11,68.
Пример 6. 7- (2-(Аминометил)4-тиазолил1 — 1-этил-6,8-дифтор-!,4дигидро-4-оксо-3-хинолинкарбоновая кислота. 35
К 800 мг (1,99 моль) 7-бромацетил1-этил-6,8-дифтор-1,4-дигидро-4-оксо3-хинолинкарбоновой кислоты в смеси
N N-диметилформамида и этанола добавляют 446 мг (1,0 экв.) 2-(N-бенэилок- 4р сикарбонил) аминотиоацетамида. Смесь перемешивают .в течение 72 ч при комнатной температуре. Смесь добавляют к воде со льдом и твердое вещество отфильтровывают с получением 0,92 r 45
1-этил-6,8-дифтор-1,4-дигидро-4-оксо7-(2- !(фенилметокси) карбониламинометил)-4-тиазолил) -3-хииолинкарбоновой кислоты, т. пл. 185-!90 С. Без дополо нительной очистки твердое вещество 50 обрабатывают бромистоводородной кислотой в уксусной кислоте на протяжении ночи и выливают в эфир/этилацетат. Фильтрование дает твердое вещество, которое растворяют в водном ам- 55 миаке при рН 10,8. Концентрирование этой смеси до трети объема и фильтрование дает 0,46 г 7-(?, †(аминометил)—
54 4
4-тиазолил1 — 1-этил-6, 8-дифтор-1, 4дигидро-4-оксо-3-хинолинкарбоновой о кислоты, т. пл. 199-203 С.
Аналогичным путем получают следующие соединения:
1-Этил-6,8-дифтор-1,4-дигидро-7(2- (метиламино)метил) -4-тиазолил)—
4-оксо-3-хинолинкарбоновая кислота, т. пл ° 172-174 С (разл.) (6a).
7- (2- ((Этиламино)метил -4-тиазолил)-1-этил-6,8-дифтор-1,4-дигидро4-оксо-3-хинолинкарбоновая кислота, т. пл. 155-157 С (6b).
7- (2-(Аминометил)-4-тиазолил)-6, 8-дифтор-1 †(2-фторэтил)-1,4-дигидро4-оксо-3-хинолинкарбоновая кислота, т. пл. 216-218 С (бс).
6,8-Дифтор-1 — (2-ф горэтил) — 1, 4-дигидро-7- (?- ((Meтиламино) метил)-4тиазолил)-4 оксо-3-хинолинкарбоновая о, кислота, т. пл. 214-215 С (6d) .
7- (2- (Этиламино)метил) -4-тиазолил)-6,8-дифтор-1-(2-фторэтил)-1,4дигидро-4-оксо-3-хинолинкарбоновая кислота, т. пл. 197-201 С (бе).
10-(?.-(Аминометил)-4-тиазолил)-9фтор-?,3-дигидро-3-метил-7-оксо-7Нпиридо (1,2,3-де) -1,4-бензоксазинкарбоновая кислота, т.пл. 229-231 С ,(6r) .
Пример 7. 7-(2- (Аминометил)4-тиазолпл) — 1-атил-б-фтор-1,4-дигидро-8-метиламино-4-оксо-3-хинолинкарбоновая кислота.
К 500 мг (1,37 ммоль) 7-(2-(аминометил)-4-тиазолил1-1-этил-6,8-дифтор1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты добавляют 15 мл 50Х.-ного водного метиламина. Смесь нагревают о при 50 С в течение 72 ч. Раствор д годят до рН 6 5 и фильтруют с получением 350 мл 7-(2-(аминометил)-4-тиаэолил) — 1-этил-6-фтор-1,4-дигидро-8метиламино-4-оксо-3-хинолинкарбоновой кислоты, т. пл. 194-195 С.
Пример 8. 1-Этил-6-фтор-1,4дигидро-8-метокси-"; — t - ((метиламино) метил) -4- гиазолил) -4-оксо-3-хинолинкарбоновая кислота.
К 500 мг (1,32 ммоль) 1-этил-6,8дифтор-1,4-дигидро-7- (2- ((метиламино) метил)-4-тиазолил) -4-оксо-3-хинолинкарбоновой кислоты н 30 мл сухого метанола добавляют 300 мг (2 экв.) трет-бутилата калия. После 24-часового кипения с обратньи холодильником смесь охлаждают, разбавляют водой, доводят до рН 6,0 и фильтруют с полу13
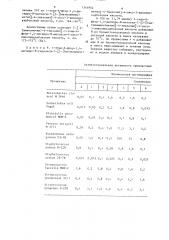
Минимальная ингибирующая
Соединение
Х I
Организмы
А 1 2 3 4 5 6
Entегоbacter cloacal М 2646 0,05 О,l 0,4 1,6 6,3 1,6 0,1
Escherichia coIi
Vogel
0013 005 02 02 1,6 08 0013
Klebsiella pneumonial MGH-2
0 05 0 05 0 4 0 4 3 1 0 8 0 1
Proteus rettgeri
М 1771
0,05 0,2 0,4 1,6 12,5 3,1 0,2
Ps eudomonas ae ruginosa UI-18 0,05 1,6 6,3 12,5 100 25
0,8
Staphylococcus
aureus Н-228
0,8 О,1 0,4 0,05 0,8 1,6 0,1
Staphylococc
aureus US-76
0,025 0,013 0,1 0,025 0,2 0,2 0,025
Streptococcus
faecalis MGH-2
1,6 0,2 0,8 0,4 0,8 1,6 0,2
Streptococcus
pneumonial SV-1
0,4 О, 4 0,8 0,4 0,4 3,1 1,6
Streptococcus
pyogenes С-203
0 4 3 1 1,6 О B 0 4 6 3 3 1 чением 310 мг 1-этил-б-фтор-1,4-дигидро-8-метокси-7- (2- ((метиламино) метил) -4-тиазолил) -4-оксо-3-хинолинкарбоновой кислоты, т.пл. 164-166 С. о
Аналогичным путем получают 7- (2(аминометил) -4-тиазолил) — 1-этил-6фтор- 1,4-дигидро-8-метокси-4-оксо-3хинолинкарбоновую кислоту, т. пл.
172-175 С (8а) .
Пример 9. 1-Этил-6-фтор-1,4дигидро-8-гидрокси-7- (?- ((метиламино) 14954 6 метился-4-тиазолил)-4-оксо-3-хинолинкарбоновая кислота.
К 700 мг (1,79 ммоль) 1-зтил-6фтор-1,4-дигидро-8-метокси-7- (2-f(Метиламино)метился-4-тиазолил) -4-оксо3-хинолинкарбоновой кислоты добавляют
8 мл бромистоводородной кислоты в уксусной кислоте и смесь нагревают до 70 С. По прошествии 4 ч добавляют
10 еще 8 мл бромистоводородной кислоты и смесь перемешивают в течение ночи.
Твердое вещество собирают, растворяют в водном аммиаке и концентрируют
Антибактериальная активность производных
Аналогичным путем получают 7- (?(аминометил)-4-тиазолил) — 1-этил-6фтор-1,4-дигидро-8-гидрокси-4-оксо3-хинолинкарбоновую кислоту, т. пл.
275-277 С (9а).
Новые производные хинолинкарбоновой Кислоты проявляют антибактериаль Таблица1 хиноликарбоновой кислоты in vitro концентрация МНК, мкг/мл
6d 6е 6f 7 8 8а 9 9а
Ов2 Ою! Оэ8 Ою2 Оь2 Оэ8 Оэ! 0,8 0,8 3,1 3,1
0,013 0,05 0,4 0,05 0,2 0,4 0,025 0,2 с0,1 0,8 с0,1
Оэ! Оэ! Оэ4 Ою! Оэ8 0)8 Ов2 Оэ8 0)4 3,1 0,4
0,8 0,4 0,4 0,2 0,8 1,6 0,2 6,3 1,6 3,1 6,3
3,1 6,3 6,3 3,1 6,3 бтЗ 3,1 50 6,3 12,5 25
0,2 0,1 0,8 0,2 0,4 0,4 0,4 0,4 0,8 (0,05 0,1
005 005 (О,! 0025 <005 а0,1 0,1 0,2 <О,! ñ005 (0,1
0,8 0,4 0,4 0,2 0,4 1,6 0,4 3,1 1,6 0,2 <О,!
3,1 1,6 6,3 3 1 1,6 6,3 3,1 6,3 6,3 0,8 0,8
3,1 1,6 3,1 1,6 3,1 1,6 3,1 6,3 6,3 1,6 1,6
7 1314954 8 до четверти объема. Фильтрование дает ную активность. Испытания актибакте580 мг 1-этил-6-фтор-1,4 дигидро-8- риальной активности проводили методом гидрокси-7-(7- ((метиламино)метил) -4- микротитрационного разбавления. тиаэолил) -4-оксо-3-хинолинкарбоновой о кислоты, т.пл. 242-246 С ° При использовании этого метода были получены следующие значения минимальной ингибирующей концентрации (МИК, мкг/мл) для соединений примеров
1-9 и известного соединения — 7-(31О амино- 1-пирролидинил)-1-этип-6-фтор1,4-дигидро-4-оксо-1,8-нафтиридинкарбоновой кислоты (соединение А).
Результаты предтавлены в табл.1.
14954 1О
В табл.2 представлены данные по антибактериальной активности соединения примера 6Ъ в сравнении с эноксаэином и нерфлоксазином. Из табл.2 видно, что соединение примера 6Ь обладает более высокой активностью в отношении положительных бакте рий.
Т а б л и ц а 2
Минимальная подавляющая концентрация МИК, мкг/мл
Эноксаэин Норфлоксаэин
Соединение по примеру 6b
Микроорганизмы
Entегоbacter MA 2646
Escherichia coli Vogel
0,1
0,2
0,1
0,05
0,05
0,05
Klebsiella pneumonial
МС-2
0,2
0,1
0,1
Proteus rettgeri М 1771
0,4
0,2
О,!
Pseudomonas aeruginosa
UI 18
6,3
0,2
0,2
Staphylococcus aureus
Н-228
1,6
0,1
0,8
Staphylococcus aureus
US-76
0 05
0,2
0,1
Streptococcus faecalis
MGH-2
Оэ!
3,1
1,6
Streptococcus pneumonial
SV-1
0,8
3,1
1,6
Streptococcus pyogenes
С-203
0,4
3,1
0,8
Новые производные хинолинкарбоновой кислоты в используемых концентрациях не проявляют признаков токсичности.
Способ получения производных хинолинкарбоновой кислоты общей формулы
Г С02В!
1Ч
"-ФЖп-», 9 13
Как следует иэ табл.1, новые производные хинолинкарбоновой кислоты проявляют активность как в отношении грамотрицательных, так и грамположительных бактерий. При этом они обладают более высокой активностью в отношении грамположительных бактерий— стафилококков и стрептококков.
Формула изобретения где Х вЂ” атом водорода, фтора или хлора или гидроксигруппа;
n = 1 или 2;
R — атом водорода или С,-С4-алкил;
R — С, -С -алкил или галоид(С, -Cp) -алкил; .R — атом водорода или С,-С4-алкил;
R4 — атом водорода или С< -С -алкил, или Х вместе с R образуют радикал
-О-СН -CH1
Ф
CCH
14954 l2
S ън,-с — сн,си, „ы
4 вз
R сор
Врсн.,-с .где Х, R имеют указанные значения;
R имеет значения, укаэанные для
R, кроме атома водорода, подвергают взаимодействию с тиоамидом формулы III
Составитель H.Êànèòàíîâà
Техред Л.Сердюкова Корректор С,Черни
Редактор М.Петрова
Заказ 2224/58 Тирам 372 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
ll 13 дополняющий вместе с атомами углерода и азота, с которыми он связан, 1,4-оксазиновый цикл, (или их кислотно-аддитивных солей, о т л и ч а ю— шийся тем, что соединение формулы II
Г где n R u R имеют указанные эначе° з ния, в среде инертного растворителя, такого как этанол, диметилформамид или их смесь, при комнатной температуре, получают целевой продукт формулы I где R, -С,-С„-алкил, или переводят его в соединение формулы I где R — атом водорода, путем кислотного гидролиза и выделяют целевой продукт в свободном виде или в виде
его кислотно-аддитивной соли с галоидводородной кислотой.