(22r, 23r, 24s)-22,23-диокси-24-этил- @ -холест-2-ен-6-он в качестве промежуточного продукта в синтезе (24s)-24- этилбрассинона и способ его получения
Иллюстрации
Показать всеРеферат
Изобретение относится к стероидному соединению , в частности к получению (22R, 23R,
(CA
СОЮЗ СОВЕТСКИХ
СОЦНАЛИСТИЧЕСКИХ РЕСПУБЛИК
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР) К АВТОРСКОМУ СВИДЕПЛЬСТВУ (21) 3895438/04 (22) 14.05 85 (46) 30.1193 Бюл. Мо 43 — 44 (71) Институт биоорганической химии AH БССР (72) Пахвич ФА; Хрипач ВА; Ковганко Н.В.; Жабинский В.Н. (54) (22R, 2ЗЙ, 24S)-22,23-ДИОКСИ24-ЭТИЛ- 5а -ХОЛЕСТ-2-EH-8-0Н 8 КАЧЕСТВЕ ПРОМЕЖУТОЧНОГО ПРОДУКТА В
СИНТЕЗЕ (24S)-24- ЭТИЛБРАССИНОНА И
СПОСОБ ЕГО ПОЛУЧЕНИЯ (57) Изобретение относится к стероидному соединению, в частности к получению (22R, 23R, 24S)-22ЯЗ-диокси-24-ave-5 5к -холест-2-ен(1 ) SU (11) U63830 Al (51) ОО
6-она (XH), который может быть использован в ка— честве промежуточного продукта в синтезе (24S)-24-этилбрассинона (ЭБ) — высоко активного ростостимулирующего вещества. Синтез ХН ведут последовательной обработкой (22R, 23R, 24$)-2223-эпокси-24-этип-5 5а -холест-2-ен6-она бромистоводородной кислотой, хлористым ацетоном,.ацетатом калия при кипячении в водной концентрированной уксусной кислоте, гидроокисью калия в метаноле при кипячении с последующим выделением ХН. При использовании ХН упрощается процесс получения ЭБ за счет. сокращения числа стадий с повышением выхода ЗБ до 99%. 2 с.п.фlib|.
1363830
Изобретение относится к новому химическому соединению (22К, 2ЗН, 24$)-22,23диокси-24-атил-5а-хелест-2-ен-6-ону формулы 1
on являющемуся полупродуктом в синтезе природного брассиностероида (24S)-24- 15 этилбрассинона, который обладает высокой активностью D качестве стимугятора роста рас-ений, и способу погучения соединения
1.
Цель изобретения — получение нового 20 полупродукта в синтезе 24(S)24-этилбрассинона из стигмастерина, что позволяет упростить процесс и увеличить выход конечного и родукта.
Пример 1. Получение (22R, 23R, 25
24S)-22,23-диокси-24-атил-5а -холест-2-ен6-она (1).
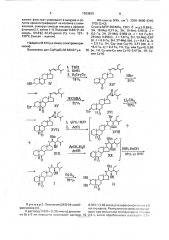
За,5-Цикло-24S-snsn-5а -холест-22-ен6-он (XlY) получают из стигмастерина (!У) по известному методу. 30 (22R, 238; 24$)-З Р-Бром-22,23-эпокси24-атил-5 а-холест-6-он, К раствору 6,91 г
{12,0 ммоль) З,о-бромкетона (XY) в 25 мл метиленхлорида приливают раствор 2,40 r (14,0 ммоль) метахлорнадбензойной кисло- 35 ты в 25 мл метиленхлорида. Реакционную смесь выдерживают г1ри комнатной температуре в течение 20 ч, затем промывают насыщеннь1м раствором бикарбоната натрия. Органический слой отделяют и фильт- 40 руют через окись алюминия. Фильтрат выпаривают в вакууме, остаток подвергают колопочной хроматографии на силикагеле при элюировании смесью гексана с эфиром (15:1), Получают наряду с 0,93 r (1,9 ммоль) 45 не вступившего в реакцию ЗР-бромкетона
XY 2,63 r(5,,2 ммоль, 51,4%), 22,23-эпоксида (XYi); т,пл, 149 — 151 С (гексан — ацетон).
Найдено, %: C 68,70; Н 9,10; Br 16, 18.
C2gH470gBr 50
Вычислено, %: С 68,62; Н 9,33; Br 15,74, М 507,60 у.е, ИК-спектр (КБг, см "): 1705 (С=О), Спектр ПМР (360 мГц, CDCb, д, м.д.):
0,67 (с„ЗН, 18-Ме); 0,80 (с„ЗН, 19-Me); 0,93 55 (d, J = 7 Гц, 6Н, 26/27-Me); 0,96 (т, Л = 7 Гц, 3Н, 29-Ме); 1,02 (d, J =5,4 Гц, ЗН, 21-Ме); 2,33 (11 = 14 Гц, Jg =-4 Гц, 1Н, С -На); 2,50(м., 1Н, Сл-Н); 2,74 (dd, Ji = 7,5 Гц, Jz = 2,4 Гц, 1Н, Сгз-H); 3,94 (м„5!/2 27 Гц, 1Н, Сз-На).
Масс-спектр . 508 (M + 1), 506 (M — 1). (22R, 23R, 24S)-22,23-Эпокси-24-атил-5 ахолест-2-ен-6-îí (XYll). Смесь 2,65 г (5,2 ммоль) ЗР -бром-22R,23R-эпокси-б-кетона (XYl) и 4,0 г (54,1 ммоль) карбоната лития кипятят в 60 мл диметилформамида в тече ние 1,5 ч. Реакционную смесь охлаждают до комнатной температуры; выливают в воду и экстрагируют хлороформом, Хлороформный.экстракт промывают 20%-ным раствором уксусной кислоты, затем водой и фильтруют через слой силикагеля. Фильтрат упаривают в вакууме, остаток хроматографируют на колонке с силикагелем, элюируя смесь|о петролейного эфира с эфиром (8:1).
Получают 1,56 r (3,66 ммоль, 70%) Л -соединения (XYli); т.пл. 102-104 С (этанол). . Найдено М 426 у.е, (масс-спектрометрически).
Вычислено для С29Н ж02 M 426.67 у.е.
ИК-спектр {KBr, см ): 1705 (С=О).
Спектр МПР (360 МГц, COMig, м.д.); 0,68 (с., 3H, i8-Me); 0,71 (с., ЗН, 19-Ме); 0,93 (д„
J =-6,6 Гц, 6Н,26/27-Ме); 0,96(т„З = 7,8 Гц, 3Н, Ме); 1,03 (д„Л = 6,0 Гц, ЗН, 21-Me); 2,36 .(д.д„11 = 14 Гц,,Ь = 4,2 Гц, 1Н, С5-На); 2,48 (д.д., 31 = 6,6 Гц,,32 = 2,1 Гц, 1Н, С2з-Н); 2,73 (д.д,, J1 = 7,2 Гц,,) 2 = 2,4 Гц, 1Н, С22 Í); 5,57 (и„1Н, Сг- или Сз-Н); 5,69(м„1Н, С- или С-Н). (228. 23R. 24$)-22,2З-Диокси-24-этил-5а
-холест-2-ен-6-он (1), К раствору 0,947 r (2,2 ммоль) соединения, полученного на предыдущей стадии, в 10 мл хлороформа приливают 25 мл уксусной кислоты (ч.д.а.) и 10 мл
48%-ной бромистоводородной кислоты.
Смесь перемешивают при комнатной температуре в течение 2 ч. затем выливают в воду и экстяагируют хлороформом. Органический слой промывают водой, пропускают через слой силикагеля, затем упаривают.
Остаток растворяют в 25 мл ацетилхлорида и выдерживают в течение 5 дней при комнатной температуре, Растворитель упаривают, остаток растворяют в 50 мл конц, уксусной кислоты и 10 мл воды, Прибавляют
3,0 r ацетата калия и реакционную смесь кипятят с обратным холодильником в течение 22 ч, после чего упаривают в вакууме, Остаток растворяют в 50 мл 10%-ного раствора гидроокиси калия в метаноле и кипятят с обратным холодильником в течение 1 ч. После охлаждения до комнатной температуры реакционную смесь обрабатывают 15 мл уксусной кислоты (ч.д.а.), затем упариваютдо 1/3 первоначального обьема и экстрагируют хлороформом. Хлороформный экстракт отфильтровывают через слой сили! 363830
HBr
95% 7Q a/
ЖСВВА
М О/о
70%
18% -Н.Ч
K. АсС1
Л® Ф
ЛсОН
65% из ХУЦ
Og О „
НО
9 fa
Пример 2. Получение (24S)-24-этилб- 0,363 r (1,43 ммоль) четырехокиси осиял в 5 расси нона (I I)., мл пиридина. Реакционную смесь вь;д<ьр.киК раствору 0,605 г(1,36 ммоль) диоксие- вают при комнатной температуре в тв.",ение на (I) в 5 мл пиридина приливают раствор. 15 2,5 ч, затем обрабатывают раствор." ".0 r кагеля, фильтрат упаривают в вакууме и остаток хроматографируют на колонке с силикагелем, элюируя смесью гексана с эфиром (сначала 2:1, затем 1:1). Получают 0,64 г(1,44 ммоль, 64,8 ) 22,23-диола (1); т.пл. 137- 5
139 С (гексан — ацетон).
Найдено M 444 у.е. (масс-спектрометрически), Вычислено для СгэН аОз М 444,67 y,å. 10
ИК-спектр (KBr, см ): 3300-3600 (ОН);
1705 (С=О).
Спектр МПР 360МГц, СОС1,д, м.д.): 0,69(с„
ЗН, 18-Me); 0,71 (с., ЗН, 19-Me); 0.90 (d, J
6,0 Гц, ЗН, 21-Me); 0,956 (d, J - 6,6 Гц,ЗН, 26-Me); 0,959 (т., 3 - 7,8 Гц, 3 H. 29-Me); 0,97 (d, J - 6,6 Гц. ЗН, 27-Me), (dd, J > - 8,4 Гц, Jz
- 2,0 Гц, 1Н, Сгг или Сгз-И); 3,71 (dd, J>
-8,4 Гц, Jz-2,4 Гц, 1Н, Сгг- или Сгз-Н): 5,56 (м„1Н, Cz- или Сз- или Сз-Н); 5,67 (м., 1Н. Сгили Сз-Н).
1363830 сульфита натрия и 0,4 мл серной кислоты в
40 мл воды в течение 40 мин при комнатной температуре. Смесь выливают в воду и экстрагируют хлороформом. Хлороформный экстракт фильтруют через слой силикагеля, затем упаривают в вакууме и.получают 0,645
r {1,35 ммоль, 99® (24}24-этилбрассинона. т.пп. 253 — 256 С (этанол).
Формула изобретения в качестве промежуточного продукта в син-тезе (24S)-24-атил брассинона.
1. {228, 23В, 243) 22,23-Д окси-24"атил- . 2 Сп об и л e„„„(22R 23 245 22,23-диокси-24-атил-5-холест-2-ен-б-она, заключающийся в том, что (22R, 23R, 24S)22,23-эпокси-24-этил- 5а -холест-2-ен-6-он последовательно обрабатывают бромисто30 водородной кислотой, хлористым ацетилом, затем при кипячении ацетатом калия в концентрированной уксусной кислоте, затем гидроокисью калия в метаноле при кипячении с последующим выделением целевого продукта.
Составитель И.Федосеева
Редактор Л.Герасимова Техред M.Ìîðãåíòàë КоРРектоР Л.©иль
Тираж Подписное
НПО "Поиск" Роспатента
113035, Москва, Ж-35, Раушская наб., 4/5
Заказ 3334
Производственно-издательский комбинат "Патент", г. Ужгород, ул.Гагарина. 101
Найдено М 478 у.е. (масс-спектрометрически).
Вычислено для С29Нво05 М 478,7 у.е.
ИК-спектр (KBr, см ). 3200-3660 (OH);
1705(С-0). Спектр ПМР(360 МГц, СОС!з, д, м.д.): 0,68 {с., ЗН, 18-Ме); 0,76 (с., 3 Н. 19-Ме);
0,91 (d, 3 - 6,6 Гц, 3Н, 26-Ме); 0,946 (т., J7,8 Гц, ЗН, 29-Ме); 0,953 (d, J.- 6,0 Гц, ЗН, 21-Ме); 0,966 (d, J - 6,7 Гц, ЗН,. 27-Ме); 2,68 (dd, J1 12,6 Гц, Jz = 3,0 Гц, 1Н, С5-На); 3,58 (d J 8,4 Гц, 1Н, Сп-Н); 3,68 — 3.80(м., 2H
Сэ-HP u Czs-Н); 4.04 (м., Ю/2 8 Гц, 1Н, С -Н). (56) Takatsuto S., lasawa N.. Morlshlta, Abe Н.
Synthesis of (24R)-28-Homobrassinollde
5 anaboques and structure — activity
relationship of brassInostегоids In the rlcelamlna lndlnatlon test. Phytochemistry, 1983, ч. 22, Ь 6, р. 1393-1397.
Takatsuto S., lkekawa N. Synthesis and
10 activity of plant-growth promoting stегоids, with modification in ring А and ВЛ. Chem Soc., Perkln Trans, 1, 1984, N. 3, р. 439 — 447.
Авторское свидетельство СССР
O 1162816, кл. С 07 J 9/00, 1981;.
15 А.А.Ахрем, Ф.А.Лахвич, B.À.Õðèïà÷, Н.B.Êîâãàíêî, В,Н.Æàáèícêèé. Новый синтез (22S, 233)-28-гомобрассинолида, — ДАН
СССР,: 283(1), 130-133 (1985).