Способ определения активности фосфолипазы а @
Иллюстрации
Показать всеРеферат
Изобретение относится к области биохимии и биотехнологии,в частности к определению активности одного из важнейших ферментов липидного метаболизма - фосфолипазы А{. Целью изобретения является повьшение точности и упрощение способа определения . Способ осуществляется путем добавления в измерительную кювету спектрофотометра , содержащую мицеллярную форму субстрата яичный лецитин и холат натрия в соотношении 1:2-4 , анализируемой фосфолипазы и кофакто- .ра-соль кальция, а в контрольную кювету - раствора гемоглобина и регистрации разностных спектров на двухлучевом спектрофотометре. При этом интенсивность спектра между максимумом при 423 нм и минимумом при 405 нм пропорциональна количеству жирной кислоты , освобождаемой в результате ферментативной реакции. Отличительным признаком способа является специфичность комплексообразования жирной кислоты с гемоглобином, приводящего к изменению спектральных характеристик гемопротеидао 3 ил ш со
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН
ОПИСАНИЕ ИЗОБРЕТ
Н А BTOPCH0MV СВИДЕТЕЛЬСТВУ
:В»
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 4065829/31-13 (22) 10,02.86 (46) 07.01.88, Бюп. Р 1 (71) Институт биоорганической химии
АН БССР (72) Н.М.Литвинко, Г,М,Андреюк, M.À.ÊHcånü и.П.А.Киселев (53) 577.15 (088.8)
1 (56) Haas G.Í.De, Postema N.М., Ni euri enhui zen W., Deenen van, Purification and properties of
phospholipase А from porcine pancreas. — Bioch. Biophys. Acta, 1968, v. 159, р, 103-117, (54) СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ
ФО СФОЛИПАЗЫ А, (57) Изобретение относится к области биохимии и биотехнологии, в частности к определению активности одного из важнейших ферментов липидного метаболизма — фосфолипазы А . Целью
„„Я0„„1364634 А 1 изобретения является повышение точности и упрощение способа определения. Способ осуществляется путем добавления в измерительную кювету спектрофотометра, содержащую мицеллярную форму субстрата яичный лецитин и холат натрия в соотношении 1:2-4 анализируемой фосфолипазы и кофакто,ра-соль кальция, а в контрольную кювету — раствора гемоглобина и регистрации разностных спектров на двухлу" чевом спектрофотометре, При этом интенсивность спектра между максимумом при 423 нм и минимумом при 405 нм пропорциональна количеству жирной кислоты, освобождаемой в результате ферментативной реакции. Отличительным признаком способа является специфичность комплексообраэования жирной кислоты с гемоглобином, приводящего к изменению спектральных характеристик гемопротенда. 3 ил.
1 13646
Изобретение относится к биохимии и биотехнологии, а именно к определению активности одного из важнейших ферментов метаболизма липидов — фосфо- липазы А
Цель изобретения - упрощение способа определения активности фосфолипазы Aã
Способ заключается в том, что анализируемую пробу, содержащую фосфолипазу А, помещают в одну из кювет, в которых находятся мицеллярная форма субстрата (яичный лецитин и холат натрия в соотношении 1:2-4), кофактор — соль кальция и гемоглобин, с последующей регистрацией разностных спектров гемопротеида на двухлучевом спектрофотометре. При этом интенсивность спектра между максимумом при 20
423 нм и минимумах при 405 нм пропорционапьна количеству жирной кислоты, освобождаемой в результате ферментативной реакции.
Пример 1. К 4 мг димиристоил- 25 фосфатидилхолина приливают 0,04 мл
20%-ного холата Na (молярное соотношение липид/детергент 1:4) и 12,8 мп
0,01 M три -HC1 рН 7,4 интенсивно встряхивают, добавляют 0,12 мп 30
0,1 М CaCl и 1,2 мл раствора гемоглобина (3,37.10 M) в 0,01 M трисНС1, рН 7.4. В опытную и контрольную кюветы помещают по 2 мл реакционной смеси, прописывают нулевую линию на 35 приборе Specord, Реакцию начинают добавлением в опытную кювету 22 мкл раствора фермента (исходная концентрация фермента 0,011 мкг/мл ), через
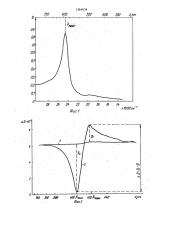
2,4,6,8 и 10 мин регистрируют и.=мене- 40 ния интенсивности между максимумом и минимумом в разностном спектре гемоглобина, На фиг.1 показано изменение интенсивности между максимумом и минимумом, которое через 2,4,6,8 и 10 мин равно 0,02 Э, 0,035В, 0,06Р,"
0,1Р, 0,14513 соответственно, Наблюдают рост интенсивности между максимумом и минимумом в разностном спектре гемоглобина в зависимости от времени ферментативной реакции(фиг,l).
Пример 2, Построение калибровочной кривой, К 4 мг димиристоилфосфатидилхолина приливают 0,04 мп
20% холата Na (молярное соотношение липид детергент 1:4), 12,8 мп 0,01 М трис-НС1 рН 7,4 интенсивно встряхивают, добавляют 0,12 мл 0,1 M СаС1 м
34 2 и 1,2 мп раствора гемоглобина (3 37»
«10 M) в 0,01 М трис-НС1 буфере рН 7,4 (конечная концентрация гемоглобина 2,9 10 М), В опытную и контрольную кюветы помещают по 2 мл реакционной смеси, прописывают на приборе Specord нулевую линию. Реакцию начинают добавлением в опытную кювету возрастающего количества фермента " 2,4,8,12,18 мкп (исходная концентрация ФЛА 0,011 мкг/мкл).
Через 10 мин записывают изменение интенсивности между максимумом и минимумом в раэностном спектре гемоглобина в каждом случае отдельно.
Сразу же реакцию останавливают добавлением 0,1 мп 0,25 M ЭДТУ для того, чтобы провести параллельно определение активности фермента уже известным хроматографическим способом.
Для этого к содержимому опытной кюветы добавляют двойной объем смеси хлороформа с метанолом в соотношении 2:1, интенсивно встряхивают 510 мнн, центрифугируют 10 мин при
3000 об/мин, нижний хлороформный слой .отбирают, упаривают и.продукты реакции — ЛФХ, ФХ и жирные кислоты— разделяют с помощью тонкостойной хроматографии на силикагелевых пластинах в системе растворителей хлороформ. метанол Н О (65;25:4 V/V).
Пятна, соответствующие лизодимиристоилфосфатидилхолину (ЛФХ) и димиристоилфосфатидилхолину (ФХ), проявляют в парах I, отмечают их границы, дают испариться. Пятна выскребают. Затем проводят количественное определение неорганического фосфата по методу Васьковского. К пробам добавляют 0,2 мп концентрированной
НС10 q и нагревают 10 мин на песчаной бане, к остывшим пробам приливают по 4,8 мп реагента Васьковского, помещают в кипящую водяную баню на
15 мин и колориметрируют на СФ-26 при = 825 нм, Исходя иэ полученных данных строят зависимость изменения интенсивности между максимумом и минимумом (d D) в разностном спектре гемоглобина от концентрации фосфолипазы А (фиг.2) и зависимость скорости накопления продукта реакции (ЛФХ) от концентрации фосфолипазы
А (фиг.3). Из этих графиков находят корреляционные. коэффициенты К „ и К
Определение К,из графика на фиг.3.
Абсцисса ордината
1364634
6.10 г . 7.10-э О 85.10
3,5 10: 4 10 э = 0,87 10;
5 10 г: 6 .10 = 0,83.10;
Среднее значение (0,85+0,02) ° 10
Определение Кг из графика на фиг. 2.
Абсцисса ордината
5 5,10- . 5.10-г
6,610 : 6.10 =1,1;
4-10 г: 3,8 10 г = 1,05;
2.10: 1,8 -10 = 1,1.
Среднее значение 1,1, Из этих же графиков выводят (ФЛАг 3 = К g dD = 1,1 . лЭ (фиг.2); (ФЛАг > = К „А = 0,85 ° 10 А, где А — количество продукта, образованного в единицу времени, выраженное мкМ (активности
30 фермента) . 20
Кг. dD
Отсюда К А = К àD А= — —— г К
1 1-dD
А 2
8,5
8 5-А = 1,1 . Л О.
Пример 3. Определение активности фасфолипазы Аг.
Реакционную смесь готовят как в примере 1 и 2. К 2 мп реакционной смеси в опытную кювету добавляют
1 мкл раствора фосфолипазы А г неизвестной концентрации и через 10 мин записывают изменения интенсивности между максимумом и минимумом в разностном спектре гемоглобина. Оно равно 0,060D, что согласно рассчитанной в примере 2 формулы, соответствует активности 7,7 10 э мкМ/мин. Одновременно оканчивают реакцию добавлением в опытную кювету 0,1 мл
0,25 М ЭДТУ, Продукты реакции экстрагируют двойным объемом смеси хлороформа с метанолом в соотношении 2:1, встряхивают, слои разделяют центрифугированием, нижний хлороформный слой упаривают и проводят определение,количества образовавшегося продукта хроматографическим способом и количественным определением неорганического фосфора по методу Васьковского. Получено при колориметрировании значение И 925 =0,405 для
ЛФХ, что соответствует активности фермента, равной 7,";.10 1 мкМ/мин, Из описанного следует, что при расчете активности фосфолипаэы Аг неизобретения
Формул а
Способ определения активности фосфолипаэы А г, предусматривающий проведение фосфолипазной реакции анализируемой пробы в присутствии соли кальция и мицеллярной формы субстрата — яичного лецитина с холатом натрия с последующим измерением количества живной кислоты, отщепляющейся от фосфолипида, о т л и ч а— ю шийся тем, что, с целью упрощения способа анализируемую пробу, содержащую фосфолипазу А, помещают в одну из двух кювет, в которые дополнительно вводят раствор гемоглобина, соль кальция и мицеллярную форму субстрата, количество жирной кислоты определяют спектрофотометрически по увеличению расстояния между максимумом и минимумом в разностном спектре гемоглобина, а активность фермента оценивают по калибровочному графику, известной концентрации предлагаемым способом и ранее применявшимся,роматографическим способом получен л сравнимые значения.
Определение активности фосфо . :па" зы А> описанным способом по.ь .ш; ст специфичность определения, пос
Способ может быть легко адаптирован для определения активности других липолитических ферментов, в результате действия которых освобожда-. ется жирная кислота (липаза, липопротеидлипаза и др.).
Способ может найти широкое применение в биохимических исследованиях кинетических закономерностей механизма действия фосфолипазы A„ а также в биотехнологии для контроля активности фермента на разных стадиях очистки при промьшшенном выделении иэ природных источников, 1364634
ХОР
ЮЫ ЛУ фн аЭЮ
28 Я Я Г2 Ю Л 1б Я—
Уйа7ОУ к
Puz. 1
1364634 ч наитии ашиаибаф юшжнупшх
Составитель Л.Борисова
Редактор И.Бобкова Техред Л.Сердюкова Корректор В.Бутяга
Заказ 6539/20
Тираж 520 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д.4/5
Производственно-полиграфическое предприятие, r.Óæãoðoä, ул.Проектная,4