Способ получения производных гидроокиси аминопиридиния или их четвертичных солей
Иллюстрации
Показать всеРеферат
Изобретение касается производных пиридина, в частности гидроокиси аминопиридиния и их четвертичных солей формул g-Rr Cl-5-StO),NH,)I -N CRj-CH CT j-CH-tR,CAn) ИЛИ |gRrWbS-S(CfttNHrCjH C«bNH-tJ CRrCH CRrCH-CR,}-cf(CAn1, где или 2-фурилметиламиногруппа R{,Ri, R - одинаковые низший алкил или фенил, которые обладают диуретической активностью и могут найти применение в медицине. Цель - разработка способа получения новых веществ указанного класса с лучшей активностью . Синтез АП ведут из соответствующего сульфоноилбензоилгидразида в тетрафторборатопирилия в низшем спирте при кипячении (4-15 ч) с последующей обработкой КОН. Синтез САП ведут обработкой АП соляной кислотой в этаноле. Испытания новых производных пиридина показывают их нетоксичность и более высокую диуретическую активность,чемхлорталидон. 4 табл. (У)
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К IlATEHTY
) „ зф Я(ф ур лт. сч ll
14м
1 %МГ,-: ., ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3697650/23-04 (22) 07.02.84 (31) 8302380 (32) 15.02.83 (33) FR (46) 23.02.88. Бюл. У 7 (71) Провезан С.А. (СН) (72) Хосе Эстев Солер ($Р) (53) 547.82.07(088.8) (56) Эльдерфилд. Гетероциклические соединения. — М.-Л., 1953, с.365369. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
ГИДРООКИСИ АМИНОПИРИДИНИЯ ИЛИ ИХ
ЧЕТВЕРТИЧНЫХ СОЛЕЙ (57) Изобретение касается производных пиридина, в частности гидроокиси аминопиридиния и их четвертичных солей формул
„SU ÄÄ 1376943 A 3 (51)4 С 07 П 213 89 А 61 К 31 44
P-B ФС1 s&!+%ly-с н)-с!ОФ-N г ) (лп) или е
j(29s. Kl-5-з(а,нн -с н,1-сев-NH-ъ -св,-сн-св,-сн-cRg).è (слп1, где
R -Н или 2-фурилметиламиногруппа, Re Ra R — одинаковые низший алкил или фенил, которые обладают диуретической активностью и могут найти применение в медицине. Цель — разработка способа получения новых веществ укаэанного класса с лучшей активностью. Синтез АП ведут из соответствующего сульфомоилбензоилгидраэида в тетрафторборатопирилия в низшем спирте при кипячении (4-15 ч) с последующей обработкой КОН. Синтез CAII ведут обработкой АП соляной кислотой З в этаноле. Испытания новых производных пиридина показывают их нетоксичность и более высокую диуретическую активность,чем хлорталидон. 4 табл.
1376943
Изобретение относится к способу получения новых производных гидра.окиси аминопиридиния формулы l0
H25O2S
Ci или их четвертичных солей формулы
) 3, о), В2 РЪ
HN С1
С=О 1
25
Н2Ж02 5
С1 где R„ — водород или 2-фурилметил- 30 аминогруппа;
R< R u R †одинаков низший алкил или фенил, которые обладают диуретической активностью и могут поэтому найти приме- 35 нение в медицине.
Цель изобретения — разработка способа получения новых производных из класса аминопиридинов формулы (I), которые обладали бы высокой диурети- 40 ческой активностью по сравнению с известными, например хлорталидоном (1-оксо-3-(3 -сульфамоил-4 -хлорфенил)-3-оксиизоиндолин).
Пример 1. ПолУчение гидро- 45 окиси 1- ((4-хлор-3-сульфамоилбензоил)амина)-2,4,6-триметилпиридииия внутренней соли.
Оставляют при кипячении в течение
4 ч раствор тетрафторбората триметил- пирилия (3,87 г; 0,0184 моль), только что полученного и 4-хлор-3-сульфамоилбензоилгидразида (5,06 г; . 0,0203 моль) в этаноле (60 мл). Охлаждают при перемешивании до комнатной температуры и добавляют 85Х-ную гидроокись калия (1,22 г; 0,0185 моль).
Перемешивают в течение 1 ч при комнатной температуре, нагревают до кипения, фильтруют в горячем состоянии образованный тетрафтарборат калия и промывают осадок этанолом при
60 С. Получают кристаллизацией из концентрированного спиртового раст нора 4,93 r (767) внутренней соли гидроокиси 1- ((4-хлор-3-сульфамоил.бензоил)-амина)-2,4,6-триметилпиридиния. Т.пл. 264-265 С.
ИК-спектр (KBr), см : 1640, 1595, 1545; 1360; 1335; 1165.
Н-спектр ядерного магнитного резонанса, Р, CDMSO (й ) : 2,5 (S, 9H);
3 5 (1, 2Н); 7 55 (S, 2Н); 7 60 (й, 1Н); 8, 15 (g, 1Н); 8,65 (d, 1Н).
Пример 2. Получение гидроокиси 1- И4-хлор-2-фурилметиламино)5-сульфамоилбензоил)амино1-2,4,6-триметилпиридиния внутренней соли.
Оставляют при кипячении в течение
6 ч раствор тетрафторбората триметилпирилия (3,87 г; 0,0184 моль) и 4хлор-2-(2-фурилметиламино)-5-сульфамоилбензоилгидразида (7,21 г;
0,02 моль) в 70 мл этаноле. Охлаждают до комнатной температуры с перемешиванием, добавляют 857-ную гидроокись калия (1,22 г; 0,0185 моль) и поддерживают перемешивани в течение
1 ч. Фильтруют и экстрагируют в несколько приемов этанолом. Концентрируют спиртовой раствор и получают
4,7 г (55X) внутренней соли гидроокиси 1 — 1(4-хлор-2 (2-фурилметиламино) -5сульфамоилбензоил)аминаjj-2,4,6-триметилпиридиния. Т.пл. 274-275 С.
ИК-спектр (KBr), см . 1638; 1600;
1560; 1355; 1340; 1260; 1165. Н ЯМР-спектр, 8(DMSO (dg)): 2,5 (S, 9Н); 4,51 (S, 2Н); 6,35 (d, 2Н);
6,92 (S, 1Н)р 7,18 (S, 2Н); 7,62 (S, ЗН) р 8,63 (S, 1Н); 9,5 (1, 1Н) .
Пример 3. Получение гидроокиси 1- ((4-хлор-3-сульфамоилбензоил) амина)-2,4,6-трифенилпиридиния внутренней соли.
Оставляют при кипячении в течение
15 ч раствор тетрафторбората трифенилпирилия (3,96 г; 0,0 1 моль) и 4хлор-3-сульфамоилбензилгидраэида (2,97 г; 0,011 моль) в этаноле (50 мл), Охлаждают с перемешиванием до комнатной температуры и добавляют 85Х-ную гидроокись калия (0,68 г; 0,0103 моль), Поддерживают в течение 15 мин при перемешивании и фильтруют. Выпаривают досуха фильтрат, перекристаллизовывают из бензола и получают 3,0 r
I 376943 (527.) внутренней сопи гидроокиси
1 †((4-хлор-3-сульфамоилбензоил)амино)—
2,4,6-трифенилпиридиния. Т.пл. 170172 С.
ИК-спектр (КВг), cM: 1628; 1600;
1550; 1350; 1165.
"Н ЯМР-спектр, / (РМ$0 (d6)): 7,27,85 (m, 17Н); 7,92-8,25 (ш, 5H).
Пример 4. Получение 1 в ((41О хлор-3-сульфамоилбенз оил) амино) -2, 4, 6-триметилпиридиния хлорида.
Добавляют при перемешивании 10 мл этанола, насьш(енного соляной кислотой, к раствору внутренней соли гидроокиси 1((4-хлор-3-сульфамоилбензоил)амино)-2,4,6-триметилпиридиния (3,5 г; 0,01 моль) в этаноле (80 мп).
После 1 ч перемешивания фильтруют образованный осадок и промывают этанолом. Получают 3,6 r (927.) хлорида
1- ((4-хлор-3-сульфамоилбензоил)амино)-2,4,6-триметилпиридиния. Т.пл.
272-274 С.
ИК-спектр (КВк), см : 1705; 1642;
1348; 1165. Н ЯМР-спектр, д, (DMSO (d g)):
2 6 (S, ÇH); 2 7 (S, 6Н); 4 85 (1, 2Н); 7,7-8,05 (m, 2Н); 8,35-8,65 (ш, 2Н).
Пример 5. Получение хлорида
1-t(4-хлор-2-(2-фурилметиламино)-5сульфамоилбензоил)амино3-2,4,6-триметилпиридиния хлоргидрата.
Добавляют при перемешивании 20 мл этанола, насыщенного соляной кисло- 35 той, к суспензии внутренней соли гидроокиси 1 в Ц4-хлор-2-(2-фурилметиламино)-5-сульфамоилбензоил)-амино)2,4,6-триметилпиридиния (4,6 г;
0,01 моль) в этаноле (40 мл). В те- 40 чение нескольких секунд получают прозрачный раствор, который немедленно начинает осаждаться. Фильтруют, промывают этанолом и получают 4,9 г (987) хлоргидрата хлорида 1- 1(4-хлор-2-(2- 45 фурилметиламино)-5-сульфамоилбензоил) амино -2, 4, б-триметилпиридиния.
Т.пл. 257-258 С.
ИК-спектр (KBr), см: 1668; 1635;
1565; 1355; 1165. Н ЯМР-спектр, Ф, (DMSO (d 1):
2,6 (S,. ЗН); 2,7 (S, 6Н); 4,6 ($, 2Н);
5-6 (1, 5H); 6,4 (d, 2Н); 7,1 (S, 1Н);
7,6 (S, 1H); 7,95 (S, 2Н); 8,73 (S, 1Í) .
Пример 6. Получение 1- ((4хлор-3-сульфамоилбензоил)амино) 2,4, 6-трифенилпиридиния хлорида.
Добавляют при перемешивании 10 мл этанола, насыщенного соляной кислотой, к раствору внутренней соли гидроокиси 1-((4-хлор-3-сульфамоилбензоил)амино)-2,4,6-трифенилпиридиния (5,4 г; 0,01 моль) в станоле (25 мл).
После полчаса перемешивания фильтруют образованный осадок и получают 5,2 г (907.) хлорида-1 †(4 †хл-3-сульфамоилбензоил)амино)-2,4,6-трифенилпиридиния. Т.пл. 290-292 С.
ИК-спектр (KBr), см : 1700; 1628;
1340; 1170. Н ЯМР-спектр, d, (ПИАНО (d,) ): А,5 (1, ЗН); 7,25-7,73 (m, 11H);
7,73-8,3 (ш, 7Н); 8 53 (S 2Н)
Соединения (1) проявляют диуретическую активность. Мочегонная активность, Используют крыс мужского пола
Sprague-Daw1ey (НС/СРу) весом 150200 г ° Отменяют животным питание и питье за 16 ч до начала опыта. Продукты дают во взвешенном состоянии в суспензии 5-ной карбоксиметилцеллюлозы, в растворе 0,97-ного хлористого натрия при помощи пищеводного зонда из расчета 50 мл/кг веса тела. Помещают животных в индивидуальные клетки метаболизма и собирают всю мочу, выделенную после следующих промежутков времени, ч: 1, 2, 3, 4, 5, 6 и 8.
В моче определяют следующие параметры: объем (мл, кг): натрия и калия (мэкв/кг/ч) (плазменный фотометр); хлорид (мэкв/кг 8 ч)(прибор для измерения хлорида); рН/8 ч (прибор для измерения рН) и осмотическое давление (м осмол/кв/8 ч) (осмометр).
Контрольные животные получают
0,57.-ную суспензию карбоксиметилцеллюлозы в растворе 0,97.-ного хлористого натрия из расчета 50 мл/кг веса тела.
При помощи статистического опыта изучения t для независимьх значений сравнивают значения параметров, указанных раньше, партий животных, обработанных при дозе 40 мг/кг, и партии контрольных животных. Считают, что продукт имеет диуретическую активность, когда различие между контрольной партией и обработанной партией значительное (Р ° 0,05).
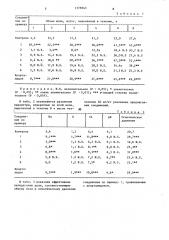
В табл. 1 показаны объемы мочи, выделенной в различные промежутки времени после назначения 4() мг/кг различных предлагаемых соединений.
1376943
Таблица!
Соедине ние по
Объем мочи, мл/кг, выделенной в течение, ч (2 Э ) 4 ) примеру (8
2i 3
Контроль 4,4
12,3
17,2
25,0
27,6
10,4 **
22,3***
3,4**
41,5*** 45,6***
18,4 N. $20,7 N. S
26,0 N. S 27,4 N. S
47,3 *22 52,4*** 1,1 N. S.
6,9 N.S. 14,2 N.S.
18,6 ."
11,9 N. S.
6,2 N. S.
О,ОN S.
39,2"*
34.4х
2 I,5 N. S 25,3 N. S
5,2 N. S. 12,6 N. S.
Хлорталидон
30,9"**
37,6 **
8, 7*** 21,0™+*
45,6*** 49,8***
П р и м е ч а н и е. N.S. незначительное (P 2 0,05); * значительное (P < 0,05); ** очень значительное (P 0,01); *** в высшей степени значительное (P c 0,001).
2 указываются различные измеренные по всей моче, в течение 8 ч после наз- 30 начения 40 мг/кг различных предлагаемых соединений.
В табл. параметры, выделенной
Т а б л и ц а 2
Соединение по
Cl рН
Осмотическое давление примеру
6,4
6,1
20,7
5 6
1,2
Контроль
1,7*** 11,8***
1,3 N.S. 6,2 N.$.
1,1 N.$. 8.1**.
9, 1***
3,0*" *
6,6*
9,3***
1,6**
8,9***
5,9 N.S.
1.2 N.S. 7,2 N.S. 6,7**
1,2 N. S. 7,5*
6,2 N.S.
6,0
Хлорталидон
29,9***
1, 9*** 10, 8*** 6, 6*
9,3***
В табл. 3 показаны эффективные пятидесятые дозы, соответствуннцие объему мочи и осмотическому давлению соединения по примеру 1, сравниваемые с хлорталидоном.
30, 2 "**
8,0*
19,4 N.S.
28,4***
19,6 N.S.
16,8 N.S.
36,0***
12,5х
22,2 N.S.
36,1 **
28,5 N.S.
19,0 N.S.
6,0 N.S.
6,1 N.S.
6,0 N. S.
6,3 N. S.
29,7***
16,6 N.S.
25,3 *
31,0***
23,4 N.S.
25, 1*™
1376943
Таблица 3
DE<,,мг/кг при
Соединение
5 осмотическом давлении, м осмол/кг/
/8 ч
1О объеме мочи мл/кг/8 ч
По примеру 1
1,2
4,7
R3 ф+
В2 Ы в
C=0 1
Хлорталидон
7,7
6,9
, 02$
С1
Н2 02Б
С1
NH2
NH
C=0
R1 (III) Н25 025
Таблица 4
Смертность
Доза, мг/кг
О/4
О/4
О/4 О/4
О/4 О/4
О/8 О/4
О/8 О/8.400 О/4
800 О/4
1600 О/4
3200 О/4
6400 О/8
12800 О/8
О/4
О/4
О/4
О/8
DE вычисляют исходя из прямой
5е регрессии представления десятичного логарифма дозы по отношению к проценту полученного эффекта.
Согласно табл. 3 предлагаемое соединение по примеру 1 лучше хлорталидона, так как его пятидесятые эффективные дозы в 1,5-1,7 раза меньше для объема мочи и в 3,6-6,4 раза меньше для осмотического давления.
Наблюдается острая токсичность.
Вводят соединение оральным путем в суспензии в 57-ном гуммиарабике мышам-альбиносам CELP-PE весом 20-25 r и крысам Sprague-Dawley CFY-RE весом
125-175 г. Назначенный объем составляет 25 мл/кг у невредимой мьппи для максимальной дозы 12,800 мг/кг, где назначали объем 50 мл/кг, и 10 мл/кг у невредимой крысы для максимальной дозы 12,800 мг/кг,. где назначали 35 объем 30 мл/кг.
Невозможно определить летальную дозу 50 ввиду того, что отсутствует смертность.
Результаты исследований по приме- 40 ру 1 представлены в табл. 4.
Таким образом, предлагаемые соединения (I) обладают диуретической активностью и эффективнее известных.
Формула изобретения
Способ получения производных гидроокиси аминопиридиния формулы (I) или их четвертичных солей формулы (II) где R, — водород или 2-ферилметиламиногруппа;
R,R и К вЂ” одинаковые низший алкил или фенил, отличающийся тем, что гидразид формулы
I где R< имеет указанные значения, подвергают взаимодействию с солью пирилия формулы где R - R+ имеют указанные значения, в низшем спирте при кипячении в течение 4-. 15 ч с последующей обработкой реакционной массы гидроокисью калия и выделением целевого продукта формулы (Т) или обработкой последнего соляной кислотой в этаноле для получения его четвертичной соли.