Способ получения солей низших алифатических карбоновых кислот
Иллюстрации
Показать всеРеферат
Изобретение относится к производным органических кислот, в частности к получению солей низших алифатических карбоновых кислот, которые используются в лакокрасочной промышленности, аналитической и прикладной химии. Цель - интенсификация процесса. Получение указанных солей ведут взаимодействием металла с карбоновой кислотой в присутствии озона в водном растворе. Способ позволяет интенсифицировать процесс в 3-4 раза в сравнении с известным. 10 табл.
СОЮЗ СОВЕТСНИХ
СОЦИАЛ ИСТИЧЕСНИХ
РЕСПУ БЛИН (5g 4 С 07 С 51/41
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPCHOMV СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 4029078/31-04 (22) 24.02.86 (46) 23.05.88. Бюл. Р 19 (72) Л.А. Абрамов, А.И. Вовк и А.Е. Капустин (53) 547.29.02 07 Г088.8 ) (56) Авторское свидетельство СССР
У 1097604, кл. С 07 С 53/10, 1982. (54) СПОСОБ ПОЛУЧЕНИЯ СОЛЕИ НИЗШИХ
АЛИФАТИЧЕСКИХ КАРБОНОВЬИ КИСЛОТ (57) Изобретение относится к производным органических кислот, в .част„,SU„„1397425 А1 ности к получению солей низших алифатических карбоновых кислот, которые используются в лакокрасочной промышленности, аналитической и прикладной химии. Цель — интенсификация процесса. Получение указанных солей ведут взаимодействием металла с карбоновой кислотой в присутствии озона в водном растворе. Способ позволяет интенсифицировать процесс в
3-4 раза в сравнении с известным.
10 табл.
1397425
Из обрет ение относится к у сов ершенствованному способу получения солей низших алифатических карбоновых кислот, которые находят применение в лакокрасочной промышленности, аналитической и прикладной химии.
Целью изобретения является интенсификация процесса, достигаемая проведением взаимодействия металла с карбоновой кислотой в присутствии озона в водном растворе.
Пример 1„В стеклянный реак" тор смешения объемом150 мл с рубашкой, обратным холодильником и барботером помещают 5 r порошка металла с содержанием основного вещества 99,9%, 30 мл (30г) карбоновой кислоты марки чда и дистиллированную воду до 100 мл (70 г). При 50 С реакционную массу 20 перемешивают в течение 60 мин, барботируя озон в количестве 5 мл/мин.
Озон получают в газоразрядном озонаторе (расстояние между электродами
10 мм, напряжение 10 кВ), концентра- 25 ция озона в газовой фазе — кислороде— до 10 об.%. Г(о окончании процесса (полное растворение металла) реакционную массу упаривают, при этом выпадает кристаллическая соль, соот- 30 ветствующая чда.
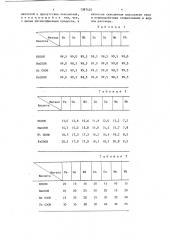
В табл. l показано содержание основного вещества в солях низших алифатических карбоновых кислот (мас.%).
Максимально за 60 мин достигается полная конверсия по любому из указанных в табл. 1 металлу — полное растворение (с учетом кристаллизационной воды). 40
Количество образующихся солей (1) показаны в табл. 2.
Пример 2. Условия по примеру
1, но озонбарботируют через PBcTBoP s нагретый до 90ОС. 45
В табл. 3 показано время процесса, необходимое для достижения 100% конверсии. по металлу (мин.) .
Пример 3. Условия по примеру 1, но озон барботируют через раст,,50 о вор, нагретый до !00 С.
В табл. 4 показано время процесса, необходимое для достижения 100% конверсии по металлу (мин).
Пример 4. Условия по примеру 1, но озон барботируют через раствор, нагретый до 20 С.
В табл. 5 показано время процесса, необходимое для достижения 100%. конверсии по металлу.(мин).
Пример 5. Условия по примеру 1, но озон барботируют через растор охлажденный до
В табл. 6 показано время процесса необходимое для достижения 100% конверсии по металлу (мин).
Пример 6, Условия по примеру 1, но в реактор помещают 80 r карбоновой кислоты и 20 г воды.
В табл. 7 показано время процесса, необходимое для достижения 100% конверсии.по металлу (мин).
П.р и м е р 7; Условия по примеру 1, но в реактор помещают 5 мл (г) карбоновой кислоты и 95 г воды.
В табл. 8 показано время процесса, необходимое для достижения !00% конверсии по карбоновой кислоте (мин).
Пример 8. В реактор смешения объемом 2,5 л с мешалкой, обратным холодильником и барботером помещают
62 r металла, 350 мл (350 г) карбоно- вой кислоты марки чда и воду до
1000 мл (650 л). При комнатной темпер атур е (21 С) 6арботируют озон в количестве 15 мл/мин. 3а 30 мин достигается полное растворение (100% конверсия) металла.
Количество образовавшихся солей показано в табл 9
Зависимость протекания процесса от температуры носит экстремальный характер, что подтверждается данными табл. 10, где показано время процесса, необходимое для 100% конверсии по металлу (мин) .
Получение солей по предлагаемому способу можно вести при любых соотношениях металл. карбоновая кислота, однако с увеличением соотношения скорость процесса снижается с (табл.
6 и 7) и зависит от типа используемой кислоты, причем она падает с увеличением молекулярного веса (табл.
2-7) .
Предлагаемый способ позволяет интенсифицировать процесс по сравнению с известным в 3-4 раза. формула изобретения
Способ получения солей низших алифатических карбоновых кислот взаимодействием металла с карбоновой
1397425 кислотой в присутствии окислителя, отличающийся тем, что, с целью интенсификации процесса, в
Таблица 1
Со
995 990 995 985 985 995 990
990 985 985 990 990 990 995
98,5 99,5 99,5 99,5 99,0 98,5 99,5
99,0 99,5 98,5 99,0 99,5 98,5 99,5
Т а б л и ц а 2
Zn Cu е Со
13,0 12,6 12,6 11,9 12,0 13,2 7,2
HCOOH
15 5 15 0 15 0 14 0 14 2 15 7 7 8
МаСООН
18,3 1?,3 17,3 16,2 16,4 18,2 8,5
20 5 17 9 17 9 18 3 18 5 20 8 9 2
Et CO0H
PrCO0H
Т а б л и ц а 3
n Cu Mn
20 15 15 20 15 10 15
20 20 25 20 20 15 20
25 25 20 35 30 20 20
30 35 30 30 40 30 25
НСООН
МаСООН
Et COOH
РгСООН
НСООН
МеСООН
Et СООН
Pr COOH качестве окислителя используют озон и взаимодействие осуществляют в водном растворе.
) 397425
Таблица 4
Со Ni
Мет
Кислот
Cu Мй
Zn
Т аблица 5
Ni Zn
Кислота
РЪ
Т а б л и ц а 6
1 Г1ета Fe
Кислота
Мп Pb
PrC0OH
HCOOH
Ме СООН
Et СООН
PrCOOH
HCOOH
МеСООН
Et СООН
PrCOOH
НСООН
МеСООН
Et C00H
35 20 20 25 15 20 15
25 25 30 30 25 25 25
25 30 30 35 35 30 35
20 40 40 35 45 40 35
15 10 10 15 15 5 10
15 15 15 10 10 10 10
20 20 10 20 10 15 15
25 30 25 25 25 15 20
Т
, Ni Zn Cu !
20 15 . 10 20 15 15 15
20 20 25 25 20 15 20
25 25 25 35 35 20 20
25 35 35 35 40 25 25
1397425
Таблица 7
Метал
Кислота
Со
РЪ
Си Ип
Таблица 8 е С
Г.
Кислот
10 5 5
Т а б л и ц а 9
Си
НСООН
МеСООН
Et COOH
PRCOOH
НС0ОН
МеСООН
Et СООН
PrC00H
НС0ОН
МеСООН
Et СООН
PrCOOH
15 10 10 15 15 15 15
15 15 %5 15 15 10 10
20 25 20 25 15 20 20
25 30 20 ЗО 25 20 30
10 10 15 . 10
10 15 15 10 10 15 10
15 20 15 20 20 15 15
20 25 25 20 15 20 15
Fe Co Ni Zn Mn
161 156 156 174 164 149 89
192 186 186 201 194 176 97
226 214 214 226 225 203 105
254 222 222 227 258 229 114
E 397425
Т аблица 10
Моляр ное соотно10 20
90 100 шение
М: RCOOH
Fe HC00H
СН3 СООН
Fe СН,(СН ) СООН
Ре СН (СН ) СООН
Ni а4 СООН
Cu CH (СН ) СООН 0,22:1 40 25
40 45
10 20
NQ HCOOH
М СН СООН
М1 СНз СН z COOH
Мй СН (СН )g СООН
0,14:1 15 5
Ме- Кислота (RCÎOH) талл (М) Со . НСООН
Со СН СООН
Со СН (CH ) СООН
Со СН,(СН,), СООН
Ni НСООН, И СН, СН,СООН
СНЗ(4 )асоон
Zn НСООН
Zrl СН СООН
Еп СН СН СООН
Еп СН (СН ) СООН
Сп HCOOH
СИ СН СООН
Сп CH,СН,СООН
Температура процесса, С
0 14 1 20 15 20 35
0,22:1 20 15 20 25
0,26:1 25 . 25 30 20
0,22: 1 25, 20 25 25
0,13: l 15 10 15 20
0,17:1 20 )5 20 25
0,2:1 25 20 25 30
0,24:1 35 30 35 40
0,13 10 10 15 20
О, 17: 1 25 15 25 30
0 21:1 25 10 25 30
0,2,5: 1 35 25 30 40
0,12: 1 20 15 20 25
О 15 1 25 10 25 30
0,19: 1 35 20 35 35
0,22: 1 35 25 30 35
0,12: 1 15 15 15 15
0,15:1 20 10 20 25
О, 19: 1 35 10 30 35
0,18:1 15 10 15 25
0,22:1 20 15 20 30
0,27:1 25 15 30 40
)39742
Продолжение табл. 19
Ие- Кислота (RCOOH) 1
РЬ НСООН 004: 1 15 )0!
5 15
Pb СН COOH
0,05: 1 20 10 20 25
Pb СН,СН,СООН О 06 1 20 15 20 35
РЬ СН (СН ) СООН 0,07:1 25 20 25 35
Составитель Н. Капитанова
Редактор И. Шулла Техред А. Кравчук Корректор
Заказ 2558/23
Тираж 370 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул, Проектная, 4