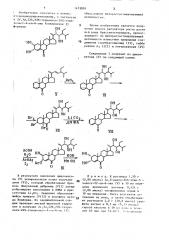
2 @ ,3 @ ,22s,23s-тетраокси-24s-этилхолест-4-ен-он, обладающий фиторостостимулирующей активностью
Иллюстрации
Показать всеРеферат
Изобретение касается активных стероидов,- которые могут быть использованы в сельском хозяйстве. 2,30, 222,238-тетраокси-243-г тилхолест-4-ен-6-она ведут окислением Щ1К- локетона 030, бромировянием бромом, дегидроброкированием кипячением з диметилформамиде н присутствии , окислением по методу Нудварда (СНзСООН, Н,0; CHjCOOAg, 1), щелочным гидролизом кон в среде метанолй. Новый стероид имеет активную концентрацию 10 М, дающую удлинение гчпокотилей на 75% (гегерспуксин - на 21%) при отсут.ствии угнетающего действия . 1 ТсгбЛ. с « со 00 ел
СОЮЗ ССВЕТСНИХ
СОиИАЛИСТИЧЕСНМХ
РЕСПУБЛИН
ОПИСАНИЕ ИЗОБРЕТЕНИЯ (21) 4194720/04 (22) 13.02.87 (46) 30. 12,91. ">þë. Р 48
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТЮЗ (71) Институт биоорганической химии ,АН БССР (72) А.A.Aõðåì, Ф.A.Лахвич, В.A.Õðèïa÷, Н.Р>. Ковганко, В.Н.Жабинский, A.И.Быховец и И.П.Борисова (53) 547.689.6 (088.8) (56) Ikekawa N,, Takatsuto S., Kitsuwa, Saito Н., Morishi.ta Т., Abe Н. Analysis of natural brassinostегоids by Вав chromatography and
gas chromatography-mass-spectrometry//3.Chromatogr 1984, vol 290, р.289-302.
Takatsuto S., Vazawa N., Ikelawa N., Morishita Т., Abe H. Synthesis îf (24R)-28-homobrassinolide analogs and Structure — activity relationship of brassinostегоids in the
rice — lamine inclination test//Phytochemistry, 1983, vol., 22, 1 . 6, р. 13931397.
Takatsuto S., Vazawa N., Ikekawa N., Takematsu T., Takeuchi V., Koguchi M. Structure — activity relationship of brassino stегоids//Phytochemistró, 1983, vol 22, 11 11, р ° 24372441, Иельников Н.Н., Новожилов H.R.
Белан С.Р., Быпова Т.Н. Справочник по пестицидам. M.: Химия, 1985.„ с.36.
Авторское свидет"льство СССР
Р 1162816, кл. С 07 J 9/00, 14.02.84.
Anastasia И., Allevi P., CiuffreBa F, 01eotti А. А convenient iso merisati.on of б-охо-34, 5-cyclo-5о stегоids tn .6-охо- д -5e -stегоids//
//Stегоids, 1986, vol. 45, Р 6, р.561
564.
„.SU„„1433005 А1 (51)5 С 07 J 9/00, А О1 И 29/00 (54) 2а(, Зс/, 22S,23S-ТЕТРАОКСИ-248ЭТИЛХОЛЕСТ-4-ЕН-6-0Н, ОБЛАДМ)1 1ИЛ
ФИТОРОСТОСТИИУЛИРУ1ОПЕИ АКТИВНОСТЬ1."1 (57) Изобретение касается активных стероидов; которые могут быть использованы в сельском хозяйстве. Сцц еэ
2,3с,228,23S-тетраокси-24S-этилхолест-4-ен-б-она ведут окислением циклокетона 0S0<, бромированием бромом, дегидробромированием к;.пячением в диметилформамиде и присутствии i>00, окислением по методу Нудварда (СН СООН, Н О; СН COÎAg, I„), щелочным гидролиэом КОЙ в среде метанола..
Новый стероид имеет активную концентрацию 10 М, дающую удлинение гипо- а . котилей на 75Х (гетероауксин — на
21X) гри отсутстгии угнетающ .го действия. 1 табл.
14 33005
5 Целью изобретения является получение нового регулятора роста расте н .й ряда брассиностероидов, лревосходящего ло фиторостостимулирующей активности известные природные сое19 динения гомобрассинолид (II), гиббе реллин A (III) и гетероауксин (IV) HO,, НО
Соединение 1 лолучают иэ цикло/ кетона (V) ло следующей схеме:
АсОн н о "Оъ
AcOAg
3 AGO
НО„, ИО"
В результате окисления циклокетона (V) четырехокисью осмин получают диол (VI), который обрабатывают бромом. Полученный дибромид (VII) дегидробромируют кипячением в ЛИФА в лриryxcxsHv Li CO . Окисляют образовавпыйся триенон (Ч11Х) в условиях мето-55 да Вудворда. На заключительной стадии проводят мягкий щелочной гидро.— лиэ и получают 2,3,22S,23S-тетраокси-24S-этилхолест -4-ен-б-он (T) .
Изобретение относится к новому ст<.роиднолулроиэнолному, в -частности к 2)/,3o(,22S,23S — тетраокси-24S-зтилхолест-4-ен-6-ону {соединение 1)
4юрмулы ОН облаг.ан)щему фиторостостнмулирующей активностью.
IT р и м е р. К раствору 1,50 r (2,80 ммоль) 38,5-цикло-24S-зтил-5 холест-22-ен-б-она (V) в 10 мл пиридина приливают раствор. 0,524 г (2,06 ммоль) четырехокиси осмия н
10 ип пиридина. Смесь реагентов оставляют на .ночь, а затем обрабатывают раствором 3,0 г (28,Я имопь) сульфита натрия и 0,5 мл (9,33 милль) серной кислоты в 30 м)1 ьч ль) н тячев ,1 ние 40 мин при 55-40 (., и зн.нн)ннун) 1 4 33! н!", с
Нес ь (?хзглжллит JtI? KAMH l тно! f темпе рлтуры, вылинлн?т H воду, экстрлгирун>т хлороформом. Экстракт промыг лют водой, упаривают . Остаток нлносят на колонку с силикагелем. Элюируют смесью гексанл с эфиром. Получают наряду с 0,107 г (0,26 ммоль) ке вступивmего в реакцию циклокетонл (Ч) 0,830 г (1,87 ммоль, 91% нл OSO ) 22$,23$- 10 диокси-3, 5-цикло-24S-этил-5г-холестан-6-она (UI) . Т.пл. 160-162 С (ацетон). Лит.т.пл.160-162 С.
K раствору 1,448 г (3,26 ммоль)
22S,23S-диокси-3г,5 †циклов?4$-зтнл- 15
54-холестан-6-îíà. (VI) в 25 мл уксусной кислоты прикапывают при перемешивании 0,2 мп (3,93 ммоль) брома в
10 мл уксусной кислоты. Смесь выперживают в течение 10 мин при комнатной температуре, вьгпивлют в воду, .экстрагируют хлороформом. Экстрлкт промывают насьггцекным раствором сульфита натрия, пропускают через слой силикагеля, уплривают. Лолучан!т 25
1,358 r (2,25 ммоль, 8/%) 22S-23$— диокси-3 -5o(-дибром-24S-этил-5о -хоI лестлн-6-îíà (VII) . Т.пл. 172-175 С (гексан-ацетон).
Смесь 1,318 r (2, 18 ммоль) 22$, 30
23$-диокси-3,5а -дибром-24$-этил-5г холестан-6-окл (VII) и 2,0 r (27,0 ммоль) карбоната лития кипятят с обратным холодильником в 30 мл диметилформлмида в течение 20 мин, за— тем охлаждают до комнатной температуры, выливают в воду, экстрагируют ороформом. Экстракт промывают воой, пропускают через спой силикагепя, упаривают. Остаток накосят на 40 колонку с силикагепем. Злюируют смесью гексаиа и эфиром (f: 1). Получают
0,704 г (1,59 ммоль, 73%) ?2S,23$ 1иокси-24$-этилхолеста-2,4-диек-б1она (VIII).
К раствору 0,270 r (0,61 ммоль)
122$,23S-диокси-24S-этил-холеста-2,4 циен-6-она (VIII) в 25 мп уксусной кислоты и 2 мл воды при 50 — 55 С прибавляют 0,300 г (1,81 ммоль) ацетлта 5
1 серебра, затем при энергичном перемешивании 0,170 г (0,67 ммоль) йода.
Реакционную смесь перемешивают при данной температуре еще 20 мин, затем упаривают. Остаток пеРеносят в лелителькую воронку, экстрагируют хлороформом. Экстракт пропускают через слой силикагеля, унарнвают, наносят иа колонку с силнклгелем. Элн!нруюг з4!гром, По. г "г,i! 1! г! I i I (О 34 и i!tb
55%) Зс-л!к*т()v н-,,г,22$-?3.. — грн н н?4$-зтилхолест-4 — г н-6 — онл (1Х) .
Рлг твс Р О, 1!0 г (0,27 ммолг ) laлцетокси-?4,22$,23$-тг?нг коlt i .--?TH!lхолест-4-ек-6-онл (1Х) н 0,2 r (3,6 ммоль) гггдроокси калия в ?О мгг метанола киггятят с обратным хг?хгодигггHHK(м rl течение 5 мин, затем AYJIHJKJtäют да комнатной темггг.рлтуры, пропускают через слой силиклгеля, упарнвлют. Остаток наносят нл колонку с силикл гелем. Элглирун1т cNecbl0 зфирл с зтанолом (25: 1}. Получлют 0,102 г (О, 21 ммоль, 80%) 20!, Зг, 22S,23$-тетраокси-24 $-этилхолест-4-,е и-6-онл (1) .
Строение полученных соединений подтгержлено спектрлльггьпги дакггьггггг.
Бнологичес кля (фито ростостггмулггрую!пля) л ктивность 2 !, 3, 22S, 23S-тетраокси-24S-этилхолест-4-ен-.б-окл (I) исследована в ллборлтарных условиях с нспользовлнием растений фасоли.
Для сравнения биологической актйннос ги изучаемого соединения использовали фитогормоны гиббереллин (III) и гетероауксин (ЕЧ), а также структурный акалог, природный регулятор роста растений — гомобрлссгнолнд (XI)
Семена фасоли элмлчннлют в плст— ворах исСледуемьгх Hetltec Ta различной концентрации. В одну члшку Петри кладут по 1О семягг Алсоли и г!носят по
10 мл растворов. Через сутки набухшие семена вьгслживлгот в стлклггч)гни с почвой. Повторность опытов 4-кратная. Дальнейшее гтрорлстлнне и рост проростков проггсходи при 12-часовом фотопериоде при искусственном осrtettte. н!ги. Спустя 7 сут роста проводят измерения длины гипокотилей и эпикотилей обрлботанггых растений.
Данные измереннгг предста!!ггеггьг в таблице.
Из приведекньгх в таблице данных видно, что предлаглемг?е сг?ел!!кение окл зывает заметное стимулнрун!г!!ее действие на рост растений флсолн. Наиболее зфАективггой оклзлллсь концсггт: l1 рация 10 "11. Тлк, при этой кокцентра ции каблюдаетсл удлинение гипокотплей HB 75%, тогда клк гетеролуксин в аналогичных ytловиях стимулирует удлинение нл 21%, гомобрлссннолнд (IX) — на 8%. и гиббереллин (ТXX} гга 4%. К достоинствам соедикеяия следует тлкже ОтHccTH отсутстки» уг
f 433005 нетающего действия во всех исследованных концентрациях, что затрудняет иепользование известных стимуляторов роста растений.
Такии образом, соединение (I) обладает ростостимулирующей активностью, превосходящей действие известных фитогормонов.
„„0H " OH
fQ
Формула йзобретения
Обладаииций фиторОстостииулируюц®й тивнОстью,.
2a,3,22S,23S-Тетраокси-248-этилхОлест-4-ен-6-он формулы
Влияние фитогорионов на рост растений фасоли
Длина гипокотилей
Концентрация, М.
Соединение
Длина зпикотилей
% к контролю контролю
10 7
45„ /» 1,6
19,5+3,8
20,0+2,2
35,0%2%0
105
104
49,4"6,5
f07
76,0 7,0
54„2М,9
54,0+4,2
46,7 13,/
42,0<5,338,5+6,5
45,0+3,5
48,217,7
49,0+6,3
52.5 5 5
27,312,8
il 08
15,7 0, /
10fl
15,0+0,5
1590 1 Ь
21,5Ф5,1
f 9,021.,8
23,0+0,1
104
115
10" 11
102
123
Контроль
43 ЗМ,З
il8, /+2,2
100
Составитель Г.Мосина
Техред М.Ходаннч Корректор С.Черни
t Редактор Г.Бельская
Заказ 4673 /ДСП Тираж 205 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5 о
Производственно-полиграфическое предприятие, г. Уагород, ул. Проектная,