Способ определения сахаролитической активности микробов
Иллюстрации
Показать всеРеферат
Изобретение относится к области микробиологии и предназначено для быстрого определения сахаролитической активности микробов при их идентификации . Для повышения чувствительности способа на поверхности бумажного диска с гидрофобным покрытием размещают углеводные субстраты и индикатор в виде фиксированных энзимоиндикаторных микропленок, содержащих дополнительно гидролизат казеина сухой и желатин при следующем -соотношении компонентов, мас.%: субстрат углеводный 2-3; гидролизат казеина сухой 0,9-1,5; желатин 0,9-1,5; феноловый красный 0,01-0,025; фосфатньй буферный раствор рН 8,0 остальное. 3 табл.Q «
СО103 СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (51) 4 С 12 q 1/00
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
H ABTOPCHOIVIY СВИДЕТЕЛЬСТВУ
C ф
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО.ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 4232569/28-13 (22) 20.04.87 (46) 07.12.88. Бюл. № 45 (71) Кишиневский государственный медицинский институт (72) Ф.И.Георгица и В.М.Никитин (53) 576.8.093(088.8) (56) Авторское свидетельство СССР
¹ 548623, кл. С 12 Q 1/00, 1977.
Авторское свидетельство СССР № 707963, кл. С 12 Q 1/04, 1980. (54) СПОСОБ ОПРЕДЕЛЕНИЯ САХАРОЛИТИЧЕСКОЙ АКТИВНОСТИ МИКРОБОВ (57) Изобретение относится к области микробиологии и предназначено для быст„„SU„, 1442549 А1 рого определения сахаролитической активности микробов при их идентификации. Для повышения чувствительности способа на поверхности бумажного диска с гидрофобным покрытием размещают углеводные субстраты и ин" дикатор в виде фиксированных энзимоиндикаторных микропленок, содержащих дополнительно гидролизат казеина сухой и желатин при следующем соотношении компонентов, мас.Х: субстрат углеводный 2-3; гидролизат казеина сухой 0,9-1,5; желатин 0,9-1,5; феноловый красный 0 01-0 025; фосфатный буферный раствор рН 8,0 остальное.
3 табл.
1442549
Изобретение относится к микробиологии и предназначено для определения сахаролитических свойств микробов, Целью изобретения является повыше5 ние чувствительности способа.
Способ заключается в том, что на поверхность бумажного диска с полимерным покрытием размещают углеводные субстраты и индикатор в виде энзимоиндикаторных микропленок, которые дополнительно содержат гидролизат казеина сухой, а в качестве фиксирующего вещества — желатин при следующем соотношении компонентов, мас. : углеводный субстрат 2-3; гидролизат казеина сухой 0,9-1,5; желатин 0,91,5; феноловый красный 0,01-0,025; фосфатный буферный раствор рН 8,0 остальное. 20
Включенный в состав микропленки углеводный субстрат используют в качестве ферментируемого субстрата, феноловый красный играет роль индикато" ра рН реакции, осуществляемой сахаро- 25 литическими ферментами микробов при использовании ими углеводных субстратов. Желатин фиксирует на поверхности бумажного диска с полимерной пленкой субстраты и индикатор и вмес- 30 те с гидролиэатом казеина одновреиенно служат питательными веществами, за счет которых происходят рост, размножение микроорганизмов, сахаролитических ферментов и их определения.
Это позволяет повысить чувствительность и ускорить определение, что приводит к быстрому накоплению сахаролитической активности микроорганизмов до 7 ч при концентрациях от
1 млрд.-1 млн. и до 18-24 ч при концентрациях до 10 микробных клеток в 1 мл.
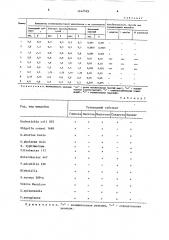
Чувствительность и скорость определения сахаролитической активности микробов в предлагаемом и известном способах приведены в табл. 1.
Способ осуществляют следующим образом.
К навескам углеводородного субстрата и гидролизат казеина сухой приливают растворы желатина, фенолового красного и фосфатного буферного рН
8,0, затем растворяют смесь на водяной бане при 90 С и получают субстрйтно-индикаторно-фиксирующий раст55 вор. Полученный и охлажденный до комнатной температуры раствор наносят н@ поверхность диска с полимерным покрытием в виде капель объемом 0,02 мл, которые высушивают до получения фиксированных энзимоиндикаторных микропленок. Для определения сахаролитической активности микробов на энзимоиндикаторные микропленки наносят по 1 капле исследуемой микробной культуры и термостатируют при 37 С.
Пример 1. Из бумаги .с полимерным покрытием вырезают диск диаметром чашки Петри и расчерчивают
20 квадратных зон площадью 1,5х х1,5 см.
В пробирку берут навеску соответствующего углеводного субстрата (0,25 г) и гидролизат казеина сухой (0,1 г) и к ним приливают растворы
10 -ного желатина 1,0 мл, 25 .-ного фенолового красного 1,0 мл, фосфатного буферного рН 8,0-7,7 мл и растворяют смесь на водяной бане при 90 С, получая субстратно-индикаторно-фиксирующий раствор, который охлаждают до комнатной температуры, Затем в центр каждой квадратной зоны диска наносят пипеткой по 1 капле объемом
0,02 мл субстратно-индикаторно-фиксирующего раствора соответственно обозначению углеводного субстрата и оставляют при комнатной температуре до полного высыхания. капель и получения фиксированных энзимоиндикаторных микропленок.
Готовый диск с фиксированными микропленками хранят при комнатной температуре в бумажных пакетах в течение
3 лет (срок наблюдения) . По мере надобности их используют для определе ния сахаролитической активноу1 и мик о. робов. С этой целью в крышку чашки
Петри кладут готовый диск и на энзимоиндикаторные микропленки наносят пипеткой по 1 капле микробной взве-. си, содержащей от 1 млрд, до 10 микробных клеток в 1 мл. Чашку закрывао ют и инкубируют при 37 С.
При расщеплении субстрата микробной культурой окраска капли переходит из красного цвета в желтый.
Способ определения сахаролитической активности микробов осуществляют использованием энзимоиндикаторных микропленок, приготовленных из ингредиентов в пределах указанных граничных значений.
Пример ы 2-9. Опыты проводят аналогично примеру 1.
От 0,9 до 1,5
От 0,9 до 1,5 микроорганизмов, Таблица!
Скорость ферментации углеводных субстратов, ч,, по способу
Концентрация ,микробов, в1мл предлагаемому известному
,1 1.1:7 1, .1 Т ..Т; I Т:
1 2 3 4 5 6 7 8 9 24 1/2+ 34 (vto J2 j a 9 24
1О
10а
+ +
+ + + +
+ + +
+ +
+ 4 +
+:4 +
+ + +
П-р м е н а н и е: "+"- полояительная реакция, "-" - отрицательная реакция. з 144
Зависимость чувствительности способа от количественных соотношений компонентов энзимоиндикаторных микропленок показана в табл. 2.
Предлагаемы способ является более чувствительным, так как позволяет определить сахаролитическую активность микробов при концентрациях до
10 микробных клеток в 1 мл (табл.1).
Это дает возможность изучить сахаролитическую активность микробной колонии, исключив этап накопления при выделении чистой культуры.
Сахаролитическая активность раз- . личных микробов показана в табл.3.
Кроме того, способ позволяет конструировать целенаправленные микротекстсистемы определения сахаролитической активности различны: групп
Формула и з о б р е т е н и я
Способ определения сахаролитической активности микробов, предусмат2549
4 ривающий размещение исследуемого образца на бумажном диске с полимерной пленкой, приготовленной с использованием углеводных субстратов, индикато5 ра — фенолового красного, фиксирующего вещества, растворенных в фосфатном буфере рН 8,0, с последующей оценкой результатов, о т л и ч а ю— шийся тем, что, с целью повышения чувствительности способа, для приготовления полимерной пленки дополнительно вводят гидролизат казеина сухой, а в качестве фиксирующего вещества используют желатин при следующем соотношении компонентов, мас.%:
Углеводный субстрат От 2,0 до 3,0
Гидролизат ка20 eHHÂ сУхой
Желатин
Феноловый красный От 0,01 до 0,025
Фосфатный буфер2ц ный раствор рН 8,0 Остальное
1442549
Таблица2
Компоненты энэимоинликаториой микропленки и их соотнопе елъность способа при ациях микробов
Пример
Желатин убстрат каэейна сухой ° поло вый асный
Утлеводиый страт клеток/мл
1 млн/мл абс. X бс. I абс.
0,3
0,3
0 5
0,3 0,3
0,001 0,001
0,0025 0,0025
0,5
2 1 0
O 5 . 0>5 0 5
0 5
0,8 0,8 0,8
0,8
3 1,5
4 2,0
5 2 5
>1,5
0,005 0,005
+++
0 9 0 OT 0,01
0,9
2,0
0,9 0 9
+++ ч++
+и
2,5
1,0
0>02 .0>02
1,0
1,0
+++
+++
0,025
6 3 0 . 3 0 1,5
1,5
1,5
1>5
0,025
+н
+++
1,75 1,75 1,75 0,03
3,5 .
7 3,5
1 75
0,03
3,75 2,0
0,05
8 3,75
9 4,0
2,0
2,0
2,0
0 05
2,5
4,0
2,5
2 5
2,5
0,075
0,075
П р н и е ч а и и е. Кнтенсивность реакцинэ "+++" - резко полоиителъная (иелтый цвет)> "++" - полопительная (светлоиелмый), "+" - слабополошпелъная (орапиевый), "-" отрицательная (красный).
ТаблицаЗ
Углеводный субстрат
l t 1 !
Род, вид микробов
typhimurium
Citrobacter 117
S.aureus 209-р
Uibrio Mecnicov
S.epidermidis
P.aeruginosa
II р и M е ч а н и е. "+" — положительная реакция, "-" — отрицательная реакция.
Escherichia coli 055
Shigella connei 1669
S.abortus bovis
S.sholerae suis
Entегоbacter 447
P.mirabilis 226
Klebsiella
Глюкоза Лактоза Мальтоза Сахароза Ианнит