Способ определения активности термостойких протеолитических ферментов
Иллюстрации
Показать всеРеферат
Изобретение относится к энзимологии, в частности к исследованию свойств протеолитических ферментов, и может быть использовано в микробиологической , медицинской, пищевой, кожевенной и кинофотопроььшшенности, а также в сельском хозяйстве. Целью изобретения является повьшение чувствительности способа и сокращение времени анализа при определении протеолитической активности. В основе предложенного способа определения активности протеаз - регистрация изменений светорассеяния (светопогт лощения) в процессе образования (Т фаза реакции) и распада (II фаза) агрегатов частично гидролизованных молекул белка. Из экспериментальных данных по измерению интенсивности светорассеяния в ходе протеолиза активность фермента может быть определена по формуле А kfll: dt k-tgo(, где I - интенсивность рассеянного светового потока в ходе 1 фазы реакции; t - время; о( - угол наклона кривой увеличения интенсивности в ходе реакции к оси абсцисс; k - коэффициент пересчета в соответствующие единицы активности. Изобретение предполагает проведение всей процедуры определения активности протеазы непосредственно в термостатированной ячейке нефелометра, за счет чего обеспечивается сокращение числа операций в ходе анализа. Кроме того, нефелометрический метод, включенный в способ определения протеолитической активности, оказывается в данном случае более чувствительным , чем широко используеъйгй спектрофотометрический, и не требует длительной инкубации с целью накопления определимых концентраций продукта (время анализа сокращается в среднем в 3-5 раз). Чувствительность предложенного способа возрастает с повышением температуры реакции, поэтому изобретение целесообразно использовать для протеолитических ферментов , обладающих максимальной активностью в интервале температур от 45 до 99°С. 3 ил,, 2 табл. СЛ 00 (У1 ел
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК (19) (11) (д1) 4 С 12 Q 1/38, G 01 1 1 33/68
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
ГОСУДАРСТ8ЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР (21) 3941263/28-13 (22) 02.08.85 (46) 30.01.89. Бюп. № 4 (71) Всесоюзный научно-исследовательский институт особо чистых биопрепаратов (72) Н.А. Климов, В.И.Батавии, А.А.Щербаков и О.А.Андреев (53) 577.156 (088.8) (56) Bergmeyer Н.U. Methods of
Enzymatic. Analysis, 1984, ч, Ч, (3dEd), р. 2?О. (54) СПОСОБ ОПРЕДЕЛЕНИИ АКТИВНОСТИ
ТЕРЯОСТОЙКИХ ПРОТЕОПИТИЧЕСКИХ ФЕРМЕНТОВ (57) Изобретение относится к энэимологии, в частности к исследованию свойств протеолитических ферментов, и может быть использовано в микробиологической, медицинской, пищевой, кожевенной и кинофотопромьппленности, а также в сельском хозяйстве. Целью изобретения является повьппение чувствительности способа и сокращение времени анализа при определении протеолитической активности. В основе предложенного способа определения активности протеаз — регистрация изменений светорассеяния (светопог-, лощения} в процессе образования (T фаза реакции) и распада (II фаза) агрегатов частично гидролизованных молекул белка. Иэ экспериментальных данных по измерению интенсивности светорассеяния в ходе протеолиза активность фермента может быть определена по формуле А = k4I 1) t
= k . tgg, где I ..— интенсивность рассеянного светового потока в ходе 1 фазы реакции; t — время; (— угол наклона кривой увеличения интенсивности в ходе реакции к оси абсцисс; коэффициент пересчета в соответствуюшие единицы активности. Изобретение предполагает проведение всей процедуры определения активности протеазы непосредственно в термостатированной ячейке нефелометра, за счет чего обеспечивается сокращение числа операций в ходе анализа. Кроме того, нефелометрический метод, включенный в способ определения прот еолитической активности, оказывается в данном случае более чувствительным, чем широко используемый спектрофотометрический, и не требует длительной инкубации с целью накопления определимых концентраций продукта (время анализа сокращается в среднем в 3-5 раз). Чувствительность предложенного способа возрастает с повышением температуры реакции, поэтому изобретение целесообразно использовать для протеолитических ферментов, обладающих максимальной актив" иост ью в интервале темпер атур от 45 до 99 С. 3 ил., 2 табл.
1 1454855 2 где Апротеолитическая активность взятого для анализа количества ферментного препарата; интенсивность рассеянного или поглощенного светового потока в ходе 1 фазы реакции (см.фиг.1); время; угол наклон кр и увели 55 чения интенсивности во времени к оси абсцисс (см. фиг.l); коэффициент пересчета в соответствующие ед, активности, Изобретение относится к энзимологии, а частности к исследованию свойств протеолитических ферментов,,и может быть использовано в микробиологической, медицинской, пищевой, кожевенной и кинофотопромьппленности, . а также в сельском хозяйстве.
Цель изобретения - повышение чувствительности способа и сокраще- 10 ние времени анализа при определении активности протеолитических ферментов.
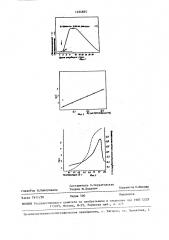
На фиг,1 показ анм изменения оптических характеристик раствора казе- 15 ина при добавлении протеолитического фермента, момент внесения протеолитического фермента указан стрелкой; на фиг.2 - зависимость между протеолитической активностью пре пар ат а 20 нейтральной протеинаэы Bacillus
thekmonon - liquefaciens ТР 1 /1 и величиной tgc(; на фиг.3 — зависимость протеолитической активности ферментного препарата термолиэин и 25 величины tg от температуры (протеолитическая активность, величина
tg 4 -х- -х-).
Основу предлагаемого способа составляет регистрация изменений свето- 30 рассеяния (светопоглощения) в процессе образования (1 фаза реакции) и распада {II фаза) агрегатов ч.:«..тйчно гидролиэованных молекул белка.
Скорость коагуляции продуктов про= теолиза пропорциональна их концентрации в реакционной смеси, а следовательно, и активности протеазы, Иэ экспериментальных данных по измерению интенсивности светорассеяния в 40 ходе ферментативного гидролиза белка активность фермента может быть определена по формуле
В отличие от известного способа, где спектрофотометрическому определеипо продуктов реакции предшествуют ее остановка и отделение непрореагировавшего белка фильтрованием или центрифугированием, изобретенке предполагает проведение всей процедуры определения активности непосредственно в термостатированной ячейке нефелометра, в которую помещают пробирку с раствором субстрата (0,25-3%-ный казеин) на буфере с
СаС1» добавляют исследуемый образец и инкубируют смесь при температуре„ близкой к оптимальной для исследуемог о фермента. Измерение инт енсивно сти светорассеяния осуществляется в ходе реакции протеолиза.
Испол ьз ов анн е изобретения об ес печивает сокращение числа операций в пр оцес се определении фер кент ати вней активности протеаз.
Кроме того „. яефелометуическнй метод в данном случае оказывается более чувствителы-:ык по сравнению со спектрофотометрическим, т. е. дает воэможность определять количества продукта, которые не обнаруживаются в аналогичных условиях по поглощению при 280 нк. Вследствие этого отпадает необходимость в длительной инкубации, преследующей цель накопления з среде достаточной для обнару" жения концентрации продукта, и время анализа может быть уменыпено B среднем в 3-5 раз.
Чувствительность пр едлаг аекого способа возрастает с повышением тек0 пературы реакции, однако при t > 99 С измерение оптических характеристик в пробе становится невозможным из-за интенсивного образования пузырей, Поскольку способ также неэффективен, o при температурах ниже 45 С, можно заключить, что изобретение обладает положительным эффекток (повьппение чувствительности, сокращение времени анализ а) для протеаз с оптимумом
0 температуры от 45 до 99 С.
Пример 1, Для определения активности нейтральной протеазы, выделенной нз культур альной жидкости
Васillus thermoпоп1i quef ac i ens
TP 1/1, готовят 1%-ный раствор казеината натрия в 50 кК трис-HC1 (рН
7,0) с 1 мМ Са01, который разлквают в .пробирки по 2,4 кл„Пробирки помез 1454855
4 щают в термостатированные ячейки ие«тупает известному в точности опредефепометра и инкубируют при 60 С с ления (см,табл.2), обладает более
0,1 мп раствора фермента в разных высокой чувствительностью по сравнеразведениях. Измеряют кинетику свето- нию с определением по поглощению в
5 рассеяния в первой фазе реакции, Ре- УФ-области; чувствительность его зультаты измерений представлены на возрастает с повышением температуры фиг.2. Иэ полученных данных следует, Т абли лиц а2
Протеолитнческая активность
Фермент
По ГОСТ Предлагаемым
20264. 2-74 способом
Протосубтилин
Термолизин
0,20 0,006 0,19 0,006
6,86 0)04
1,46 0,03
0,24 0,007
Прототер" 6 8 0,03 мин
19520 03
0,25 0,006
Величина tg < при 50 С
Пр от еолитическая активность, выраженная в ед. ГОСТ
20264. 2-74
HcIIoJIbsoBание изобретения IIABBo ляет значительно повысить чувствиЗ5 тельность анализа и сократить время, затрачиваемое на определение активности большой группы протеолитических ферментов (с оптимальной температурой реакции от 45 до 99 С), 40 широко используемых в различных областях народного хозяйства.
1,02-0,05
1,61 0,06
2в75 0е08
5,0 0,12
0,21-0,01
0 43 0 0?
0,85 0,04
1,74 0,06
Формула из обр ет ения, что величина tgd прямо пропорциональна активности фермента, а величина К 10 в данных условиях определения равна
0,08 0,003, Пример 2. Дпя определения активности препарата Протосубтилизин
rú
ГЗХ готовят l Ilblé 1 à.лвор казеина в 50 мМ трис-НС1 буфере (рН 7,0) с 1 мМ СаС1 . Активность различных разп едепнй препарата определяют как в примере 1, но инкубацию ведут.при температуре 50 С. Параллельно опреде" 20 ляют активность фермента в аналогичных условиях.
Pезультаты сравнительного анапил за представлены в табл.1 и свидетельст.вуют о четкой корреляции между величи" 25 ной tg c(и активностью протеазы, определенной известным методом и выраженной в соответствующих единицах.
Т аблица1!
5,2-0,? 2
1,05й0,05
0,15"0,005
4,8 0,025
1,2 0,05
5,15+0,20
1 00+0,05
0,145 0,004
4,86 0,024
1,16 0,045
Пример 3. Активность термолизина определяют как в примере 1, но при т емпер атур ах от 40 до 83 ОС.
Пар аллельно в аналогичных условиях определяют активность фермента известным способом и выражают ее в микромолях тирозина, перешедшего в раствор за 1 мин.
Результаты приведены на фиг.3.
Анализ полученных результатов показывает, что активность протеаэ, опр еделя емая поедлагаемым способом, четко коррелирует с величинами, полученпы п1 спектр офотометрическим методом; преплягаемый способ не ус45 Способ определения активности термостойких протеолитических ферментов, включающий инкуб ацию ферментного препарата с раствором казеина в буфере при оптимальной температуре реакции и определение продуктов гидролиза оптическими методами,отличающийся тем, что, с целью IIDBblllleHHH чувствительности способа и сокращения времени
55 анализа, измеряют интенсивность светорассеяния непосредственно B реакционной смеси при оптимальной для исследуемого фермента температуре в интервале 45-99 С.
1454855 фамэ веуФуию prwrv) а.7
О7 Ог З
Д 1 ЙЕ.(ед ЯС7Жйбйй- r4}
М 47 ХЛ бУ бЮ 71
rr euem Ф ) Составитель О. Скуратовская
Техред М.Ходанич Корректор С.Шекмар
Редактор Н.Киштулинец
Тираж 500
Подписное
Заказ 7411/30
ВНИИПИ Государственного комитета по изобретениям и открытиям нри ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул . Проектная, 4