Способ получения гидроперекиси н-децила
Иллюстрации
Показать всеРеферат
Изобретение касается перекисных соединений, в частности способа получения гидроперекиси н-децила, которая применяется в качестве инициатора при получении полимеров. Цель - увеличение скорости накопления целевого продукта. Процесс ведут жидкофазным окислением декана кислородом воздуха при 130-150°с в присутствии катализатора. В качестве последнего используют ионообменную смолу на основе сополимера метакриловой кислоты и дивинилбензола КБ-4П2 в NA<SP POS="POST">+</SP> - форме с нанесенными ионами CO<SP POS="POST">2</SP>+ или смеси ионов CO<SP POS="POST">2</SP>+ и NI<SP POS="POST">2</SP>+, или смеси ионов CO<SP POS="POST">2</SP>+, NI<SP POS="POST">2</SP>+, CU<SP POS="POST">2</SP>+. Способ позволяет увеличить скорость накопления гидроперикиси до 1,20-4, 4,32 мол.%/ч, что в 7,83-19,53 раза выше, чем в известном способе. 3 табл.
1 с, use
;КГ
СС",ОЗ СОВЕТСКИХ.
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
„.ЯО„,, 14829 Л
А1
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPCHOMV СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР (21) 4180425/31-04 (22) 04. l2.86 (46) 30.,05.89. Бюл. Р 20 (71) Институт теоретических проблем химической технологии АН АЗССР (72) Т.Н.Шахтахтинский, А.М.Рагимова, Э,И.Саркисова, Р.Г.Сулейманова, Ю.М.Султанов и А.А.Эфендиев (53) 547.943 ° 607 (088,8) (56) Солдадзе А.M. и др. Ионообменные высокомолекулярные соединения, с.118, 1960 r, М,: Наука.
Копылова В.Д. и др. Ионитные комплексы в катализе, М.: Химия, 1987, с.23.
Жур.физ. хим. с.711 1955. (54) СПОСОБ ПОЛУЧЕНИЯ ГИДРОПЕРЕКИСИ
Н-ДЕЦИЛА (57) Изобретение касается перекисИзобретение относится к способу получения гидроперекиси н-децила, которая находит применение в качестве инициатора при получении полимеров.
Целью способа является увеличение скорости накопления целевого .продукта.
Предлагаемый способ иллюстрируется нижеприведенными примерами.
Для получения катализатора карбоксильную дивинилбензольную смолу
КБ-4П2 в натриевой форме оставляют в течение 7-12 ч в контакте с 0,05М раствором соответствующей соли металла (в данном случае использованы растворы хлорида кобальта СоС1д 6Н О и (59 4,С 07 С 179/025, 178/00
В 01 J 31/08, 23/74
2 ных соединений, в частности способа получения гидроперекиси н-децила, которая применяется в качестве инициатора при получении полимеров.
Цель — увеличение скорости накопления целевого продукта. Процесс ведут жидкофазным окислением декана кислородом воздуха при 130-150 С в присутствии катализатора. В качестве последнего используют ионообменную смолу на основе сополимера метакриловой кислоты и дивинилбензола
КБ-4П2 в Na -форме с нанесенными ионами Со вЂ, или смеси ионов Со и
Ni, или смеси ионов Со, Ni
Cu . Способ позволяет увеличить скорость накопления гидроперекиси до 1,20-4,32 мол.%/ч, что в 7,8319,53 раза выше, чем в известном способе, 3 табл. хлорида никеля ИхС1 6Н О, а также раствор серно-кислой меди CuS04 5Н О, Количество нанесенного металла зависит от продолжительности контакта и составляет 4-5,5 мг-экв/г. Смолу промывают водой и сушат при 80 С.
Количество нанесенного металла определяют методом комплексометрического титрования трилоном Б в при сутствии мурексида.
Реакцию осуществляют в стеклянном термостатированном реакторе, в который впаян фильтр Шотта и патрубок для .ввода газа. Реактор снабжен обратным холодильником. Окисление проводят в жидкой фазе техническим кис1482914 лородом со скоростью 3,2 л/ч при атмосферном давлении и температурах
130-150 С. Реактор термостатируют до заданной температуры, включают для барботажа через реакционную массу окисляющий газ,вводят катализатор и углеводород. По ходу окисления отбирают пробы, которые анализируют на содержание гидроперекисей, 10 карбонильных соединений, сложных эфиров, спиртов, карбоновых и летучих низших кислот, альдегидов, а также углекислого газа.
Гидроперекиси определяют нодо- 15 метрически, карбонильные соединения и сложные эфиры — спетрофотометрически, спирты — алкилнитритным методом, карбоновые и летучие низшие кислоты — обратным тетрованием спир- 20 товым раствором гидроокиси калия, углекислый .газ — определением непрореагировавшего количества гидроокиси бария (во время эксперимента выделившийся газ проходит через склянки, 25 последовательно соединенные и заполненные дистиллированной водой и раствором гидроокисн бария) .
После проведения реакции окисления катализатор отделяют фильтрова- 30 нием от оксидата. Катализатор может быть использован неоднократно.
Оксида.т нейтрализуют 5%-ным водным раствором углекислого калия.
Отделив от водного слоя„ оксидат обрабатывают 25Х-ным охлажденнм (лед, соль) раствором гидроокиси натрия.
Обработку, повторяют 3 раза. Полученные водные вытяжки собирают в стеклянную посуду и обрабатывают охлажденным петролейным эфиром. Затем через водные вытяжки пропускают углекислый газ. Образуются два слоя— г
4 органический и водный. Органический слой отделяют от водного и сушат.
Полученные гидроперекиси определяют иодометрически.
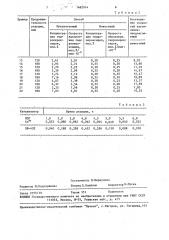
Результаты по примерам 1-12 приведены в табл.1.
В табл.2 приведены результаты проведения процесса по предлагаемому и
I известному способам в сравнимых условиях (за исключением катализатора— . 2 в известном способе — соль Со ).
В табл.3 приведены сравнения результатов проведения процесса с использованием предлагаемого катализатора и известного катализатора— полиэтиленгликоль с нанесенными ионами Со
Как видно из приведенных примеров, предлагаемый способ позволяет увеличить скорость накопления гидроперекиси до 1,20-4,32 моль. 7 в 1 ч, что в 7,83-19,53 раза выше, чем в известном способе.
Формула иэ обретения
Способ получения гидроперекиси и-децила жидкофазным окислением декана кислородом воздуха при 130-150 С в присутствии катализатора, содержащего ионы металла переменной валентности, отличающийся тем, что, с целью увеличения скорости накопления целевого продукта, в качестве катализатора используют ионообменную смолу на основе сополимера метакриловой кислоты и дивинилбензола КБ-4П2 в Na -форме с нанесенными
« 2 ионами Со, или смеси ионов Со и
° ь2 ° +2
Ni, или смеси ионов Со, Ni u
+9.
1482914
«СЪО ВeeON л
Е В Л е Ъ л т вЪ О а с с с 1 е 1 ° 1 еч еечееъеълеь е е
ОО е ООСЕО ееъ ееъ е ъ чг» е еее й
СЧлф Еффал
C O eNQelCO в в е в в а е в в
N.ЕЕЪ N О Е ф Е Ъ ф ЕЕЪ
О Ю ЕЪ О Л В Е ЕЧ ЕЪ
ЕЧ а ЕЕ Ф ф еЪ Л.Е Ъ О в а а в а е е в а
СЧ О
N C
° » РЪ е в е
СЧ» \Ч
IA
N Yl N ЕеЪ.N ЕеЪ в «N
ОООQаeоо. е е ааечсчРъе ъсчсч ф Io ch
ООЕе)УЪЛЛAA Л Л СЧ в а с в в а 1 в 1 а в
ЕЧСЧ Ффав в Ее\ С4Ъ в,в о аа тоeeбееЪ
CO Ф O N а сФ СЧ Ф
O Q O O IO % O O C O
CO CO N N РЪ 6Ъ ЕЧ N ф CO
О О е Ъ ееЪ л Л еЪ е Ъ Ф Ф в е е с е с е а е е сЧ сЧ Ф еЕ сО Ф Ф »» е 1 1 в а с а а
»» е»» е»»» °
V Е Ъ О О СЧ СЧ О О П Л ЕеЪ Л О О О О О.О
ФОЪОСФФОЪОЪ вв ЮФЪЕ ЪРЪЕЕЪЕ ЪЕ ) с в е в в а а в а в а а с а в в а е
QOQO»»OOOO ОООООООО
ФФФФФФФФФО ФОФОееъФОееь с е с а в в . е е с ° 1 с с с а 1 а е ФФ ев.е Ф ФФ Ф Ф Ф»ФЕЕЪ ФЛЕРЕ дййй88888И
О О
° Ф ее
О СЧ
» СЧ ОЪ в ЕЕЪ а Л ф CCI
ООООООООО еЕ Ф е ЪееЪ в° »» «»»»» е
СЧ ее\ е
CO Ф ееЪ
СеЕ ФЪ с 1
Щ N
° Ф
О о в в
° Л а Ф
Еее. Л
CO 0 е с л еч. еее
D в
РЪ
CO
Л
РЪ
О
О
О еч е
1 > I
1482914
Таблица2
Продолжис тельность
Способ
СоотношеПример ние скорос. тей накопПр едлаr аемый
Известный реакции, мин ления:
Концентрация гидропероксидов, мол.%
Концен тр ация гидропероксидов, мол.% предлагаеемый известный
Таблица3
Катализатор
Время реакции, ч
1,0 2,0 3,0 4,0
0,052 0,080 0,062 0,042
4,5 5 0 5,5 6,0
0,044 0,040 0,040 0,032
ПЭГ
Со
КБ-4П2
0,040 0,188 0,338 0,452 0,526 0,.150 0,088 0,070
Составитель M.Ìåðêóëoâà
Техред Л. Олийнык Корректор И Муска
Редактор M.Íåäoëóæåíêo
Заказ 2755/19 Тираж 351 Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., д. 4/5
П оизводственно-издательский комбинат Патент, г.ужгород, ул. Гагарина,1 и II
Г н 101
13
14
16
17
18
19
21
180
2,41
4,93
2,70
5,39
3,74
7, 16
4,07
6,37
2 35
7,03
Скорость накопления гидропероксидов, мол.%/ мин 10
2,01
2,74
2,25
2,99
3,12
3,98
3,39
3,54
1,96
3,91
0,30
0,35
0,30
0,35
0,30
0,35
0,30
0,35
0,30
0 35
Скорость образован. гидропероксидов, мол.%/минч
«10
0,25
0,20
0,25
0,20
0,25
0,20
0,25
0,20
0,25
0,20
8, 03
13,60
11,25
14,97
12,47
19,89
13,57
17,69
7,83
19,53