Способ определения цитохромоксидазы в фотосинтезирующих организмах
Иллюстрации
Показать всеРеферат
Изобретение относится к экспериментальной биохимии и физиологии растений и может быть использовано в научных исследованиях по растениеводству и биотехнологии культур фототрофных микроорганизмов для диагностических целей. Целью изобретения является ускорение, упрощение и повышение точности способа за счет предотвращения инактивации фермента путем сохранения структурной целостности образца. Для определения цитохромоксидазы в фотосинтезирующих микроорганизмах измеряют спектры действия фотостимуляции ингибированного окисью углерода дыхания. При этом исключают этап препаративного получения фермента из разрушенных образцов. Спектры действия реакции цитохромоксидазы регистрируют непосредственно в целых клетках или тканях фотосинтезирующих организмов, у которых селективно подавляют изменения фотосинтетического газообмена О<SB POS="POST">2</SB>. Фотосинтетическое выделение О<SB POS="POST">2</SB> подавляют ингибитором диуроном. Реакцию фотопоглощения О<SB POS="POST">2</SB> хлоропластами стабилизируют в режиме светового насыщения путем непрерывного воздействия на образец фоновым светом 650 - 700 нм, который избирательно возбуждает хлорофилл. Ускорение записи спектров действия достигается за счет использования режима импульсного возбуждения комплексов цитохромоксидаза - СО монохроматическим светом переменной длины волны в области 400 - 600 нм, мощностью 1 - 10 Вт/м<SP POS="POST">2</SP>, длительностью 1 - 10 с с темновыми интервалами 10 - 60 с и полярографической регистрации быстрых фотоиндуцированных изменений скорости поглощения О<SB POS="POST">2</SB> у зафиксированного на поверхности платинового электрода образца. Количественным критерием активности фермента в образце принимают максимальную скорость поглощения О<SB POS="POST">2</SB> при насыщающих интенсивностях света 400 - 600 нм. 1 ил.
СОЮЗ СОаЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
ГОСУДАРСТ8ЕННЫЙ КОМИТЕТ
IlQ ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
1 (21 ) 4395460/31-13 (22) 21.03.88 (46) 30.12.89. Бюл. И- 48 (71) Институт почвоведения и фотосинтеза АН СССР (72) В.А. Бойченко (53) 541.144.7(088.8) (56) Peschek G.À. Occurrence of
cytochrome aa3 in Anacystis nidulans
Biochim. — Biophys. Acta, 1981, v.635, Р 3, 470-475. (54) СПОСОБ ОПРЕДЕЛЕНИЯ ЦИТОХРОМОКСИДАЗЫ В ФОТОСИНТЕЗИРУ!ОЩИХ ОРГАНИЗМАХ (57) Изобретение относится к экспериментальной биохимии и физиолргии растений и может быть использовано в научных исследованиях по растениеводству и биотехнологии культур фототрофных микроорганизмов для диагностических целей. Целью изобретения является ускорение, упрощение и повынение точности способа за счет предотвращения инактивации фермента путем сохранения структурной целостности .образца. Для определения цитохромоксидазы в фотосинтезирующих микроорганизмах измеряют спектры действия фотостимуляции ингибированного окисью углерода дыхания. При этом исключают этап препаративного
Изобретение относится к экспериментальной биохимии и физиологиии растений, а именно к экспресс-методам определения ключевого дыхательного. фермента цитохромоксидазы в целых клетках и тканях фотосинтеэи„„SU„„1532586 А 1 (51)4 C 12 Q 1/26; G 01 N 21/63
2 получения фермента из разрушенных образцов. Спектры действия реакции цитохромоксидаэы регистрируют непосредственно в целых клетках или тканях фотосинтезирующих организмов, у которых селективно подавляют изменения фотосинтетического газообмена
О . Фотосинтетическое выделение О подавляют ингибитором диуроном. Ðåàêцию фотопоглощения О хлоропластами стабилизируют в режиме светового насыщения путем непрерывного воздействия на образец фоновым светом 650700 нм, который избирательно возбуждает хлорофилл. Ускорение записи спектров действия достигается за О ф счет использования режима импульсного возбуждения комплексов цитохромоксидаза-СО монохроматическим светом переменной длины волны в области 400- С
600 нм, мощностью t-10 Вт/м, длительностью 1-10 с с темновыми интервалами 10-60 с и полярографической регистрации быстрых фотоиндуцированных изменений скорости поглощения О у зафиксированного на поверхности пла тинового электрода образца. Количест- Ьь
1 венным критерием активности фермента Q в образце принимают максимальную ско- (р рость поглощения 0 при насыщающих интенсивностях света 400-600 нм. 1 ил.
I рующих организмов, и может быть использовано в научных исследОваниях по растениеводству и биотехнологии культур фототрофных микроорганизмов. для диагностической характеристики типа и функционального состояния ды1532586 ха ельного метаболизма в зависимости от внутренних и внешних факторов.
Целью изобретения является ускорени, упрощение и повышение точности способа за счет предотвращения инакти ации фермента путем сохранения ст уктурной целостности образца.
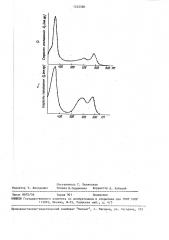
На чертеже спектры действия погло ения 0 при фотодиссоциации компле сов цитохромоксидаза-СО в клетках хл реллы (а) и листе пшеницы (б) на им ульсном монохроматическом свету с не рерывным фоновым облучением свето 650-700 нм 1,2 ВТ/м2 . Концентрац диурона 10 М.
Пример 1. Одноклеточные зелень е водоросли хлорелла (Chio re 1 lа
v 1яаг«.з) выращивают 5 дней на агаров субстрате с минеральной средой
Т ия в атмосфере воздуха +1% СО п и непрерывном освещении л«аминесцент ыми лампами ЛБ-40 5 Вт/м .
На поверхность платинового электр да площадью 20 мм наносят тонкий ой суспензии клеток хлореллы, сод ржащих 0,5-1 мкг хлорофилла, и фикс руют его целлофановой мембраной.
П лярографическую ячейку заполняют п одутым газовой смесью 10-20K Oz и 80-90% СО раствором 0.05 М КС1, 0 05 М натрий-фосфатного буфера (Н 6,8) и 10 М диурона.
Образец освещают непрерывным ф новым светом в области 650-700 нм
1 2 Вт/Mz . Через несколько минут в лючают импульсный измерительный с ет с длительностью световых и темнов «х интервалов 1 и 10 с. Спектр измер тельного света монохроматора со 40 с««ектральной шириной щелей 3-10 нм сканируют в области 400-650 нм со скоростью 15-20 нм/мин. Оптимальная и «тенсивность измерительного света ддя всего спектра составляет 110 Вт/м2 ° На самописце регистрируют импульсы уменьшения полярографического тока, соответствующие скорост1и поглощения Oz при фотодиссоциации к омплексов цитохромоксидаза — СО.
Измеряют амплитуду импульсов тока
И после коррекции на распределение
=.1нергии измерительного света строят
« рафик зависимости, относительной ве- ,««ичины скорости поглощения Оа от дли« ы волны (а).
Из спектра действия вццно, что комплекс цитохромоксидаза-СО хлореп«п« имеет полосы поглощения 425-430 и 590593 нм- (а).
Таким образом, характерная структура спектра действия фотостимуляции поглощения О служит основным критерием в качественном определении фермента у исследуемого образца.
Пример 2. Проростки яровой пшеницы сорта Московская 36 выращивают 14 дней на вермикулите при световом режиме 14 ч освещения люминесцентными лампами 16 Вт/м и 10 ч темноты.
На поверхности платинового электрода фиксируют кусочек листа площа" дью 20 мм2, который инфильтрирован раствором 10 М диурона. Дальнейшая процедура аналогична примеру 1. В связи с более высоким диффузионным сопротивлением ткани листа длитель-. ность импульсов измерительного света увеличивают до 10 с, а темновых интервалов до 30 с. Для ограничения времени записи спектра пределами 1520 мин диапазон 400-650 нм регистрируют по точкам с интервалами 1020 нм.
Спектр действия фотодиссоциации комплекса цитохромоксидаза-СО в листе пшеницы (б) подобен спектру водорослей. Отличия соотношения амплитуд полос в двух спектрах объединяются более сильным экранирующим эффектом хлорофилла в тканях растения.
Способ может быть использован не, только для качественного определения цитохромоксидазы, но и количественной оценки активности фермента в одноклеточных фотосинтезирующих микроорганизмах.
Пример 3. Культуры одноклеточных водорослей Chlorella vulgaris
CALU-246 и Stichococcus mirabilis
CALU-256 выращивают на агаровом субстрате со средой Р 6 СА1.U в атмосфере воздуха +iZ COz при освещении 5 Вт/м2.
Образец 7-дневной культуры водорослей фиксируют на электроде и помещают в среду как в примере 1. Образец освещают через монохроматор непрерывным фоновым светом 680 нм 1 Вт/м . Затем на 1 2 мин включают измерительный свет в области 400-600 нм интенсивностью 100 Вт/м, который выделяют из спектра лампы накаливания светофильтром СЗС22. Регистрируют величину уменьшения полярографического тока
1532586
Фо р мул а
Способ определения цитохромоксидазы в фотосинтезирующих организмах, 15. включающий заполнение полярографической ячейки буферным раствором, продувку раствора смесью 0 и СО, внесение исследуемого образца, полярографическую регистрацию спектров действия фотостимуляции ингибированной ,окисью углерода реакции поглощения кислорода при воздействии измерительного света в области 400-600 нм с последующей качественной оценкой, о т— л и ч а ю шийся тем, что, с целью ускорения, упрощения способа и повышения точности за счет предотвращения инактивации фермента путем сохранения структурной целостности
30 образца, в буферный раствор дополнительно вносят 5-10 мкм диурона, в качестве образца используют клетки или ткани объекта, образец фиксируют мембраной на поверхности электро-.
35 да причем полярографическую регист рацию осуществляют при одновременном непрерывном облучении фоновым светом
650-700 нм интенсивностью 1 Вт/м2, а воздействие измерительным светом
4Q осуществляют монохроматическим светом переменной длины волны интенсивностью 1-10 Вт/м, в импульсном режиме длительностью 1-10 с с темновыми
b интервалами 10-60 с, с последующей
45 количественной оценкой содержания фермента в образце по максимальной скорости поглощения кислорода при световом насыщении реакции.
7 9 10
Ч вЂ” — — - — — — — — — — — — 12 х
3,86 10 <-2 -10-<.0,86
«10 моль 0 /r сух. массы кл. с °
В серии из пяти измерений на раз- . ных образцах клеток водорослей эта величина у хлореллы составляет (12+
+2) «10 9, а у стихококкус (4+1) "
«10 моль 0 /r сух. массы клеток. с . Таким образом, способ выявляет видовые различия в активности реакции фермента.
Количественным критерием активности фермента в образце принимают максимальную скорость поглощения 0 при насыцающих интенсивностях света s области 400-600 нм.
Предлагаемый способ определения цитохромоксидаэы позволяет определять фермент непосредственно в фотосинтеэирующем организме без предварительного разрушения образца, выделения и очистки фермента, что в сочетании с применением быстрого метода регистрации спектров действия значительно (в
16-33 раза) сокращает время на проведение анализа. на измерительном свету и рассчитывают скорость поглощения 0 при световом насыщении реакции фотодиссоциации комплексов цитохромоксидаэа-СО в клетках образца (по закону Фарадея 1 моль 0 /с = 3,86 А).
В образце 20 мкл суспензии хлореллы, содержащей 0,85 г сухого вещества клеток.на 1 л суспензии, зарегистрирована величина уменьшения полярографического тока при световом насыщении фотостимулированного дыхания 7,9;10 А. Расчет активности (V) цитохромоксидазы в клетках образца:
Способ упрощает и повьппает точност определения, так как при очистке теряется до 407 фермента, а неопредеЛенные потери его на предшествующих стадиях не позволяют оценить содержание и активность цитохромоксидазы в целых клетках и тканях.
Способ позволяет с достаточной точностью диагностировать функциональное состояние дыхательного метаболизма фотосинтетических организмов в зависимости от внешних и внутренних факторов. из обретения
1532586 50 ОЮ 050 БХ В
Р едактор Т. Лазоренко
Э аказ 8070t36 Тираж 501 Подписное
ВйИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская. наб., д. 4/5
Производственно-издательский комбинат "Патент", r. Ужгород, ул. Гагарина, 101 фь ф ь
Ф ф ь ь ь
Сос тавитель Г. Белянская
Техред Л.Сердюкова Корректор В. Кабаций