Способ количественного определения каталитически активных молекул сериновых протеиназ бацилл
Иллюстрации
Показать всеРеферат
Изобретение относится к аналитической химии ферментов и представляет собой способ количественного определения каталитически активных молекул сериновых протеиназ бацилл. Цель изобретения - повышение чувствительности и специфичности анализа. Анализируемый фермент взаимодействует с иммобилизованным на твердой фазе овомукоидом из белка утиных яиц или белковым ингибитором сериновых протеиназ из семян кукурузы. Полученный комплекс обрабатывают антителами к этому ферменту,меченными другим ферментом с более высокой активностью. Детекцию осуществляют по активности связавшейся метки. 2 ил.
-СОВХОЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И OTHPbfTHAM
ПРИ ГКНТ СССР (21) 4467468/31-13 (22) 28.07.88 (46) 15.11.90. Бюль У 42 (71) Институт биохимии им. А.Н.Баха (72) А. В. Жердев, Б. Б. Джантиев, Т. А. Валуева, В. В. Мосолов и Л. И. Гри>орьева (53) 663. 15(088.8) (56) Shirahata А., Christman К. L., Pegg А. Е. Quantitation of S-adenosylmethionine decarboxylase protein.—
1985, Biochemistry, v. 24, Н- 16, р. 4417-4423.
Delpech В., Chanzy С., Davean М., Lebreton J. — Р.Ä Bertrand i P. An1
nie О. Caracterisation и une hyaluronidase de type lysosmal dans le milien de culture de deux lignees cellulares derivees d hepatomes humains—
1986, Comptes rendus de 1 Academic
des sciences, t. 302, serie III
9 16 р ° 593-596.
Изобретение относится к аналитической химии ферментов, а именно к способам количественного определения каталитически активных молекул ферментов в биологических и биотехнологических препаратах.
Цель изобретения — повышение чувствительности и специАичности анализа.
Способ осуществляют следующим образом.
Пример 1. В лунки стандартных полистироловых микропланшетов для иммуноАерментного анализа вносят
З „„ 1606940 А I
51)5 С Of N 33/53 С 12 М 9/54
2 (54) СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕ
НИЧ КАТАЛИТИЧЕСКИ АКТИВНИХ МОЛЕКУЛ
СЕРИНОВЫХ ПРОТЕИНАЗ БАЦИЛЛ (57) Изобретение относится к аналитической химии Аерментов и представляет собой способ количественного определения каталитически активных молекул сериновых протеиназ бацилл. Цель изобретения — повышение чувствительности и специфичности анализа. Анализируемый фермент взаимодействует с иммо-билизованным на твердой фазе овомукоидом из белка утиных яиц или белковым ингибитором сериновых протеиназ из семян кукурузы. Полученный комплекс обрабатывают антителами к этому Аерменту, меченными другим Аерментом с более высокой активностью. Детекцию осуществляют по активности связавшейся метки, 2 ил. по 100 мкл 0,1 М калий-Аосфатного буфера, рН 6,3, содержащего овомукоид из белка яиц утки в концентрации
0,1 мкг/мл. Планшет инкубируют при
37 С в течение 2 ч, затем удаляют из лунок раствор отсасыванием и вносят
100 мкл fi!-. ного раствора бычьего сывороточного альбумина в том же буфере. После 30 мин инкубации при 37 С Й лунки 4-кратно промывают 0,05 М калий-фосфатным буАером, рН 7,4, содержащим 0,1 h NaC1 и 0,053 твина-20 (буфер Х), и вносят анализируемую пробу, содержащую сериновую протеина1606940 зу бацилл, разбавленную буфером Х не менее, чем в 2 раза. Планшет инкубируют 20 мин при 37 С, 4-кратно промывают буфером Х и вносят по 1.00 мкл раствора конъюгата поликлональных кроличьих антител против сериновой протеиназы с пероксидазой в концентрации 1,2 мкг/мл по пероксицаэе (Коньюгат синтезирован из IgC выделенных из сывороток с титром в ИФА 1: 100000, и пероксидазы хрена с. RZ- = 3,0 периодантным методом). Длительность инку.бации - 60 мин. Далее после четырех отмывок буфером Х и одной - дистилли- 15 рованной водой в лунки вносят раствор
5-аминосалициловой кислоты (5;О. мМ) +
+" Н,О, (1»8 мМ), рН 6,0, и после
10 мий инкубации при комнатной температуре определяют оптическую плотность при 490 нм.
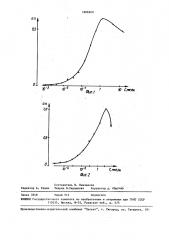
На фиг. 1 изображен типичный кали.бровочный график анализа. Чувствительность анализа до 10 нг/мл.
Средняя ошибка в серии измерений4,6Х.
П, р и м е р 2. Анализ проводят в соответствии с примером 1, но ад сорбцию ингибитора проводят при +4@ С в течение 16 ч. При этом чувствитель- 30 ность и точность определения не отличаются от примера 1.
Пример 3. В лунки полистироловых микропланшетов вносят по
100 мкл 0,1 М калий-фосфатного буфера, рН 7,0, содержащего ингибитор сериновых протеиназ из семян кукурузы, в концентрации 0,8 мкг/мл. Планшет инкубируют при 4 С в течение 16 ч затем удаляют иэ лунок раствор отсасыванием и вносят 100 мкл 1Х-ного раствора бычьего сывороточного альбумина в том же буфере. После 30 мин инкубации при 37 С лунки 4-кратно про мывают буфером Х (как в примере I) и вносят анализируемую пробу, содержащую срриновую протеиназу бацилл, раэ. Фавленную буфером Х не менее чем в
2 раза. Микропланшет инкубируют 10 мин йри 37 С и проводят дальнейший ана50 лиз по методике, приведенной в примере 1, вплоть до отмывки от иммунопероксидаэного конъюгата. После отмывки в лунки вносят по 100 мкл 3,7 мМ раствора орто-фенилендиамина в 30 мМ натрий-ацетатном буфере, рН 5,0, с
1,8 мМ Н О . Микропланшет выдерживают
10 мин в темноте при комнатной температуре, а затем останавливают реакцию, добавляют по 50 мкл 0,5 М Н,БО .
Оптическую плотность измеряют при
490 нм.
На фиг. 2 изображен калибровочный график анализа. Чувствительность анализа - 1 нг/мл. Средняя ошибка определения — 3,4Е.
Пример 4. В лунках микропланшетов проводят иммобилизацию ово--. мукоида из белка яиц утки и обработку бычьим сывороточным альбумином в соот-. ветствии с примером 1. После отмывки от альбумина буфером Х микропланшет промывают дистиллированной водой, высушивают и хранят при 4 С до 3 мес.
Далее анализ проводят в соответствии с примером 1, но концентрация . конъюгата составляет 2,0 мкг/мл (по содержанию пероксидазы).
Чувствительность определения
10 нг/мл, средняя ошибка — 8-10K., рабочий диапазон калибровочного графика достоверно не отличается от примера 1.
Предлагаемый способ по сравнению с известным позволяет увеличить чувст= вительность определения ферментов более чем в 10() рау, сократить время анализа более чем в 4 раза, а также существенно повысить специфичность анализа и упростить способ его проведения, для которого может использоваться стандартное оборудование для иммуноферментного анализа, имеющееся во многих исследовательских и клинических лабораториях.
Формула. изобретения
Способ количественного определения каталитически активных молекул сериновых протеинаэ .бацилл, предусматривающий проведение реакции анализируемого фермента с иммобнлизованным на твердой фазе реагентом, специфически связывающимся с активным центром фермента, и детекцию образовавшегося комплекса путем взаимодействия со специфическими антителами, меченными другим ферментом, с последующим определением активности связавшейся метки, отличающийся тем, что,. с целью повышения чувствительности и специфичности анализа, в качестве реагента, специфически связывающегося с активным центром фермента, используют овомукоид иэ белка утиных яиц или белковый ингибитор сериновых протеиназ из семян кукурузы.
1606940
ОЯ
Составитель В. Банзакова
Редактор А, Ревин Техред Л.Сердюкова Корректор А. Обручар
Заказ 3548
Тираж 514
Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-издательский комбинат "Патент", r. Ужгород, ул. Гагарина, 101
7,0
70 7
4ЬГ. 7
О Са ц
С жду