Способ определения активности иммуномодулятора
Иллюстрации
Показать всеРеферат
Изобретение относится к области медицины, в частности к клинической иммунологии, и может быть использовано для отбора лекарственных препаратов и для определения индивидуальной чувствительности к ним при назначении иммунокоррегирующей терапии. Целью изобретения является ускорение и повышение точности способа за счет того, что при добавлении исследуемого иммуномодулятора в среду с иммунокомпетентными клетками создаются единые условия культивирования путем помещения клеток на разные полупроницаемые мембраны, а их культивирование проводят в единой экспериментальной системе. Это исключает ошибки, связанные с изменением функциональной активности клеток, культивируемых в различных условиях, что повышает точность способа, при этом способ ускоряется в 2,5 раза.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (я)ю G 01 N ЗЗ/80
ГОСУДАРСТ8ЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4266232/14 (22) 19.06,87 (46) 23.07,91. Бюл. 6Ф 27 (71) 2-й Московский государственный медицинский институт им. H.È nèðîrîâà (72) M.À.Ñòåíèíà, А.Ю.Скрипник и А.А.Зернов (53) 616.07(088.8) (56) Методические материалы по экспериментальному (фармакологическому) и клиническому испытанию иммуномодулирующего действия фармакологических средств. МЗ СССР, Фармакологический Комитет, 1984, с. 5-10, (54) СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ИММУНОМОДУЛЯТОРА (57) Изобретение относится к области медицины, в частности к клинической иммуноИзобретение относится к медицине, точнее к клинической иммунологии, и может быть использовано для отбора лекарственных препаратов с иммуномодулирующей активностью, а также для определения индивидуальной чувствительности к ним при назначении иммунокорригирующей терапии.
Цель изобретения — ускорение и повышение точности способа за счет стандартных, единых .условий культивирования иммунокомпетентных клеток на разных полупроницаемых мембранах в единой экспериментальной системе.
Способ осуществляется следующим образом.
10 мл крови помещают в раствор этилендиаминтетрауксусной кислоты (10 мл
„„ Ы,„1665310 А1 логии, и может быть использовано для отбора лекарственных препаратов и для определения индивидуальной чувствительности к ним при назначении иммунокоррегирующей терапии, Целью изобретения является ускорение и повышение точности способа за счет того, что при добавлении исследуемого иммуномодулятора в среду с иммунокомпетентными клетками создаются единые условия культивирования путем помещения клеток на разные полупроницаемые мембраны, а их культивирование проводят в единой экспериментальной системе. Это исключает ошибки, связанные с изменением функциональной активности клеток, культивируемых в различных условиях, что повышает точность способа, при крови на 2 мл 2,7-ного раствора), разводят раствором Хенкса без Са++, Мо++, наслаивают на раствор фиколла-верографина, имеющий плотность 1,077. После центрифугирования при 400 o6/мин 45 мин собирают мононуклеарные клетки, концентрировавшиеся над слоем фиколла, отмывают фосфатным буфером (1500 об/мин, 15 мин, три раза), ресуспендируют в среде культивирования, содержащей антибиотики и 20 инактивированной человеческой сыворотки IV группы, доводят концентрацию клеток до 10х10 в мл. Часть мононуклеарных клеток используют для выделения фракции Т-лимфоцитов. Для этого 4х10 мононуклеарных клеток соединяют с равным объемом 1 -ной взвеси эритроцитов барана, центрифугируют при 1000 об/мин
1665310
10 мин, выдерживают 60 мин при +4 С, осторожно ресуспендируют и наносят на новую порцию фиколла. Центрифугируют при
400 об/мин 45 мин, собирают фракции . сконцентрировавшуюся на дне пробирки, добавляют к ней 1 мл дистиллированной воды для лизиса эритроцитов, отмывают в фосфатном буфере (1500 об/мин, 10 мин), ;ресуспендируют в среде культивирова ния и доводят концентрацию Т клеток до, 10х10 вмл.
В два,сосуда со средой культивирования помещают по пять полупроницаемых мембран (1, 2, 3, 4, 5), На мембраны 1 и 2 обоих сосудов помещают фракцию Т-клеток в объеме 0,05 мл, а на мембраны 3, 4, 5 обоих сосудов — фракцию мононуклеарных клеток в таком же объеме. Среду культивирования
,,сосуда 1 (опыт) дополняют иммуномодуля тором в соответствующей концентрации. В среду культивирования сосуда 2 (контроль) добавляют такое же количество среды куль тивирования, Сосуды с помещенными в них мембранами выдерживают при +37 С 48 ч. После этого вынимают мембраны 1, 2, 3, 4 из обоих сосудов, а в среду культивирования
, сосуда 1 и 2, в которой остались мембраны
, 5, добавляют Н-тимидин и культивируют еще 4 ч.
На мембранах 1 опытного и контрольного сосудов определяют экспрессию рецептора для Fc фрагмента IgG на Т-клетках, Для этого мембраны помещают в пробирки, содержащие 1;(,-ную взвесь эритроцитов быка, сенсибилизированных кроличьим IgG, выдерживают при+37 С 15 мин, а затем при
+4 С 1 ч. Находящиеся на мембранах клетки фиксируют 20 -ным раствором формалина и окрашивают гематоксилин-эозином общепринятым способом. В световом микроскопе подсчитывают процент розеток, образовавшихся на мембранах в присутствии и отсутствии иммуномодуляторов.
На мембранах 2 опытного и контрольного сосудов определяют внутриклеточное содержание циклического АМФ в
T-лимфоцитах в присутствии и отсутствии иммуномодулятора. Для этого мембраны подвергают многократному замораживанию и оттаиванию в ЭДТА-буфере для разрушения Т-клеток. Дальнейшее определение циклического АМФ проводят по методике, предлагаемой фирмой
Amersham, поставляющей наборы для onðåделений циклических нуклеотидов.
На мембранах 3 опытного и контрольного сосудов определяют экспрессию рецепторов для эритроцитов барана на мононуклеарных клетках. Для этого мембраны опускают в пробирки с 1 (,-ной взвесью эритроцитов барана, выдерживают при + 37 С 15 мин, а затем при + 4 С
60 мин. Находящиеся на мембранах клетки фиксируют 20 -ным раствором формалина и окрашивают гематоксилинэозином известным способом. В световом микроскопе подсчитывают процент розеток, образовавшихся на опытной и контрольной мембранах.
На мембранах 4 опытного и контрольного сосудов определяют экспрессию рецепторов к С3-компоненту комплемента на
10 мононуклеарных клетках. Для этого мембраны опускают в пробирки, содержащие 1 взвеси эритроцитов быка, сенсибилизированных антиэритроцитарными антителами и комплементом, выдерживают при +37 С
15 мин и фиксируют 20 -ным раствором формалина. Окрашивают клетки гематокси20 лин-зозином и в световом микроскопе подсчитывают число оозеток на опытной и контрольной мембранах.
На мембранах 5 опытного и контрольного сосудов определяют способность иммуномодулятора индуциро вать и ролиферацию покоящихся лимфоцитов, Для этого мембраны отмывают от невключившегося в клетки з
Н -тимидина и оценивают уровень пролиферации на каждой из них радиометриче25
35 ским методом.
Пример 1. Исследовали кровь здоровогодонора описанным способом. В качестве иммуномодулятора испольэовали тактивин. Результаты оценки действия тактивина на параметры функциональной активности лимфоцитов суммированы в табл.1, Данные проведенного анализа свидетельствуют, что тактивин увеличивает экс40 прессию Fc рецептора на Т-лимфоцитах, снижая при этом внутриклеточный уровень циклического АМФ, и не влияет на остальпримере 1, из крови здорового донора выделяли фракцию Т-клеток. В двух сосудах со средой культивирования размещали по 5 полупроводниковых мембран 1 — 5, на которые наносили по 0,5 мл Т-клеток. В двух сосудах со средой култивирования размещали по 5 полупроницаемых мембран (1 — 5), на которые наносили по 0,05 мл Т-клеток.
Осуществляли стимуляцию Т-клеток в каждом из сосудов к пролиферации путем добавления в среду культивирования митогенной дозы (5 мкг/мл) конканавалина
А и инкубации при +37 С 48 ч. Стимулиро.ванные Т- клетки переносили в два других сосуда со средой культивирования, не со50
55 ные исследованные параметры функциональной активности лимфоцитов.
45 Пример 2. Способом, описанным в
1бб5310
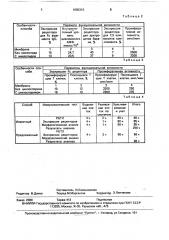
Таблица
Особенности способа
Па амет нк иональной активности
Внутри клеточный уровень циклического
АМФ вТ клетках, пмоль/10
Экспрессия рецептора для эритроцитов барана на мононуклеаах, Экспрессия рецептора для Fc фрагмента IgC на
Т клетках, П ролиферативная активрецептора для СЗ компонента ком племента на мононуклеаРах ОА
2 1
12,6
8,4
39
Мембрана
Без тактивина
С тактивином
15 держащей конканавалин А. Первый сосуд (опыт) дополняли иммуномодулятором (миелопид) в дозе 30 мкг/мл, а во второй (контроль) добавляли соответствующее количество среды культивирования. Через 5
24 ч инкубации при 37 С измеряли параметры функциональной активности пролиферирующих Т-клеток на каждой из мембран описанным способом, Результаты исследо-. вания влияния миелопида на пролифериру- 10 ющие T-клетки представлены в табл.2.
Данные проведенного анализа свидетельствуют, что конканавалин несколько увеличивает пролиферативную активность
Т-лимфоцитов, но не влияет на остальные l5 исследованные параметры функциональной активности, Пример 3. Способом, описанным в примере 1, из крови здорового донора выделяли фракцию Т-клеток. В двух сосудах со 20 средой культивирования размещали по две полупроницаемые мембраны, на которые наносили по 0,05 мл Т-клеток, В сосуд 1 с мембранами 1 и 2 добавляли митогенную дозу конканавалина А, а в сосуд 2 с мембра- 25 нами 3 и 4 — соответствующее количество среды культивирования. Оба сосуда инкубировали при +37 С 48 ч, После этого в сосуд
3 со средой культивирования переносили мембрану 1 из сосуда 1 и мембрану 3 из 30 сосуда 2. В сосуд 4 со средой культивирования переносили мембрану 2 из сосуда 1 и мембрану 4 иэ сосуда 2. Таким образом, в каждом из сосудов 3 и 4 находятся по две мембраны, на одной из которых культивиру- 35 ются. покоящиеся лимфоциты, а на другой— стимулированные митогеном к пролиферации. В сосуд 3 (опыт) добавляют иммуномодулятор (циклоспорин) в дозе 4 мкг/мл, а в сосуд 4 (контроль) — соответствующее коли- 40 чество среды культивирования. После инкубации при +37 С 24 ч измеряли параметры функциональной активности пролиферирующих и покоящихся Т-клеток способам описанными B примере 1. Результаты иссле дования влияния циклоспорина на пролифе рирующие и покоящиеся Т-клетки представлены в табл.3.
Таким образом, исследование эффектов циклоспорина в единой экспериментальной системе позволило выявить различие его действия на покоящиеся и пролиферирующие клетки: препарат не оказывал влияния на покоящиеся лимфоциты, но стимулировал экспрессию рецептора для Fc фрагмента IgG на пролиферирующих клетках и несколько ингибировал их пролиферацию, Таким образом, ускорение способа достигается эа счет того, что все тесты осуществляют в единой экспериментальной системе.
Сравнение предлагаемого и известного способов приведено в табл.4.
В предложенном способе произведена стандартизация условий выделения и культивирования исследуемых клеток (для всех иммунологических тестов клетки помещаются на одинаковые мембраны в одном сосуде). Это исключает ошибки, связанные с изменением функциональной активности клеток, культиBèðóåìûх в различных условиях, что повышает точность способа.
Формула изобретения
Способ определения активности иммуномодулятора путем добавления его в среду с иммунокомпетентными клетками с последующим определением их функциональной активности,отл ич а ю шийся тем,что, с целью ускорения и повышения точности способа эа счет стандартных единых условий культивирования, иммунокомпетентные клетки помещают на разные полупроницаемые мембраны, л их культивирование проводят в единой экспериментальной системе.
1665310
Таблица 2
Таблица 3
Таблица 4
Иммунологический тест
Культивирование и учет
Итого
Выделение клеток
Способ
2ч
1ч
1ч
80ч
ВОч
80ч
4ч
4ч . 4ч
Известный
Предложенный
90ч
2ч
Составитель И.Емельяненко
Техред M.Mîðãeíòàï Корректор Э.Лончакова
Редактор В.Данко
Заказ 2389 Тираж 413 Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5
Производственно-издательский комбинат "Патент", t, Ужгород, ул.Гагарина, 101
Р БТЛ
Экспрессия рецепторов
Морфологической анализ
Результаты анализа
РБТЛ
Экспрессия рецепторов
Морфологический анализ
Рез льтаты анализа
Разнесеwe клеток по системам
86ч
85v
85ч
256 ч
96ч
96ч