Способ определения активности фосфолипазы с
Иллюстрации
Показать всеРеферат
Изобретение относится к биохимии, а именно к энзимологии. Цель изобретения - сокращение времени определения активности фосфолипазы С. Способ заключается п измерении активности фосфолипазы С, которое проводится по изменению интег рлльноп интенсивности сигнала фосфатидилхолина (Ф) с введенным ферментом в процессе рас щепления Ф до диацилглицерина и фогфп холина, определяемое при регистрации 31р-ямР спектров в течение часа после нача ла реакции. Расчет проводят по формуле Е ФХ -AS- 1000- 10/S-f Б- 32 -25 (мкМоль/мин/мг), где ФХ количество яе цитина (Ф), дающее сигнал на спектре, мкМоль; S - интегральная интенсивность исходного сигнала лецитина, в нормированных условных единицах; AS- изменение интегральной интенсивности сигнала за единицу времени, в нормированных условных единицах; t - время, за которое определяют изменение интегральной интенсивности сигнала, мин.Б - количество добавленного в образец фермента, мг, 1 /25 - коэффициент пересчета количества ФХ, мг, на неорганический фосфат (Рн) для ФХ с мол. мае. около 800, 1/32 -- коэффициент пересчета количества Рн, мМоль, в ФХ, а при 1000 - в мкМоль; 10 - поправочный коэффициент , полученный эмпирически. Способ позволяет измерять активность фермента в процессе непрерывной реакции. 3 ил, k/ с о со го со о VI
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (st)s 6э 01 N 24/08
ГОСУДАРСТВЕН-1ЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР :MON
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4463748/13 (22) 20.07.88 (46) 07.10.91; Бюл. ¹ 37 (71) Центральный научно-исследовательский институт гастроэнтерологии, Институт биохимии им. А.Н.Баха и Всесоюзный кардиологический научный центр АМН СССР (72) В.И,Решетняк, В.А.Еремин, С.Н.Дворянцев, А.С.Логинов, Э.К.Рууге и Г.Ф.Роэенблат (53) 557.15 (088.8) (56) Campbell!,D., Boyd I., Brindle К.M., Qxley
S.Т, NMR — methods for studying enzyme
kinetics. (Dept. Biochem, Univ. Oxford, Oxford, ОХ 1 3QU, GB), "22 nd Congr. Amplre .
Magn. Resonan. and Relat. Phenom. Proc..
Zurlcli, 1984". Zurich, 1984, р. 459 — 460.
Fernander Е.1., Clarke 0.S. MNR
spectroscopy: à noninvasive tool for studying
, In cellular process. Enzyme and Microb.
Techn0l„1987, ч. 9. ¹ 5, 259 — 271.
Florin — Chri ste n sen I., F la rln
Clrlstensen М, ес al. An acid phospholipase f, from tetrahymena culture medium. Comp.
Biochem. and Physlol., 1986. v. 85, t4 1, р.
143-148. (54) СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФОСФОЛИПАЗЫ С (57) Изобретение относится к биохимии, а именно к энзимологии. Цель изобретения— сокращение времени определения активноИзобретение относится к биохимии, а именно к энзимологии.
Цель изобретения — сокращение времени определения активности фосфолипазы
С.
„„„ Ж ÄÄ 1682897 А1 сти фосфолипазы С. Способ заключается я измерении активности фосфолипаэы С, которое проводится по изменению интегральной интенсивности сигнала фосфатидилхолина (Ф) с введенным ферментом в процессе расщепления Ф до диацилглицерина и фосфохолина, определяемое при регистрации
31р-ямр спектров в течение часа после начала реакции..Расчет проводят по формуле
Е=ФХ AS 1000 10/St Б 32 25 (мкМоль/мин/мг), где ФХ вЂ” количество лецитина (cD), дающее сигнал на спектре, мкМоль; S — интегральная интенсивность исходного сигнала лецитина, в нормированных условных единицах; A S — изменение интегральной интенсивности сигнала за единицу времени, в нормированных условных единицах; t — время, за которое определяют изменение интегральной интенсивности сигнала, мин; Б — количество добавленного в образец фермента, мг; 1/25 2 — коэффициент пересчета количества ФХ, мг, на неорганический фосфат(Рн) для ФХ с мол, мас. около 800; 1/32 — коэффициент пересчета количества Рн, мМоль, в.ФХ, а при
1000 — в мкМоль; 10 — поправочный коэффициент, полученный эмпирически. Способ позволяет измерять активность фермента в 00 процессе непрерывной реакции. 3 ил, Ч„) Способ заключается в том, что измерение активности фосфолипаэы C проводится по изменению интегральной интенсивности сигнала фосфатидилхолина (ФХ) с введенным ферментом в процессе расщепления
ФХдодиацилглицирина и фосфохолинд, оп н о о и-с-о-с-я
) о и-с-о-с -я
f н-с-о-и ( н.
I,2- оиаииргоииорин
О (сн,), и O=p-О-(СН ) -Н
О
Фосфонооин и о
f и н-с-о-с-д ,о н-с-о-с-р (I
I I-C-О-P-О-(Сно)о-Н-(СН,)о
Н О О
Лонинан
Фооаооипа за с
40
50 ределяемое при регистрации 31р-ящ> спектров в течение часа после начала реакции, Расчет проводят по формуле
ФХ AS 1000 10
Е 5 т Б 32 25=, мкМоль/MMH/ p где ФХ вЂ” количество лецитина (фосфатидилхолина), дающее сигнал на спектре;
S — интегральная интенсивность исходного сигнала лецитина, и нормированных условных единицах;
AS — изменение интегральной интенсивности сигнала эа единицу времени, в нормированных условных единицах;
t — время, за которое определяют изменение интегральной интенсивности сигнала, мин;
Б — количество добавленного в образец фермента, мг;
1/25 — коэффициент пересчета количества ФХ, мг на неорганический фосфат.(Рн) для ФХ с мол.мас. около 800;
1/32 — коэффициент пересчета количества Рн, мМоль, в ФХ, а при х1000, мкМоль;
10 — поправочный коэффициент, полученный на основе калибровки, Способ позволяет измерять активность фермента в процессе непрерывного протекания реакции.
Способ осуществляют следующим образом.
Озвученную суспенэию лецитина (не менее 100 мг) в 50 мМ Трис-H CI буфере (рН
7,4) помещают в ампулу для ЯМР-спектроскопии и регистрируют спектр 31р-ядр в течение времени, необходимого для накопления достаточного по интенсивности сигнала. При этом необходимо проводить измерение в режиме с как можно меньшим временем накопления сигнала (от 30 с до
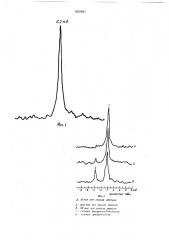
3 — 5 мин), На фиг. 1 приведен типичный спектр
31р-ялур озвученной суспензии ФХ в 50 мМ
Трис-HCI буфере(рН 7.,4). На спектре обнаруживается один сигнал с химическим сдвигом 0,2 м,д., соответствующий фосфатной . группе фосфатидилхолина, Добавление в суспензию лецитина (ФХ) ионов кальция (в конечной концентрации 10-20 мМ) — активатора фосфолипазы С не меняет форму и интегральную интенсивность сигнала.
Далее в ампулу добавляется фермент— фосфолипаэа C (не менее 1 мг), Образец быстро перемешивается и помещается в
ЯМР-спектрометр -для регистрации серии
31р--ямр спектров в течение 15 — 60 мин. В каждом из полученных 31р-ядр спектров определяется интегральная интенсивность сигнала фосфатидилхолина. Так как в процессе реакции от лецитина отщепляется фосфохолин, сигнал от фосфорной группы которого - (— ) 4 м.д„то на
31р-ямр спектрах в процессе реакции сигнал от фосфатидилхолина (лецитина) уменьша тся, а в области (— 4 м.д.) появляется и возрастает со временем сигнал от фосфохолина (фиг. 2), Интегральная интенсивность сигнала в спектрах 31р-ялур пропорциональна количеству ядер фосфора и соответствует определенному количеству лецитина в образце.
Кинетика уменьшения интегральной интенсивности сигнала ФХ, измеренная в процессе фосфолипазной реакции, отражает активность фермента фосфолипазы С, Чем больше скорость падения сигнала, тем активнее препарат фермента, Зная интегральную интенсивность сигнала, строят график зависимости ее от времени ферментативной реакции (фиг. 3) и определяют активность фермента по указанной формуле.
Способ апробирован с использованием препарата фосфолипаэы С иэ бактерий Candida
Weichii фирмы "Sigma" с активностью 5 ед/мг.
1 ед. высвобождает 1 мкМоль водорастворимого органического фосфора из Z — а -фосфатидилхолина в минуту при рН 7,3 и 370С.
Пример. Озвученную суспензию лецитина готовят следующим образом, 100 мг лецитина (Харьковского предприятия по производству бактерийных препаратов) из раствора в спирте переносят в специальную ампулу для озвучивания. Спирт удаляют под вакуумом, а к лецитиновой пленке добавляют 2 мл
50 мМ Трис-НС! буфера, рН 7,4. Озвучивание проводят на дезинтеграторе УЗДН вЂ” 1 (Харьковского завода) в течение 3 мин с паузами для охлаждения в режиме максимального резонанса при 0,3 мА. Далее образец центрируют при 2500 об/мин в течение 3 мин.
Супернатант используют для работы. 2 мл озвученного лецитина помещают в ампулу для ЯМР-спектроскопии. Добавляют 0,5 мл
Д20 и 50 мкл 1 M CaCI2. Регистрируют 31р-ямр спектр субстрата (фиг. 1). Спектры 31р-ядр. высокого разрешения образцов лецитина регистрируют на ЯМР-спектрометре с рабочей частотой 81 МГц при 37 С без вращения ампулы и беэ подавления спин-спинового взаимодействия ядер 31р с протонами. Спектры
1682897 получают с использованием 45Π— х импульсов и временем выборки 0,82 с с задержкой
1 с. Снижения уровня шумов достигают ум. ножением функции спада сигнала свобод- ной индукции на экспоненциальную функцию. Значение химических сдвигов 5 сигналов в спектрах в миллионных долях (м.д.) приведены относительно сигнала 85
НзР04.
В ампулу с лецитином добавляют 1 мг фермента — фосфолипазы С, быстро переме- 10 шивают и каждые 2,5 мин регистрируют спектры 31р-ямр в течение 60 мин в процессе расщепления фосфатидилхолина до диацилглицерина и фосфохолина. В исходном спектре и первом спектре после добавле- 15 ния фосфолипазы С интегральная интенсивность сигналов фосфатидилхолина одинаковая — 80,2 нормированных условных единиц, Строят график зависимости между интегральной интенсивностью сиг- 20 нала фосфатидилхолина и временем реакции (фиг. 3). Далее по графику определяют изменение интегральной интенсивности сигнала фосфатидилхолина с введенным ферментом за единицу времени, например 2 за 10 мин (фиг. 3) — 3,5 нормированных условных единицы, Исходная интегральная . интенсивность сигнала ФХ равна 80,2 нор- . мированных условных единицы и обусловлена она 80 мг лецитина. В 2,5 мл образца 3 (2 мл озвученного фосфатидилхолина+ 0,5 мл Д20) содержится 100 мг лецитина. Однако сканирование спектра происходит лишь с объема 2 мл, вокруг которого имеется магнитная катушка ЯМР-спектрометра,2 мл со- 3 держимого ампулы составляет 80 мг лецитина. Подставляют данные в формулу и получают
5 где ФХ вЂ” количество лецитина (фосфатидилхолина), дающее сигнал на спектре, мкМоль;
S — интегральная интенсивность исходного сигнала лецитина, в нормированных
0 условных единицах;
Л S — изменение интегральной интенсив:-лсти сигнала за единицу времени, в нормиро; анных условных единицах; т — время, за которое определяют изме5 нение интегральной интенсивности сигнала, мин;
Б — количество определяемого в образце фермента, мг;
1/25 — коэффициент пересчета количества ФХ, мг, на неорганический фосфат (Р ) для ФХ с мол.мас. около 800;
1/32 — коэффициент пересчета количества Р, мМоль, в фосфатидилхолине, а при х1000 — в мкМоль;
10 — поправочный коэффициент, полученный на основе калибровки.
80 х 3 5 х 1000 х 10
Из фиг. 3 видно, что для измерения активности фермента фосфолипазы Q необхо- 45 димо и достаточно получение 5-10
80,2 х 10х 1 х25х32
- 4,4 м к Мол ь Р и/мин/мг. экспериментальных точек в первые 15-20 мин проведения реакции. Способ позволяет быстро и достоверно определять активность фосфолипаэы С.
Формула изобретения
Способ определения активности фосфолипазы С, предусматривающий расщепление озвученного фосфатидилхолина до диацилглицерина и фосфохолина с последующим расчетом ее Ilo формуле, о т л и ч à ko щ и йс я тем, что, с целью сокращения времени определения, регистрируют 31р-яц спектр субстрата и серию спектров 31р-ядр с введенным ферментом в процессе расщепления фосфатидилхолина до диацилглицерина и фосфохолина, определяют интегральную интенсивность субстрата и изменение интегральной интенсивности с введенным ферментом за единицу времени, а активность фермента рассчитывают по формуле
ФХ ЛS 1000 10
MKMonb/ìèí/Mr, 1682897 — 8 -6 -4 -2 а 2 4 б ЮкУ.
)(ииииесвш айг
Фиг. Z
Д - 10иин. от начала реакции б - 22 У сии от начала реакции
I д — ой мин от начала реакции
1 - сигнал д осдыл иРилхо ина сигнал сросооохолина
1682897
ЮB5 ц75
0,И
Ж Я 6д 70
t(мои)
Составитель И.Чаплина
Редактор М.Стрельникова Техред M.Ìîðreíòàë Корректор О.Кравцова
Заказ 3408 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5
Производственно-издательский комбинат "Патент", r. Ужгород, ул.Гагарина. 101