Способ определения пестицидной интоксикации рыб
Иллюстрации
Показать всеРеферат
Изобретение относится к водной токсикологии и может быть использовано для диагностики интоксикации рыб. Целью изобретения является повышение точности определения. Рыб разделяют на опытную и контрольную партии. Опытную партию помещают в исследуемую среду. Затем отбирают пробы крови у рыб обеих партий, проводят отмывку эритроцитов в забуферной изотонической среде и гемолиз эритроцитов путем смешивания отмытых эритроцитов с буфером и последующим центрифугированием. Определяют концентрацию гемоглобина и выравнивают ее во всех пробах, далее устанавливают в н,их значение рН, равное физиологическому рН крови рыб. После обработки проб нитритом натрия ежесекундно регистрируют экстинкцию гемоглобина, а пестицидную интоксикацию у рыб устанавливают при отклонении времени полуокисления гемоглобина в опыте по сравнению с контролем более чем на 30%. 3 табл. (Л С
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (19) (1 I ) (я)ю G 01 N 33/18
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4628903/13 (22) 30.12.88 (46) 23.11.91. Бюл, N 43 (71) Азовский научно-исследовательский институт рыбного хозяйства (72) А.М.Левин, М.Л.Кесельман и В.Н.Прокофьев (53) 586(088.8) (56) Зигова И.Л. и др. Мембранотоксический эффект воздействия пестицидов на промысловую ихтиофауну. — Тезисы докл. к XXVII съезду Госхимкомиссии Итоги госиспытаний пестицидов, биопрепаратов и регуляторов роста растений в 1986 г. М., 1987, с. 229 и 230. (54) СПОСОБ ОПРЕДЕЛЕНИЯ ПЕСТИЦИДНОЙ ИНТОКСИКАЦИИ РЫБ (57) Изобретение относится к водной токсикологии и может быть использовано для диагностики интоксикации рыб. Целью
Изобретение относится к водной токсикологии и может быть использовано для диагностики интоксикации рыб при загрязнении рыбоводных водоемов пестицидами.
Цель изобретения — повышение точности определения.
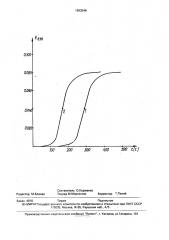
На чертеже изображена кинетическая кривая, поясняющая способ.
Способ осуществляют следующим образом.
Рыб разделяют на опытную и контрольную партии, опытную партию помещают в изобретения является повышение точности определения. Рыб разделяют на опытную и контрольную партии. Опытную партию помещают в исследуемую среду. Затем отбирают пробы крови у рыб обеих партий, проводят отмывку эритроцитов в забуферной изотонической среде и гемолиз эритроцитов путем смешивания отмытых эритроцитов с буфером и последующим центрифугированием. Оп ределяют кон центрацию гемоглобина и выравнивают ее во всех пробах, далее устанавливают в них значение рН, равное физиологическому рН крови рыб. После обработки проб нитритом натрия ежесекундно регистрируют экстинкцию гемоглобина, а пестицидную интоксикацию у рыб устанавливают при отклонении времени полуокисления гемоглобина в опыте по сравнению с контролем более чем на
30 . 3 табл. исследуемую среду, затем отбирают пробы крови у рыб обеих партий, проводят отмывку эритроцитов в забуферной изотонической среде и гемолиз эритроцитов путем смешивания отмытых эритроцитов с буфером и последующим центрифугированием, определяют концентрацию гемоглобина и выравнивают ее во всех пробах, далее устанавливают в них значение рН. равное физиологическому рН крови рыб, после обработки проб нитритом натрия ежесекундно регистрируют экстинкцию гемоглобина, а пестицидную интоксикацию у рыб устанавливают при отклонении времени полу1I693548
55 окисления гемоглобина в опыте по сравнению с контролем более чем на 30 .
Пример 1. Для эксперимента брали лещей 2-летнего возраста, выдержанных 45 сут в аэрированной водопроводной воде, Их помещали в емкости с водой, содержащей хлорорганический пестицид полихлор, пинен (ПХП) в концентрации 0,5 мг/л. В
, контроле рыбы содержались в аэрируемой, водопроводной воде без токсиканта. Эритроциты отмывали в 130 мМ раствора NaCI забуференным 20 мМ трис-буфером рН 7,4 и гемолизировали 10 мМ трис-буфером рН
7,4. Концентрацию гемоглобина выравнивали во всех гемолизатах, доводя Esm до
0,5001+. 0,010 путем разбавления гемолизата 10 мМ трис-буфером рН 7,4.
Для контроля выравнивания снимали спектры поглощения гемолизатов в диапазоне длин волн 500-600 нм на спектрофотометре. К 3 мл гемолизата в кювете спектрофотометра добавляли 50 мкл 35 мМ раствора нитрита натрия 10 мМ трис-HCI буфера рН 7,4. Кинетику реакции окисления
HbOz,нитритом натрия регистрировали при
А=630 нм. температуре 25 С, рН 7,4. Оптимальная концентрация нитрита натрия для гемоглобина леща составляла 10 мМ. Изменение экстинкции гемоглобина регистрировали в течение 500 с со скоростью 60 измерений в 1 мин. По кинетической кривой определяли время, за которое экстинкция гемоглобина достигала величины, равной половине максимальной, время полуокисления гемоглобина to,5 выражали в секундах.
Полученные данные приведены в табл.1.
Как видно из табл,1, воздействие ПХП на лещей в течение 24 ч достоверно снижает время полуокисления гемоглобина (то,5) на
42,8 (Р<0,02). При 48-часовой экспозиции
ПХП отмечается достоверное снижение to,5 <0,05).
Пример 2. Аналогично примеру 1 исследовали действие ГХЦГ (гексахлорциклогексана) на кинетику полуокисления гемоглобина леща нитритом натрия.
Концентрация ГХЦГ составляла 2 мг/л, Результаты исследования представлены в табл.2.
Как видно изтабл.2, под влиянием ГХЦГ достоверно снижается время полуокисления гемоглобина лещей на 36%. . Пример 3. Аналогично примеру 1 определяли кинетику окисления гемоглобина лещей нитритом натрия под воздействием растворенных в воде фосфорорганических пестицидов паратион-метила и базудина в концентрации 5 мг/л и 0,1 мг/л соответственно, 5
Результаты исследований представлены в табл.3.
Как видно из табл.3, воздействие на лещей паратион-метила в течение 24 ч, увеличивает tp,5на 107,9%, а через 48 ч — на 43,5%, базудина на 127,8 и 42.6% соответственно.
Полученные данные свидетельствуют о существенных нарушениях функционального состояния гемоглобина при пестицидной интоксикации.
Сравнение результатов регистрации кинетики полуокисления гемоглобина под воздействием хлор- и фосфорорганических пестицидов показыает, что хлорорганическая интоксикация сопровождается снижением времени полуокисления, а воздействие фосфорорганических — противоположным изменением функционального состояния гемоглобина.
Минимальное отклонение от контроля в приведенных примерах составляло 30,5%.
Таким образом, изменение кинетики полуокисления гемоглобина рыб более чем на
30% по сравнению с контролем свидетельствует о патологии и может быть принято за показатель пестицидной интоксикации рыб.
Предлагаемый способ позволяет улучшить качество исследований пестицидной интоксикации рыб за счет повышения точности и достоверности ее определения.
Формула изобретения
Способ определения пестицидной интоксикации рыб, предусматривающий разделение рыб иа опытную и контрольную партии, помещение опытной партии рыб в исследуемую среду, отбор проб крови у рыб обеих партий, отмывку и гемолиз эритроцитов, определение концентрации гемоглобина, обработку нитритом натрия, установление времени полуокисления гемоглобина путем регистрации динамики экстинкции раствора, сравнение опытных и контрольных данных и установление пестицидной интоксикации у рыб опытной партии в случае отклонения on ытных данных от контрольных, отличающийся тем, что, с целью повышения точности определения, отмывку эритроцитов проводят в забуференной изотонической среде, а гемолиз— путем смешивания отмытых эритроцитов с буфером с последующим центрифугированием, после определения концентрации гемоглобина осуществляют выравнивание экстинкции растворов и установление в них значения рН, равного физиологическому рН крови рыб, во всех пробах, после обработки нитритом натрия экстинкцию гемоглобина регистрируют эжесекундно, а пестицидную
16935 18 окисления гемоглобина в опыте по сравнению с контролем более чем на ЗО (.,интоксикацию у рыб опытной партии устанавливают при отклонении времени полуТабли ца 1
Показатели
Контроль
Время окисления с,при экспозиции
24 ч
48 ч
108,0
117,2
204,2
135,5
152,0
149,1
206 3
238,0
163,9*16,5
<0,02
-42,8
422,8
255,7
194,8
182,4
181, 5
255,4
322,1
478,2
286,4 39,8
x+s„
Процент
Табли ца2
Показатель
Время окисления с46 при. экспозиции
156 ч
Контроль
143
314
241
401
267+-43
Кинетика нитритного окисления гемоглобина х+я
P.
Процент та бл и ца 3
0рен лолтюкислемия,,с
Показатели
Па рагмнон-метил
Конт- 24 и 48 и Контроль роль
247,4
225,4
224,8
255.7
319,6
275 ° 0
332,0 (..
32 91
74 37
29 215
35 70
79
202
28
54
99,86!7,8
48,067,2 с0,02
+!07,В
404,5
548,8
845,7
227,1
334,5
277,1
466,3
450,3
554 9
463,6
291,0
Кинетика ннтритного окисления геноглобина
363+40.9
21,1 а0,05
+42,6
268! 16, 2
68 ° 9! 7, 4 с0 ° 05
+43,5
611,7+1 с0,01
127,8!
Пв
Процент
Кинетика нитритного окисления гемоглобина
- 105
43
33
88
39
27
28
81
92
193,9
-261, 6
221, 7
183,7
148,4
221,8
224,0
207, <+13,7
<0,05
-30,5
183
141
171
159
1 70+10 (0,05
-36
1693548 яо t(c) Составитель О.Корженко
Техред M.Ìîðråíòàë Корректор Т.Палий
Редактор М.Бланар
Производственно-издательский комбинат "Патент", r. Ужгород, ул,Гагарина, 101
Заказ 4076 Тираж Подписное
ВНИИПИ Государст венного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5