Электролит для электролиза воды
Иллюстрации
Показать всеРеферат
Изобретение относится к электрохимическим процессам, в частности к электролизу водных растворов с целью получения водорода и кислорода, и позволяет снизить энергозатраты. Электролит для элеткролиза воды содержит гидрокарбонат калия 3,0-3,1 г-экв/л, карбонат тетраэтиламмония 0,15- 0,20 г-экв/л, воду до 1 л. Предложенный электролит снижает энергозатраты за счет увеличения активности пористых титановых анодов. 4 табл.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (51)5 С 25 В 1/02
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ 3
«) о
«4 (21) 4795831/26 (22) 26.12.89 (46) 07.03.92. Бюл. М 9 (71) Курганский машиностроительный институт (72) А,Г. Рябухин, В.И. Прохорова и Г.B.
Иванцова (53) 621.357.1(088.8) (56) Авторское свидетельство СССР
N 1430410, кл, С 25 В 1/02, 08.12.86.
Изобретение относится к электрохимическим производствам, в частности к электролизу водных растворов с целью получения водорода и кислорода.
Известен электролит, содержащий 33,1 г-.экв/л гидрокарбоната калия и 0,150,20 r-экв/л карбоната тетраметиламмония (TMAK). Электролит используют для стационарного электролиза на пористых титановых электродах при габаритной плотности тока 500 А/м при 40 — 50 С в течение 50 сут непрерывной работы без обнаружения видимых следов разрушения анодов,: в частности пористого титана, покрытого смешанным оксидом.
Недостатком известного электролита является увеличение клеммного напряжвния на злектролизных ячейках и уменьиение электрохимической активности пористых титановых анодов при увеличении срока эксплуатации свыше 1500-2500 ч непрерывной работы.
»., Ж<1, 1717674 А1 (54) ЭЛ Е КТ РОЛ ИТ ДЛЯ ЭЛ Е КТ РОЛ И ЗА ВОДЫ (57) Изобретение относится к электрохимическим процессам, в частности к электролизу водных растворов с целью получения водорода и кислорода, и позволяет снизить энергозатраты. Электролит для элеткролиза воды содержит гидрокарбонат калия 3,0 — 3,1 г-экв/л, карбонат тетраэтиламмония 0,150,20 г-экв/л, воду до 1 л. Предложенный электролит снижает энергозатраты за счет увеличения активности пористых титановых анодов. 4 табл.
Целью изобретения является снижение энергозатрат при электролизе.
Цель достигается тем, что в электролит с содержанием 3,0 — 3,1 г-экв гидрокарбоната калия на 1 л водного раствора дополнительно вводят 0,15 — 0,20 г-экв/л карбоната тетраэтиламмо ния (ТЭАК}, Влияние добавки ТЭАК улучшает энергетику процесса разложения воды на пористых титановых электродах при длительных сроках эксплуатации злектролизных ячеек.
Кроме того, введение ТЭАК уменьшает коррозионное разрушение как самого титана, так и активного покрытия смешанными оксидами. Благодаря именно слабым поверхностно-активным свойствам четвертичных аминов и их солейуказанная добавка не вызывает дополнительного увеличения пассивного слоя диоксида титана на аноде.
Вввдение тетраэтиламмония в карбонатной форме исключает влияние посторонних анионов. Вто же время,,действие ТЭАК на организм не опасно. При работе с ним следует
1717674 соблюдать та же меры предосторожности, как и с другими карбонатными растворами.
ТЭАК приготавливают пропусканием углекислоты в раствор гидроксида тетраэтиламмония гидроксида до полного насыщения, после чего электролит готов к работе.
Концентрация ТЭАК определяется методом объемного кислотно-щелочного титрования в присутствии фенолфталеина и метилоранжа с осаждением карбонатов хлоридом бария (известен 10 и 20%-ный раствор гидроксида тетраэтиламмония}.
Для определения количественного соотношения ТЭАК и КНСОз проводят электрохимические исследования на образцах из монолитного титана площадью 2 мм в электролитах разного состава, г-экв/n, водный раствор КНСОз 3; TMAK 0,15 (известный состав 1), КН СОз 3: ТЭАК 0,1 (состав 2).
КН СОз 3; ТЭАК 0,15 (состав 3), КН СОз 3;
ТЭАК О, 20 (состав 4), КНСОз 3; ТЭАК 0,30 (состав 5), КНСОз 3„1: ТЭАК 0,12 (состав 6).
КН СОз 3,1; 0,20 (состав 7), ТЭАК 1 (состав 8).
Критерием выбора соотношения компонентов в предлагаемом электролите максимальная электрохимическая активность титана в исследуемых растворах.
Исследования проводят в электрохимической ячейке ЯСЭ-2 с помощью потенциостата П-5828 в интервале потенциалов
0,76 — 8,0 В при скорости развертки 2 В/мин.
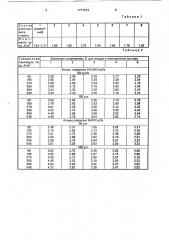
Запись потенциодинамических кривых проводят на двухкоординвтном самописце, С целью получения воспроизводимых данных на поверхности титана электрохимически формируется пленка диоксида титана при циклировании в течение 30 мин, В табл. 1 приведены значения плотности тока процесса выделения кислорода на электрохимически окисленной поверхности . титанового анода при потенциале 3,5 В в электролитах состава 1-8, описанного выше, Таким образом, максимальный ток выделения кислорода на окисленной поверхности монолитного титанового электрода наблюдается в электролите, содержащем
3.0-3,1 г-экв КНСОз+ 0,15 — 0,20 r-экв ТЭАК на 1 л водного раствора. В-этом случае плотность тока выделения кислорода на 5-11% больше, чем в прототипе.
Испытания проводят при злектрохимическом разложении воды на пористых титановых электродах. покрытых смешанными оксидами ЗгСбй!Со 06 и NdNICzOs перов. родов оценивают по данным поляризационных кривых, снятых с помощью потенци10
25 Коррозионные исследования прово30
50 скитной структуры при габаритной плотности тока 500 А/м в течение 100 сут непрерывной работы. На работающих ячейках периодически снимают вольт-амперную характеристики, позволяющие судить об энергетике процесса.
Электрохимическую активность электостата П-5828, в.гальванодинамическом режиме с автоматической регистрацией тока и потенциала, Для сравнения предлагаемого электролита с известным приводят усредненные по пяти образцам для каждого состава электролита вольт-амперные (табл. 2) и поляризационные (табл. 3) характеристики электролизных ячеек с описанными электродами по истечении 50 и 100 сут непрерывной работы.
Оценка влияния предлагаемого электролита и известного на коррозионную стойкость испытуемых электродов приведена в табл. 4. дят весовым методом, Весовой метод оценки коррозионной стойкости электродов заключается в определении относительного изменения веса электродов за время работы анодов. Относительное изменение веса (— 100, %) при одинаковом п
91 времени работы эквивалентно относительной скорости коррозии, Таким образом; электрохимические и коррозионные исследования подтверждают преимущество предлагаемого электролита по отношению к известному: снижение энергозатрат на 12-23% и сохранение активной поверхности работающих анодов в течение 2500 ч непрерывных испытаний, что достигается за счет введения в состав электролита ТЭАК в количестве 0,15-0,20 гэкв/л.
Формула изобретения
Электролит для электролиза воды, содержащий гидрокарбонат калия, карбонат тетраалкиламмония и воду, отл и ча юшийся тем, что, с целью снижения энергозатрат при электролизе, в качестве карбоната тетраалкиламмония электролит содержит карбонат тетраэтиламмония при следующем содержании компонентов: гидрокарбонат калия 3,0-3,1 г-экв; карбонат тетраэтиламмония 0,15-0,20 г-экв; вода до 1 л.
17 1.7674
Таблица 1
Таблица 2
Клеммное нап яжение, В, ля ано ов в элект олитах состава
Габаритная плотнос2ть тока, А/м
2 3 4 5
Аноды, покрытые ЯгСбй! Со206
50с ток
100с т
Анодырокрытые йбй!Со206
50 с т
100с т
540
540
540
540
2,36
2,66
2.89
3,08
3,24.
3,39
3.59
3,78
4,01
4,22
4,40
4,48
2,48
2,78
3,01
3,20
3.36
3,51
3,83
4,02
4,25
4,46
4,64
4,72
2,45
2,64
2,90
3,12
3,32
3,40
2,84
3,02 .
3,26
3,47 ..
3,68
3,76
2,31
2,50
2,76
2,98
3.18
3,26
2,70
2,88
3,12
3,33
3,54
3,62
2,10
2,29
2,54
2,76
3,00
3,09
2,65
2,83
3,06
3,26
3,48
3.54
1,96
2,13
2,38
2,60
2,84
2,93
2,49
2,67
2,90
3,10
3,32
3,38
2,17
2,38
2,63
2,85
3,06
3,15
2,70
2,89
3,12
3,35
3,52
3,62
2,02
2,23
2,48
2,70
2,91
3 00
2,55
2,74
2,97
3,20
3,37
3,47
2,33
2,54
2,78
3,03
3,24
3,34
2,78
2,98
3,22
3,45
3,64
3,74
2,21
2,42
2,66
2,91
3,22
322
2,66
2,86
3,10
3,33
3,52
3.62
1717674
Таблица 3
Потен иал ано а, 8, я злект олитов состава
2 3 4
Плотност ., тока. А/м
Аноды, покрытые SrCdNICozOs
50c
100 с т
Аноды, покрытые NdNICozOe
50 с т
100 ст
Таблица 4
133
222
278
333 .
444, 90 t33
222
278
333
444
133
222
278
333
444
133
22.2
278
333
444
1,170
1,180
1,220
1,260
1,300
1,330.
1,340
1.198
1,221
1,254
1.284
1,322
1,352
1,390
1,182
1,192
1,233
1,272
1,314
1,342
1,354
1,200
1,220
1,266
1,296
1,334
1,365
1,406
1,120
1.140
1,168
1,178
1,208
1,244
1,282
1,158
1,168
1,206
1,240
1,272
1,320
1 356
1,116
1,136
1,164
1,174
1;204
1,241
1,276
1,153
1,164
1,202
1,236
1,268
1,316
1,350
1,060
1,068
1,104
1,132
1,164
1,204
1,242
1,122
1,150
1,164
1.190
1,222
1,260
1,296
1,058
1,063
1,100
1,127
1,160
1,200
1 238
1,120
1,150
1,160
1,188
1,220
1,258
1,292
1,078
1,088
1,124
1,152
1,188
1,220
1,256
1,128
1,159
1,170
1,196
1,228
1.269
1,302
1.076
1,083
1,120
1,143
1,183
1,216
1 248
1,123
1,153
i,166
1,192
1,226
1,263
1,298
1,100
1,130
1,144
1,170
1,202
1,240
1,276
1,152
1,164
1,202
1,230
1,268
1,312
1 346
1,096
1,100
1,140
1,167
1,200
1,235
1 272
1,150
1,160.
i,197
1,228
1,264
1.309
1,344