Способ получения 4-хлор-3-сульфамоилбензойной кислоты
Иллюстрации
Показать всеРеферат
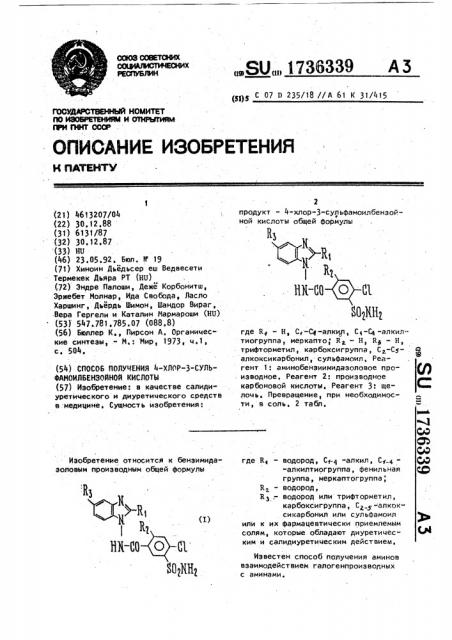
Изобретение: в качестве салидиуретического и диуретического средств в медицине, Сущность изобретения: продукт - 4-хлор-З-сульфамоилбензойной кислоты общей формулы Rl Н н ИК-СО где Я., - Н, С -С4-элки/1, С -С/ -алкилтиогруппа, меркапто; Кг - Н, RJ - Н, трифторметил, карбоксигруппа, алкоксикарбонил, сульфамоил. Реагент 1: аминобензиимидазоловое производное . Реагент 2: производное карбоновой кислоты. Реагент 3: щелочь . Превращение, при необходимости , в соль. 2 табл. (Л
ОПИСАНИЕ ИЗОБРЕТЕНИЯ (Т) С1
30фН, ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ll0 ИЭОБРЕТВНИЯМ И ОТНЯТИЯМ и И ГННТ CQCP
1 (21) 4613207/04 (22) 30, 12.88 (31) 6131/87 (32) 30,12,87 . (33) HU (46) 23.05.92, Бюл. Н 19 (71) Хиноин Дьедьсер еш Ведвесети
Термекек Дьяра РТ (HU) (72) Эндре Палоши, Деже Корбонитш, Эржебет Молнар, Ида Свобода, Ласло
Харшинг, Дьердь Шимон, Шандор Вираг, .
Вера Гергели и Каталин Мармароши (HU) (53} 547.781,785.07 (088.8) (56) Бюллер К,, Пирсон А. Органические синтезы, - М,: Мир, 1973, ч,1, с. 504, (54) СПОСОБ ПОЛУЧЕНИЯ 4-ХЛОР-3-СУЛЬфАМОИЛБЕНЭОВНОЙ КИСЛОТЫ (57) Изобретение: в качестве салидиуретического и диуретического средств
s медицине, Сущность изобретения:
Изобретение относится к бензимидазоловым производным общей формулы
„„SU„„1736339 А 3 (51)5 С 07 D 235/18 //А 61 К 31/415
2 продукт - 4 "хлор-3-сульфамоилбензойной кислоты общей формулы где 4 — Н, С -С -алкил, С -С -алкилтиогруппа, меркапто, R — Н, R> — H трифторметил, карбоксигруппа, С -Csалкоксикэрбонил, сульфамоил, Реагент 1: аминобензиимидазоловое про. изводное, Реагент 2; производное карбоновой кислоты, Реагент 3: ще- С лочь, Превращение, при необходимости, в соль, 2 табл, где, — водород, С -q --алкил, С -4"алкилтиогруппа, фенильная группа, меркаптогруппа, Rz - водород, R .- водород или трифторметил, карбоксигруппа, С -алкоксикарбонил или сульфамоил или к их фармацевтически приемлемым солям, которые обладают диуретическим и салидиуретическим действием, Известен способ получения аминов взаимодействием галогенпроизводных с аминами.
17
Оель изобретения — синтез новых бензимидаэолов с использованием известного способа получения аминов иэ аминов и галогенпроизводных, по своим свойствам превосходящих известные диуретики бензимидазольного типа.
Поставленная цель .достигается согласно способу получения соединений общей формулы (1), заключающемуся во взаимодействии 1-аминобензимидазолового производного общей формулы
k> N
1(Rl (и)
1 2 где К4 и Rg имеют вышеуказанные зна- чения, с производным карбоновой кислоты общей Формулы
СОХ,пц
U.1"м,s
Rq где R имеет вышеуказанное значение, Х - хлор;
К и Ry — водород или совместно образуют группу
-сни(сн,),; защитную группу удаляют в щелочной среде и целевой продукт выделяют в свободном виде или в виде соли, Пример 1, 105 мл сероуглерода добавляют в суспензию, которая содержит 100 r 2-амино-4-меток-! f сикарбонил-М-(4 -хлор-3 -сульфамоилбензоил)-фенилгидразина в 400 мл метанола, Затем по каплям в реакционную смесь при температуре ниже 20 С с перемешиванием и охлаждением холодной водой добавляют гиррат окиси калия, растворенный в 190 мл абсолютированного этанола. После завершения операции добавления смесь кипятят с обратным холодильником с перемешиванием в течение 2 ч, а затем прозрачный коричневый раствор оставляют стоять в течение ночи, На следующий день в раствор добавляют
145 мл уксусной кислоты и перемешивают в течение 1 ч, затем выпаривают до половины объема, Остаток выливают в 1500 мл воды с перемешива.нием, Бежевый осадок отфильтровывают
36339
35 с вакуумом, промывают водой и высушивают, Сырой продукт растворяют в кипящей смеси диметилформамида с водой в соотношении 1:1, горячий раствор осветляют активированным углем и профильтровывают в горячем состоянии. После охлаждения кристаллический бежевый осадок отфильтровывают с вакуумом, -flpgMblBBIQT водой и высушивают при 100 С под пониженным давлением, В результате получают 75 r (681-ный выход) 1-(4 -хлор-3 -сульфамоилбензоил)-амино-5-метоксикарбонилбензимидазол-2-тиона с т,пл.
242-245 С (c разложением).
После перекристаллизации из смеси диметилформамида с водой в соотношении 1:2 его температура плавления составляет 252-261 С (с разложением).
Вычислено, Ф: С 43, 59, Н 2,97;
N 12,71, С1 8,04; S 14,55.
Сi Н э ClNó Ops g.
Найдено, : С 43,80; Н 2,78;
N 12,57; Cl 8,62, S 14,60.
48,4- г сложного эфира, полученного по описанному способу, перемешивают совместно с 330 мл 2 н. расто вора гидрата окиси натрия при 50 С в течение 4 ч, Прозрачный желтый раствор охлаждают и подкисляют до величины рН 3-4 робавлением 2 н, соляной кислоты, Осадок отфильтроBblBBIoT с вакуумом, ройывают водой и высушивают при КО С. Полученный сырой продукт перекристаллизовывают иэ смеси диметилформамида с водок в соотношении 1:1 с осветлением раствора активированным углем, Таким образом, получают 1-(4 -хлор-3 -сульфаf моил бензоил) -а ми но-5-кар боксибензимидазол-2-тион, содержащий 1 молекулу диметилформамида, в вире снежно-белых очень мелких кристаллов, Продукт содержащий риметилформамид, кипятят с 430 мл дистиллированной воды в течение 30 мин, После охлаждения с вакуумом отфильтровывают белые кристаллы, которые промывают
50 водои и высушивают при 80 С под пониженным давлением, В результате в виде снежно"белых кристаллов получают, 37,4 г (выход 76,63) 1-(4-хлор-3—
-сульфамоилбенэоил)-амино-5-карбоксибензамидазол-2-тМонионогиррата с т,пл, 55 320-322 оС
Вычислено,
И 12,59, С1 7,97; S 14,41, С4 Н„„CXS< Н О
Вычислено, Ф: С 42,,01, Н 3,05, N 13,07;. С1. 8,27, . S 7,48.
Cqy H a3 С1Иц О 18
Найдено,. 4: С 41,71,Н 3,38;
N 13,06, Cl 8,01 Б 7,86, С) 10 г никеля Ренея в качестве катализатора добавляют в раствор, ко торый содержит 60 r нитросоединения, 5 173633
Найдено, ь : С 40,22; Н. 2,80, N 12,20; Cl 7,70, S 14,65.
Получение исходного продукта.
А) 80 мл гидразингидрата выливают в суспензию 172,5 г метил-4-хлор-3-нитробензоата .в 1600 мл абсолютированного спирта с перемешиванием. Затем реакционную смесь подвергают кипячению с обратным холодильником с перемешиванием в течение 45 мин, Исходный материал растворяют, и началось выпадение в осадок прорукта.
После охлаждения продукт отфильтровывают с вакуумом и подвергают последовательной промывке абсолютированным этанолом и ворой до полного освобождения от ионов хлора, Таким образом, в вире желтых кристаллов получают 143,6 г (853-ный выход) 4-метоксикарбонил-2-нитрофенилгидразина с т,пл. 169-171 С.
Вычислено, Ф: С 45,49, Н 4,29, N 19189.
Cg Hs N og
Найдено, б: С 45,58, H 4,31;
N 20,33.
В) 127 г 4-хлор-3-.сульфамоилбензоилхлорида, растворенного в 500 мл диоксана, добавляют в суспензию
105 г фенилгидразинового производного, полученного по методике А, в 1 л диоксана с перемешиванием. Затем в смесь добавляют 26,5 r безводного кар-. боната натрия, и эту смесь перемешивают при кипячении с обратным холодиль- 35 ником на бане с горячей водой в течение 5 ч, После охлаждения смесь профильтровывают и фильтрат выпаривают под пониженным равлением с получением в вире остатка смолоподобной массы, которую перемешивают. совместно с
1500 мл воры до тех пор, пока она не превратилась в. порошок, после чего этот послерний отфильтровывают с вакуумом, промывают ворой и высушива- 45 ют при 80 С. Получают в виде желтого порошка 203 г (выход 94,7Ж) 4-метокЭ
) сикарбонил-2-нитро-N-(4 -хлор-3-сул ьфамоил бензоил) -фенил гидразина с т,пл. 144-147 С. 50
6 полученного в соответствии с методикой В, в 500 мл метоксиэтанола (этиленгликольмонометиловый эфир), температуру которого поддерживают на о уровне 70 С, Затем смесь подвергают гиррогенизации при 70 С под давлениФ ем 10 атм в машине для встряхивания, После прекращения поглощения водорода реакционную смесь охлаждают и с отфильтровывают катализатор. Фил ьтрат выпаривают под пониженным давлением и остаточную смолоподобную массу перемешивают в 500 мл воды до ее разрушения и превращения в фильтруемый порошок. Продукт отфильтровывают с вакуумом, промывают водой и высушивают при 80 С. B результате полуо чают 52 г (911-ный выход) 2-амино-41
-метоксикарбонил"N-(4 -хлор-3 "сульфамоилбензоил) -фенилгидразина в виде бежевого порошка .с т,пл. 214-215 С
0 (с разложением), Вычислено, Ж: С 45,17; Н 3,79;
N 14,05, С1 8,89; S 8,04, Cgg Н 5 С1.NqOs S
Найдено, 3: С 45,72 H 3,17;
N 13,75, С1 9,29, S 7;94.
Пример 2, 42 мл сероуглерода выливают в суспензию 38,5 г 2-ами" но-4-карбокси-N-(4 -хлор-3 -сульфамоилбензоил)-фенилгидразина в 160 мл метанола, а затем по каплям в указанную смесь при перемешивании добавляют 20,72 г гидрата окиси калия, растворенного в 105 мл абсолютированного этанола. Приготовленный ра" створ кипятят в течение l ч, затем охлаждают и величину рН доводят до
4-5 добавлением 2 н, соляной кислоты, Осадок отФильтровывают с вакуумом, u: промывают водой и высушивают при о0 С, В результате получают 31,8. г (754-ный
I выход) 1-(4 -хлор-3 -сульфамоилбензоил)-амино-5-карбоксибензимидазол-2-тиона в вире бежевого порошка с т,пл. 290-295 С (с разложением), ПосО ле очистки по примеру 1 продукт идентичен продукту по примеру 1, Получение исходного продукта, А) 25,7 г, 4-метоксикарбонил-2-нитро-N-(4 -хлор-3 -сульфамоилбенI I. зоил)-фенилгирразина перемешивают с
120 мл 2 н, раствором гидрата окиси натрия при 50 С в течение 4 ч. Пос9 ле охлаждения величину рН темно-фиолетового раствора доводят до 5 добавлением 2 н. соляной кислоты. Желтый осадок отфильтровывают с вакуумом, Вычислено, Ж: С 43,70, Н 3,40;
14 >561 С1 9>21; s 8 >33 °
Сц >уз С1И40УS
Найдено, +. с 43,83, Н 3,40, н 14,21; с1 8,94; s 8,10.
П р и м е.р 3, Смесь, содержаЧУю " r 2-амина-4-метоксикарбонил> >
-N-(4 -хлор-3 -сульфамоилбензоил)-фенилгидразина и 3,2 r этилксантата калия в 30 мл пиридина кипятят с обратным холодильником в тецение 30 мин, после чего пиридин выпаривают под пониженным давлением, После растворения остатка в 40 мл ледяной уксусной кислоты раствор выливают в
160 мл воды, Осадок отфильтровывают с .вакуумом, промывают водой и высушивают при 80 С. В результате в виде ф розового порошка получают 8,2 r
7 1 промывают водой и высушивают при 80 С, получив в виде желтого порошка 23 г (выход 92,)3) 4-карбокси-2-нитро-N-(4-хлор-3 -сульфамоилбензоил) -фенилгидр, зина с т.пл. 273"275 С.
Вычислено, 1: с 40,53; Н 2,67;
N 13,50, с1 8,50, 8 7,.70
С >4 Н Р С1И4 ОУ Я
Найдено, ь: С 40,23, Н 2,88;
N 13,76; с1 8,54; s 7,66, В) 4 г 10 ь-ного палладия на угле в качестве катализатора добавляют в суспензию 41,4 r нитросоединения, полученного по методике А примера 2, в 500 мл 963-ного этанола. Затем реакционную смесь нагревают .с перемешиванием до 60 - 70 С и по каплям
150 мл 30 -ного водного раствора гипофосфата натрия добавляют с такой скоростью, которая позволяет, избегать интенсивного пенообразования. После охлаждения смесь профильтровывают и фильтровальный пирог перемешивают с
70 мл 2 н, раствора гидрата окиси нат рия. Отфильтровывают катализатор и велицину рН фильтрата доводят до 5 добавлением 2н, соляной кислоты. . Осадок отфильтровывают с вакуумом, У промывают водой и высушивают при 80 С
В. результате получают 32 г (834-ный
> выход) 2-амино-4-карбокси-N-(4 -хлор-!
"3 -сульфамоилбензоил) -фенилгидразина с т.пл, 240-244 С (с, разложео нием), После перекристаллизации из смеси диметилформамида с водой в соотношении 1:2 температура плавления этого продукта составляет 245-246 С (с
0 разложением), 736339
8 (944-ный выход) l-(4 -хлор-3 -сульфамоилбензоил) -амино-5-метоксикарбонилбензимидазол-2-тиона с т.пл.
258-261"С (с разложением) после его предварительной перекристаллизации из смеси диметилформамида с водой в соотношении l:2, Пример 4. 0 85 мл тиофосгена по каплям добавляют в раствор, который содержит 4 г 2-амино-4-метоксикарбонил-N-(4 -хлор-3 -сульфа 1 > моилбензоил)-фенилгидразина в 22 мл
1 н, раствора. гидрата окиси натрия, с одновременным перемешиванием и охлаждением водой . Смесь перемешивают при комнатной температуре в течение 4 ч, после чего ее кипятят, с обратным холодильником в тецение
20 30 мин. После охлаждения велицину рН смеси доводят до 7 добавлением нор. мального раствора бикарбоната натрия, перемешивают в течение 30 мин, затем величину рН доводят до 5 добавлением уксусной кислоты. Осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80 С, получив в виде бежевого порошка
4,35 г (выход — 98,5Ф) 1 (4 -хпор-3 -сульфамоилбензоил)"амина-5-метоксикарбонилбензимидазол-2-тиона .с т.пл, 258-261 С (с разложением) пос-. ь ле предварительной перекристаллизации из смеси диметилформамида с водой в соотношении 1:2, 35 1
Пример 5. 2,54 г 4-хлор-3-сульфамоилбензоилхпорида добавляют при перемешивании в виде небольших порций B. раствор 2,2 г 1-амино-5-ме40 токсикарбонилбензимидазол-2-тиона в 8 мл диметилформамила и 1,4 три" этиламина. Реакционную смесь оставляют стоять на ноць, затем величину рН доводят до 5 добавлением уксус© ной кислоты и разбавляют смесь 100 мл воды. Выделившийся смолоподобный про.дукт разрушается до порошкообразного состояния, который отфильтровывают с вакуумом, промывают водой и вью
g0 сушивают при 80 С, Полученный сырой продукт кипятят с 10 мл ледяной уксусной кислоты в течение 30 мин, а затем выливают в 50. мл воды. Выделившаяся смолоподобная масса при перемешивании разрушается с образованием . порошка, Осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80 С. В результате s виде
0 бежевого порошка получают 2,4 г (выВычислено, Ж: С 48,00, 1! 3;61, N16,,72,, S 12,76, С10 Б9 13ОЗ .
Найдено, 4: С 48,70,.Н 3,50
N 16,70; S 12,74, Е) 25,1 г бензимидазолового производного, полученного по методике
Dпримера 5,,кипятят со 100 мл 2 н, соляной кислоты при перемешивании в течение 6 ч, После охлаждения кристаллы отфильтровывают с. вакуумом, о промывают водой и сушат при 80 С, Получают в виде бежевого твердого кристаллического продукта 20,5 r (выход 983) 1-амино-5-карбоксибенз173633 ход 54,5Ж) 1-(4 -хлор-3 -сульфамоипбензоил)-амино-5-метоксикарбонил бензимидазол-2-тиона с т.пл, 258261 С (с разложением) после предва5 рительной перекристаллизации из смеси диметилформамида с водой в соотношении 1:2, Получение исходного продукта.
А) После кипячения 105,6 r 4-меток- 10 сикарбонил-2-нитрофенилгидразина с
1 л ледяной уксусной кислоты в те- чение 1 ч прозрачный оранжево-красный раствор выпаривают под пониженным давлением. Остаток перемешивают в
1500 мл воды, кристаллический. осадок отфильтровывают с вакуумом промывают водой и высушивают. при 80 С. Получают в виде желтых порошкообразных кристаллов 123 г (выход 97 ) 4-метоксикарбонил-2-нитро-N -ацетилфенилгидразина с т.пл, 182-185 С, а после о перекристаллизации из водного раствора о этанола его т,пл, 190-1.92 С, Вычислено, : С 47,43, Н 4,38;
N 16,59.
С„1,„N,О, Найдено, i: C 47,55; Н 4,73;
N 16,58.
В) 107,7 г производного бензойной кислоты, полученного по методике A примера 5, кипятят с обратным холодильником в 425 мл 1 н, раствора гидрата окиси натрия в течение 10 мин, а затем раствор фильтруют, получив прозрачный темно-красный раствор, ко- 35 торый подкисляют до величины РН 3»5 добавлением уксусной кислоты. Крис- . таллический осадок отфильтровывают с вакуумом, пРомывают водой и высушивают при 80 С. Получают 98 r (выход
96,4ь) 4-карбокси-2-нитро-N-ацетилфенилгидразина в виде желтого твердого кристаллического вещества с т,пл, 262-263 С, После перекристало лиэации из 504-ного водного раствора 45 этанола температуру. плавления повышают, до 272-274 С (с разложением)„
С) Раств6р 116,3 г нитросоедине ния, полученного по методике В примера 5, в 490 мл нормального раствора бикарбоната натрия фильтруют. Получают прозрачный раствор, который подвергают гидрогенизации в присутствии 10 r 104-ного палладия на угле в качестве катализатора до прекращения поглощения водорода. После отфильтровывания катализатора фильтрат подкисляют до величины РН 4 добавлением
5 н, соляной кислоты, Кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают о при 80 С, Получают в виде бежевого твердого кристаллического продукта
80,9 г (выход 79,6ь) 2-амино-4-карбокси-N-ацетилфенилгидразина с т.пл. о
145-150 С (с разложением) . После перекристаллизации из абсолютированного этанола температуру плавления о удалос ь повысит ь до 156-158 С (с разложением), Вычислено, 3: С 51,67, Н 5,30;
N 20,09.
С9 1111ЫЗОЗ
Найдено, Ф: С. 51,3.1; Н 5,49;
N 19,79, D) 62,75 г аминового соединения, полученного по методике С примера 5, растворяют в растворе 36 r гидрата окиси калия в 450 мл абсолютированного этанола, а затем добавляют
20,5 мл сероуглерода и смесь кипятят с обратным холодильником при перемешивании в течение 5 ч. В осадок выпадает желтый твердый кристаллический материал. В смесь добавляют
250 мл горячей воды, полученный раствор осветляют активированным углем, фильтруют и из фильтрата под пониженным давпением отгоняют около ?00 мл этанола. К оставшейся части раствора добавляют 65 мл уксусной кислоты, отфильтровывают с ваку-. умом желтый кристаллический осадок, промывают его водой и высушивают при
9 С
80 С, Получают в виде белого кристаллического твердого вещества 46 r (выход 61/) 1-ацетипамино-5-карбоксибензимидазол-2-тиона с т,пл, 334338 С после предварительной перекристаллизации из 504-ного водного раствора этанола, 17363
301 имидазол-2-тиона с т. пл, 304 С (с разложением), Вычислено, : С 45,92, Н 3,37;
N 20,0Р; S 15,30.
C>V NyS.
Найдено, 3: С 45,40; Н 3,34;
N 19,92; S 15,70, F) Суспензию, содержащую 20,5 г карбоновой кислоты, полученной по ме- 10 тодике Е примера 5, в 250 мл мета» иола насыщают газообразным хлористым водородом, а затем кипятят с обратным холодильником при перемешивании в течение 30 мин, постепенно 15 вводят газообразный хлористый водород. После охлаждения кристаллы отфильтровывают с вакуумом и добавляют во влажном состоянии к с0 мл нормального раствора бикарбоната 20 натрия при интенсивном.перемешивании. После перемешивания в течение
30 мин кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 80 С. Таким 25 образом,. e виде кристаллов костяной окраски получают 19,9 r (выход 914)
1-амино-5-метоксикарбонилбенэимидазол-2-тиона с т.пл. 239 С (с разложением) после предварительной 0 перекристаллизации из смеси диметилформамида- с водой в соотношении
2:1.,:
Вычислено, 4: С 48,42, Н 4,06; и 18,82 S 14,36, СдНзй,О,З
Найдено, 4: С 48,16; Н 3,94;
N 18,50; S 14,61.
Пример 6, 12,7 r безводного карбоната натрия, растворенного в . 4g
200 мл воды, добавляют в суспензию
44,6 r 1-амино-5-метоксикарбонилбензимидазол-2-тиона в 400 мл диоксана, затем по каплям в укаэанную смесь при перемешивании и охлаждении водой о до 15-20 С добавляют раствор, который содержит 68 г 4-хлор-3-(N-диметиламинометилиден) -сульфамоилбензоилхлорида; в 400 мл диоксана. После завершения добавления реакционную смесь переме- я1 шивают при 20 С в течение 2 ч, а зао тем ее фильтруют с получением прозрачного раствора, Фильтрат разбавляют 2 л воды, кристаллический осадок отфильтровывают с вакуумом, промывают водой и сушат при 80 С . 84,5 r полученного сырого продукта растворяют в горячем виде 1 л воды при интенсивном перемешивании, После охлаждения
3912 кристаллический осадок отфильтровывают с вакуумом, промывают водой и су шат при 80 С, Получают в виде белого порошка 74,4 г (выход 75,5Ф) 1- 4
-хлор-3 -(М-диметиламинометилиден)-сульфамоилбензоил)-амино-4-метоксикарбонилбензимидаэол-2-тиона с т,пл.
238-239 С (с разложением).
Вычислено, 3: С 45,92, Н .3,85, N 14,10; Cl 7,13, S 12,90, Сщ Н а C1NgOgs
Найдено 3 С 45 45 H 3,59; .N 13,95; Cl 7,10, .S 13,16, 86,8 г соединения, полученного по вышеизложенному, перемешивают в
500 мл 2 н. раствора гидрата окиси о натрия при 50 С в течение 8 ч, а затем раствор осветляют активированным углем, профильтровывают и величину рН фильтрата добавляют до 6 добавлением 2 н„ соляной кислоты с одновременным охлаждением и интенсивным перемешиванием, После добавления
100 мл зтанола выпавший осадок отфильтровывают с вакуумом, промывают водой и сушат при температуре
80 С с получением bU,È r (выход
81,4Ф) 1-(4 -хлор-3 -сульфамоилбензоил)-амино-5-карбоксибенэимидазол.-2-тиона с т.пл. 285-290 С (с разложением). После очистки, аналогично методике примера 1 оба вещества оказываются совершенно идентичными.
Пример 7, После добавления
3,66 r N,N-ди-(метоксикарбонил)-метилиэомочевины в раствор 2,06 г 2-амино-4-метоксикарбонил-(4 -хлор-3
I У
-сульфамоилбенэоил)-фенилгидразина в
1О мл диметилформамида полученный раствор кипятят в течение 3 ч, а затем выпаривают под пониженным давлением, Остаток растворяют в 10.мл теплой ледяной уксусной кислоты, осветляют активированным углем, фильтруют и фильтрат выливают в 100 мл воды, Выделившиеся кристаллы отфильтровывают с вакуумом, промывают водой и высушивают при 80 С, В результате получают 3.,7 г (выход
87ь) 1-(4 -хлор-3 -сульфамоилбензоил) -амино-5-метоксикарбонилбензимидазолона с т,пл. 210-216 С (с разлоо жением), 3,7 г бензимидазолового производного, полученного по вышеизложенному, перемешивают в 37 мл 2 н, раствора гидрата окиси натрия при 60 С о в течение 5 ч, Затем смесь освет36339Пример 10. 6,6 г 1-(4 -хлорf
-3 -сульфамоилбенэоил) -амино-5-метоксикарбонилбензимидазол-2-тиона
5 растворяют в растворе, приготовленном из 0,35 г металлического натрия и
60 мл метанола. После добавления
2 мл хлористого бензоила реакционную смесь подвергают кипячению с обратным холодильником в течение 16 ч, а затем выпаривают под пониженным дав лением, Остаток растирают в воде, твердый продукт отфильтровывают и подвергают после сушки хромэтографической обработке в колонке, В качестве сорбента используют силикагел ь, а в качестве элюента - смесь бенэола с ацетоном в соотношении 2:1, Таким образом, в виде белого порошкообразно2О ro твердого продукта получают 5,37 r (выход 67,8/) 2-бенэилтио-1-(4 -хлор-3 -сульфамоилбензоил)-амино-5-метоксикарбонилбензимидазола с т,пл. » 1» 8 С (с разложением), Величина этого продукта равна 0,90, ее определя" ют тонкослойной хроматографией (TCX) с использованием для проявления системы хлороформ-уксусная кислота-метанол, Вычислено, Ф: С 52,02 Н 3,61, N 10,55, Сl 6,68; S 12,08 °
СОН19 C1N)О S<
Найдено, io: С 52,32 Н 4,00;
- N 9,90; Cl 6,00, "S 12,00, Пример », Суспензию, кото35 рая содержит 5,3 г 2-бензилтио-1I
-(4 -хлор-3 -сульфамоилбензоил) -амино-5-метоксикарбонилбензимидаэола в
30 мл 2 н, раствора гидрата окиси натрия, перемешивают в течение 4 ч при
4О 50 С, Тем временем растворяется большая часть исходного вещества.
После отфильтровывания нерастворимой части фильтрат нейтрализуют добавлением 30 мл 2 н. соляной кис4 лоты, Белый осадок отфильтровывают с вакуумом, промывают водой и высушивают с получением 4,9 r (выход 94,84)
2-бензилтио-1- (4 -хлор-3 -сульфамоил)-амино-5-карбоксибензимидаэола с 0 т,пл, 190-196 С (с разложением) °
13
17 ляют активированным углем, профильтро вывают и фильтрат подкисляют 2 н. соляной кислотой, Кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушивают при 60 С, Таким образом, в виде бежевого твердого кристаллического продукта получают 2,6 г (выход 723) 1-(4 -хлорг
-3 -сульфамоилбензоил) -амино-5-карбоксибензимидазолона с температурой плавления после перекристаллизации из 504-ного водного раствора этанола 339 С, Вычислено, Ф: С 43,85, H 2 70;
N 13,64, S 7,80.
С 45 H A C1Ng 0 < S
Найдено, Ф: С 43 57, H 2,86; и 13,58; Я 7,42.
Пример 8. » г 1-(4 -хлорt
-3 -сульфамоилбензоил)-амино-5-метоксикарбонилбензимидазол-2-тиона растворяют в растворе, который приготовляют из 0,58 г металлического натрия и 10 мл метанола. После добавления
1,56 мл иодистого метила раствор кипятят с обратным холодильником в течение 3 ч, затем метанол выпаривают и остаток растирают в воде. Порошкообразные кристаллы отфильтровывают с вакуумом, промывают водой и высушивают при 80 С, В результате получают 10,8 г (выход 954) 1-(4 -хлор-3 -сульфамоилбензоил)-амино-5-метоксикарбонил-2-метилтиобензимидазола с т,пл. 186-188 С (с разложением), Вычислено, Ф: С 44,88, Н 3,32, N 12,32; Cl 7,79; $14,10, С47 Н у CIN405S2.
Найдено, Ф: С 44,75, Н 3,68;
N 12,50, "Cl 7,60 S 13,91.
Пример 9, 10 r сложного эфира, полученного пб методике примера
8, гидролизуют с использованием 50 мл
2 н, раствора гидрата окиси натрия аналогично примеру 1. Таким образом, получают 9 г (выход 943) 1-(4 -хлор l
-3 -сульфамоилбензоил)-амино"6- карбокси-2-метилтиобензимидазола, кото= рый перекристаллизовывают иэ. 50Ф нрпо водного раствора этанола, В результате получают вещество с 1,5 молеку- . лы кристаллогидратной влаги и т,пл, 214-222 С (с разложением).
Вычислено, Ф: С 41,06; Н 3,44;
N 11,97; Cl 7,57; S 13,07.
С@нуэ C1NpOpS 1,5HzO
Найдено, i: С 41,00; Н 3,35;
N»,71 Cl 7,»; S 13,15,.
Вычислено, ь: С 51,10, Н 3,31, N 10,84; Сl 6,86; S 12,40, CggHqg C1N40gSz
Найдено, 3: С 49,23; H 3,77; N»,00," С1 6,84, З 11,40, Пример 12, 3,85 мл 35ь-ного раствора перекиси водорода по каплям при 20 С добавляют в суспензию о
15 173633
9 г (4 -хлор-3 -сульфамоилбензоил)-амино-2-метилтио-5-метоксикарбонилбензимидазола в 20 мл ледяной уксусной кислоты. Затем реакционную смесь перемешивают в горячей воде в течение 90 мин, После охлаждения твердый продукт отфильтровывают с вакуумом, промывают водой и высушивают. Получают в виде белого nnpowxa 6,4 r (выI у l0 ход 65,74) 1-(4 -хлор-3 -сульфамоилбенэоил)-амино-5-метоксикарбонил-2-метилсульфонилбенэимидазола с т.пл.
254-255 С (с разложением) после перекристаллиэации иэ смеси циметилформамида с водой в соотношении 1:1.
Вычислено, 4: С 41,93; H 3i10;
N 11,50; Сl 7,28; S 13,17, С<> Н„С1Н404$
Найдено, Ф: С 42,01; Н 3,15; и 11,34; сl 7,35, s 13,01.
П р и и е р 13. Суспензию, соФ 1 держащую 5,4 г 1-(4 -хлор-3 -сульфамоилбензоил) -амино-5-метокси карбонил-2-метилсульфонилбенэимидазола в
25>
30 мл 2 н. раствора гидрата окиси о натрия перемешивают при 50 С в течение 4 ч, В результате получают прозрачный фиолетовый раст вор, который ос ветляют а кти вированным углем, фильтруют и фильтрат подкисляют до величины рН 2 добавлением 2 н, соляной кислоты, Белый осадок отфильтровывают с вакуумом, промывают ,водой и высушивают, Получают в виде. белого порошкообразного твердого продукта 4 43 r (выход 85,74) 5-карбокси-1-(4 -хлор-3 -сульфамоилбензо)
f ил) -амино-2-метилсульфонилбензимидазола с т,пл. 222-225 С (с разложением), которая не изменяется после 4О . перекристаллизации из смеси диметилформамида с водой в соотношении 3:2.
Вычислено, 3: С 40,64, Н 2,77;
N 11 .85; С1 7,50; $ 13,56, С gg Н гъС1И О Sz, Найдено, 4: С 40,07; Н 3,01;
N 12,02; Cl 7,65; $13,29.
Пример 14, 17,25 г 4-хлор-3-(N-диметиламинометилиден) -сульфа- р моилбензоилхлорида добавляют в суспензию 11,45 г 1-амино-5-метоксикарбонил-2-метилбензимидазола в 25 мл пиридина. Затем реакционную смесь нагревают до 60-70 С с получением о
55 желтого раствора. Густую желтую смесь оставляют стоять на ночь, затем добавляют 200 мл воды, Выделившаяся желтая смолоподобная масса разрушает9 16 ся с образованием Гежевого порошка после перемешивания в течение нескольких минут, Пролукт отфильтровывают с вакуумом, промывают водой и высушивают с получением 23,9 г (выход
904) 1-Q4 -snop-3 -(N-диметиламинометилиден) -сульфамоилбенэоил -амино-5-метоксикарбонил-2-метилбенэимидаэола с т ° пл. 240-245 С (с разложением).
После перекристаллизации из нитрометана температура плавления продукта 260-263 С (с разложением), Вычислено, 3: С 50,26; Н 4,22;
N 14,65; Cl 7,42) S 6,71, Cgy11 yC1Ny0gS
Найдено, Ф: С 49,85; Н 4,31;
N 15,12, Cl 7,44; S 6,52, Получение исходных продуктов, А) 235 мл уксусного ангидрида добавляют в суспензию 97,5 г 2-амино-4-карбокси-N-ацетилфенилгидразина в
450 мл дихлорметана с одновременным перемешиванием. Эту смесь перемешивают при комнатной температуре в течение 3 ч, затем кристаллы отфильтровывают с вакуумом, промывают дихлорметаном и высушивают при 60 С..
Таким образом, получают 101,2 r (вы- . ход Рб 51) 2-ацетиламино-4-карбокси-N-ацетилфенилгидразина с т, пл.
238 С (с разложением).
Вычислено, Ф: С 52,58; Н 5,21;
N 16,93.
С,„Н„И,0
Найдено, Ф: С 52,82; Н 5,12, N 17,20.
В) 101,2 r ацетилового производного, полученного по примеру 14А, кипятят в 800 мл уксусной кислоты в течение 13 ч, а затем выпаривают под пониженным давлением, После перемешивания остатка в 800 мл воды кристаллический осадок отфильтровывают с вакуумом, промывают водой и высушио вают при 80 C Получают в виде белого порошкообразного твердого продукта 73,13 (выход 78,53) 1-ацетиламино-5"карбокси-2-метилбензимидазола с т,пл, 293-294 С (с разложением), . Вычислено, Ф: С 56,65; Н 4,75;
N 18,02, С«Нй "З0 з
Найдено, 4: С 56,71; Н 4,62;
N 17,89, С) 73,1 г бенэимидазолового производного, полученного по методике В примера 14, кипятят в 310 мл 2 н. соляной кислоты в течение 5 и. Полу17 1 ченный таким образом прозрачный раст вор осветляют активированным углем и фильтруют, После охлаждения кристаллический осадок фильтруют с ваку» умом, промывают небольшим обьемрм воды и высушивают при 80 С, В резуль
4 тате в виде снежно-белых блестящих. пластинок ролучают 68,9 г (выход
964) 1-амино-5-карбокси-.2-метилбензи мидазолхлорида с т,пл, 287-288 С (с разложением), Вычислено, 4: С 47,48; Н 4,43;
N 18,46, С1 15,17.
С Н С1ИзОд
Найдено, В: С 47,85; Н 4,83;
N 18, l5; Cl 15,20, //) 68,1 r гидрохлорида, полученного по методике С примера 14, суспендируют в 1 л метанола. Далее повторяют методику F примера 5, получив
48 г (выход 784) 1-амино-5-метоксикарбонил-2-метилбензимидазола с т.пл, 220-222 С.
Вычислено, 4: С 58,53; Н 5,40;
N 20,48.
С,> H yy 1,0, Найдено, Ж: С 58,10, H 5,38;
N 20,25.
Е) В суспензию, содержащую 14,5 r
4-хлор-3-(N-диметиламинометилиден)-сульфамоилбензойной кислоты в 50 мл хлористого тионила добавляют 2 капли диметилформамида. Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 2 ч, затем фильтруют, получив прозрачный раствор, Фильтрат выпаривают под.пониженным давлением, В результате получают 12,7 г (выход 824)
4-хлор-3-(N-диметиламинометилиден)-сульфамоилбенэоилхлорида в виде снежно-белого твердого вещества с т,пл, 140 С, После перекристаллиэаб ции иэ бензола температуру плавления о повышают до 154-155 С.
Вычичлено, 4: С 38,84; Н 3,26, N 9,06; Cl 22,93; S 10,37.
С // Н.рС1 Н ОзБ
Найдено, 4: С 38,28; H 3,07;
N 8,94; C123,14, S 10,58.
Пример 15, Смесь, содержащую 25 r 2-амино-4-метоксикарбос / нил-11- 4 -хлор-3 «(Б-диметиламинометилиден)-сульфамоилбензоил -фенилгидразина в 80 мл уксусного ангидрида выдерживают при комнатной температуре в течение ночи, а затем смешивают с 250 мл воды. Кристаллы
736339Фильтруют с вакуумом, промывают во1 дой и сушат, Получают 26 г 2-ацетиламино-4-метоксикарбонил-N- 4
5
-хлор-3 - (N-диметиламинометилирен)—
-сул ьфамоилбензоил -фенилгидразина с т,пл ° 216-220 С (с разложением) . о
26 г полученного таким образом продукта кипятят в 200 мл ледяной уксусной кислоты в течение 5 ч. Прозрачный желтый раствор выпаривают под пониженным давлением и остаток растирают в воде. Выделившиеся кристаллы фильтруют с вакуумом, промывают ворой и высушивают. Таким об-. разом, в виде бежевого порошка получают 24,5 г (выход 98 ь в пересчете г t на исходное аминосоединение) 1- f4—
-хлор-3 -(N-диметиламинометилиден)-сульфамоилбенэоил -амино-5-метоксикарбонил-2-метилбензимидазола с о т,пл, 245-255 С (с разложением). Температуру плавления перекристаллизацией из нитрометана удается повысить о до 260-263 С. Этот продукт оказывается идентичным продукту по примеру 14, Получение исходных материалов, А) 17,75 г кристаллического кар30 боната натрия, растворенного в 330 мл воды, добавляют в суспензию 70,76 r
4-метоксикарбонил-2-нитрофенилгидразина в 670 мл диоксана, 103,6 г 4-хлор-3-(N äèìåòèëàìèíoìåòèëèäåí)-сульфамоилбензоилхлорида, раство35 ренного в 280 мл дйоксана, по каплям добавили в вышеуказанную смесь с перемешиванием, в результате чего получают трюмный прозрачный раствор, Величину рН реакционной смеси периоди40 чески регулируют, поддерживая ее на уровне приблизительно 7 периодическим добавлением нормального раствора бикарбоната натрия, После завершения операции добавления смесь перемешива45 ют в течение дополнительного 1 ч а затем разбавляют 1 л воды, Осадок фильтруют с вакуумом, промывают водой и высушивают при 80 С, Получают
127,8 г (выход 78,8ь) 4-метоксикарбо50 нил-2-нитро-N (4 -хлор-3 -(N-метил" аминометилиден)-сульфамоилбензоил -Фенилгидразина с т,пл, 243-247 С, После перекристаллизации из нитрометана температуру плавления повышают я до 255-256 С, !
Вычислено, ь: С 44,68 Н 3,75, и 14,47; С17,33, s 6,63.
Св Н13 С1Н5078
2П
1736339
Найдено, Ф: С 44,70; Н 3,69;
N 14,70; Cl 7,53; S 6,79, В) 5 г 10ь-ного палладия на угле в качестве катализатора добавляют в суспензию 61 r нитросоединения, полученного по методике А примера 15, в 40 мл 963-ного этанола. Смесь вью держивают при 60-70 С и по каплям при той же температуре добавляют
250 мл 30™ь-ного водного раствора гипофосфита натрия с такой скоростью, чтобы избежать интенсивного пенообразования. После завершения операции добавления. смесь перемешивают в течение дополнительных 30 мин при 6070 С, После охлаждения смесь фильтP руют., твердый продукт смешивают с
250 мл диоксана, фильтруют и фильтрат выпаривают под пониженным давлением, 11осле растирания остатка в
200 мл 50ь-ного водного раствора этанола кристаллы фильтруют с вакуумом, промывают 503-ным этанолом и высуши0 вают при 80 С, Таким образом, в форме кристаллов цвета масла получают 40 г (выход 684) 2-амино-4-метоксикарбоГ нил-N- 4 -хлор-3 - (N-диметиламинометилиден) -сул ьфамоилбензоил) -фенилгидразина с т,пл, 219-220 С (с разложением), Вычислено, 3: С 47,63; н 4,44;
N 15,43, Cl 7,81.
С n„ciN Î S
Найдено, ь: С 47,80 Н 4,25;
15е44, С1 7,41 °
Пример 16, 23.,9 r 1- 4
-хлор"3 "(N-диметиламинометилиден)-сульфамоилбензоил -амино-5-метоксикарбонил-2-метилбензимидазола перемешивают в 150 мл 2 н, раствора гидрата окиси натрия при 50 С до ïðåo кращения процесса образования аммиака. В этот период времени образовался желтый раствор, После охлаждения раствор подкисляют до РН 1 добавлением 2 н, соляной кислоты, Осадок фильтруют с вакуумом, промывают водой и высушивают..Получают в виде белого порошкообразного проI I дукта 1- (4 -хлор-3 -сул ьфамоилбензоил) -амино-5-карбокси-2-метилбензимидазола с т,пл.293-296 С (с разложением) после перекристаллизации из 50 ь-ного водного раствора этанола„
1 !
Вычислено, 4: С 47,00; Н 3,20, N 13,71; С1 8,67; S 7,85, С Н С! И405Б
Найдено, 4: С 45,80, Н 3,71;
N 13,93, Cl 8,80; S 7,74.
Пример 17, Методику примера
14 повторяют за исключением того, что в данном случае в качестве исходного соединения используют 10,63 r
1-амино-5-метоксикарбонилбензимидазола. В результате в виде бледножелтого порошка получают 21,1 г о, у I (выход 82 ) 1- 4 -хлор-3 -(N-диметилеминоэтилилен)-сулнбемоилбензоил1-а ми но-5-мет окси ка р бон ил бенз имидж з ола с т.пл. 249-252 C (с разложением).
Вычислено, r.: С 49,19; Н 3,91, N 15,10, S 6,91, Cgg Нщ C1NgS
Найдено, %: С 49,62, Н 4,36; и !5,30, s 6,68, 20 Получение исходных продуктов.
А) 2,5 г 104-ного палладия íà угле в качестве катализатора добавляют в раствор 25,3 г 4-метоксикарбонил-2-нитро-N-ацетилфенилгидра25 зина в 380 мл метоксиэтанола и смесь подвергают гидрогенизации в аппарате для встряхивания до прекращения процесса поглощения водорода. После отфильтровывания катализатора фильт-. рат выпаривают под пониженным давлением и остаток смешивают с 100 мл воды, Выделившиеся кристаллы фильтруют с вакуумом, промывают водой и о высушивают при 80 С, Таким образом, в виде бежевого кристаллического
35 твердого вещества получают 19,1 г .(выход 85,6i) 2-амино-4-метоксикарбонил-N-aцетилфенилгидразина с т.пл.
175-178 С. После перекристаллизации из метанола температуру плавления
40 удается повысить до 180-182 С.
Вычислено, 1: С 53,80, Н 5,87;
N 18,82, С4Р Н43 N303
Найдено, Ф: С 53,17; Н 5 94
45 N 18,93.
B) Кипятят с обратным холодильником 22,3 г фенилгидразинового производного, полученного по методике
А примеРа 17, в 150 мл безводной муравьиной кислоты в течение 5 ч, прозрачный раствор фиолетового цвета выпаривают под пониженным давлением.В . результате приливания 250 мл воды к
55 остаточной смолоподобной массе получают раствор, из которого вскоре начинают выпадать белые кристаллы, После выдержки в течение нескольких ча-, сов кристаллы отфильтровывают с ва21
17 куумом промывают водой и высушивают при 80 С, Получают в виде белого .крис таллического твердого вещества 17,2 г (выход 76/) 1-ацетиламино-5-метоксикарбонил-бензимилазола с т. пл. 210212 С (с разложением).
Вычислено, 1: С 56,65, Н 4,75,.
N 18,02.
С lqH 1З" Э
Найдено, : С 56,55; Н 4,67;
N 18 28.
Cj 32,5 г банаимидааолового лроизводного, полученного по методике В примера 17, кипятят в 140 мл 2 н, соляной кислоты в течение 5 ч, После осветления раствора активированным углем, фильтрования и охлаждения выпавшие в осадок кристаллы отфильтровывают с вакуумом, промывают неболь; шим количеством воды и высушивают при
80 С. Таким образом, в виде снежнобелого кристаллического твердого ве щества получают 23,2 г (выход 783)
1-амино-5-карбоксибензимидаэолгидрохлорида с т.пл. 325-330 С.
Вычислено, i: С 44,98; Н 3,77;
N 19,67; Cl 16,60.
C
Найдено, 4: С 44,49; Н 3,80;
N 19,68; Cl 16,52.
D) 26 г бензимидазолового производного, полученного по методике С примера 17, используют для реакции с 270 мл метанола, содержащего хлористый водород, аналогично методике
F примера 5, Рля разложения полу . ченного таким образом гидрохлорида используют 220 мл нормального раствора бикарбоната натрия. В результате получают 19,3 г (выход 83 ) 1-амино-5-метоксикарбонилбензимидазола с. т,пл. 194-195 С, Вычислено, ь: С 56,54," Н 4,75;
N 21,98.
С9 Н ИЗО г
Найдено, Ф: С 56,95, Н 4,63;
N 21,62, Пример 18, 28в) г 2-аминоУ
-4-метоксикарбонил-N- (4--хлор-3 -(R-диметил