Способ биотестирования наличия химических соединений в водной среде
Иллюстрации
Показать всеРеферат
Использование: биотестирование наличия химических соединений в водной среде. Сущность изобретения: учитывают скорость поступательного движения клеток микроводорослей и величину , характеризующую ориентацию направления движения клеток относительно бокового света. Эту величину оценивают по формуле R(V/V )/( ), где R - показатель; V, VK, - скорость поступательного движения клеток в опытной и контрольной средах; ft, РК- величина, характеризующая ориентацию направления движения клеток в опыте и контроле относительно бокового света . Наличие химических соединений в опытной среде регистрируют в случае достоверного отклонения величины R от единицы. 3 табл., 1 ил. Ј (Л с
8 А1 (19) (11) СООЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (gg)g G 01 N 33/18
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н АВТОРСКОМ,Ф СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР (21) 4737382/13 (22) 13.09,89 (46) 07.06.92. Бюл. и 21 (71) Украинская сельскохозяйственная академия (72) Ю.И.Посудин (53) 556.555.8(088.8) (56) Масюк Н.П, Укр. бот. журн. 1961, т.- 18, и 5, с. 62-64.
Авторское свидетельство СССР
)г 1482887, кл. G 01 N 33/18, 1989. (54) СПОСОБ БИОТЕСТИРОВАНИЯ НАЛИЧИЯ
ХИМИЧЕСКИХ СОЕДИНЕНИЙ В ВОДНОЙ СРЕДЕ (57) Использование: биотестирование наличия химических соединений в водной среде. Сущность изобретения:
Изобретение относится к санитарной, медицинской и сельскохозяйственной микробиологии, альгологии, токсикологии и может быть использовано при биомониторинге и контроле водных сред.
Известен способ биотестирования наличия химических соединений (в частности, гибереловой кислоты) на ос нове регистрации потери подвижности и отмирания клеток зеленых водорослей Dunaliella salina.
Данный способ, оснбванный на визуальном наблюдении движения клеток, довольно трудоемок, неточен, так как связан с необходимостью регистрации живых и неживых клеток посредством микроскопа.
Наиболее близким к предлагаемому является способ, основанный на оценке энергозатрат, скорости движения и
2 учитывают скорость поступательного движения клеток микроводорослей и величину, характеризующую ориентацию направления движения клеток относительно бокового света. Эту величину оценивают по формуле R=(V/V<)/(P/P ), где К вЂ” показатель; V, V. — скорость поступательного движения клеток в опытной и контрольной средах; Р, Рк— величина, характеризующая ориентацию направления, движения клеток в опытe и контроле относительно бокового све.та. Наличие химических соединений в опытной среде регистрируют в случае достоверного отклонения величины R от единицы. 3 табл., 1 ил.
1 числа подвижных клеток с помощью метода корреляционно-доплеровской спек.троскопии, который содержит следующие операции. Вносят исследуемое химическое вещество определенной концентрации в суспензию тес г-обьектов (водоросли Dunaliella salina, Dunaliella virilis), Через 30-100 мин облучают когерентным светом в красном диапазоне кювету с суспензией водорослей и химическим веществом и измеряют флуктуации рассеянного на движущихся клетках света и определяют корреляционную функцию амплитуды рассеянного излучения. Оценивают скорость, число подвижных клеток и относительную величину энергозатрат на движение клеток водорослей и судят о токсическом эффекте, производимым химическим веществом, по концентрации этого вещества, при которой имеет ме3
1739 сто увеличение энергозатрат на движе-"
we клеток водорослей.
Недостатками известного способа являются длительность процесса определения действия химических веществ (более 30-100 мин), необходимость поддержания точной температуры (26+
+ 0,5 C). Отклонение от этого значения влияет на точность измерений.
Ограниченность способа проявляется в том, что не все химические вещества действуют непосредственно на скорость движения клеток, число подвижных клеток и относительную величину энергозатрат. Например, азид натрия (Иаецу) ингибирует способность клеток ориентироваться относительно направления распространения света (фототопотаксис), оставляя без изменения указанные параметры движения.
Цель изобретения - сокращение времени и повышение точности определения химических веществ, а также расширение возможностей способа.
Поставленная цель достигается путем измерения параметров фотодвижения водорослей - скорости поступательного движения, стимулируемой белым светом, направленным через конденсог микроскопа на предметное стекло с суспензией водорослей и способности клеток ориентироваться относительно направления распространения белого света, направленного под углом к поверхности предметного стекла с суспензией клеток водорослей.
На чертеже дана схема для иллюстрации предлагаемого способа.
На схеме показаны источники 1 и 2 света, объект 3 (предметное стекло с углублением, а котором располагают суспензию водорослей), микроскоп 4, видеокамера 5, телевизор 6.
При определении скорости v поступательного движения излучение источника 1 пропускают через объект 3 и регистрируют скорость движения клеток через микроскоп 4 с помощью видеокамеры 5 на экране телевизора 6 путем фиксации времени прохождения клетками определенного расстояния.
Способность клеток водорослей проявлять ориентацию относительно направления распространения бокового света (от источника 2), направленного под углом к поверхности предметного стекла 3 с суспензией водорослей, характеризуется параметром Р фототопотаксиса, который определяется
288
55 где ч, v„ — скорости поступательного движения клеток в опытной и контрольных средах; г, P - величины, характеризующие ориентацию направления движения клеток а опытной и контрольной средах относительно бокового света.
Наличие химических соединений в опытной среде регистрируют а случае статистически достоверного отклонения показателя R от единицы. Так, при отсутствии химического вещества в водной среде.v=v и т" =1, т.е.
R=1. В присутствии химического > вещества чФч„ или Р Ф Р, т.е. R > 1 или к
R (1. Кроме того, возможны количественные оценки присутствующего в водной среде химического вещества с помощью параметра R = который при отсутствии химического
4 какт- =(n<-no)/(ni+n„) Где n< и и количество клеток, двигающихся к источнику бокового света и от него соответственно. Освещенность суспензии при определении v и P составляет
500 лк.
Оценку наличия химического вещества в водной среде производят следующим образом. Размещают тест-объекты (водоросли) в опытную, с химическим веществом, и контрольную, без хими- ческого вещества, среды: обе среды вносят в экспериментальные ячейки оптической системы, т.е. в углубления предметного стекла, которое размещают на предметном столике микроскопа, закрыв покровным стеклом. Располага" ют ячейки последовательно в фокусе
20 микроскопа 4, сопряженного с видеокамерой 5, и освещают объекты светом источников 1 и 2. На экране монитора
6 регистрируют скорости v и чк посту" пательного движения клеток в опытном и контрольном образцах соответственно при освещении их светом исто ника
1, а также параметры фототопотаксиса
Р и Р, характеризующие способность клеток водорослей ориентироваться относительно бокового света от источника 2 в опытном и контрольном образцах соответственно.
О наличии химического вещества в водной среде судят по показателю R, который рассчитывается по формуле
R (ч/чк)/(®/ К) °
Способ биотестирования наличия химических соединений в водной среде, предусматривающий помещение водорослей в опытную и контрольную среды, внесение обеих сред в экспериментальные ячейки. оптической системы, освещение ячеек боковым светом, определение параметров фотодвижения водорослей в обеих средах, расчет показателя, учитывающего эти параметры, и регистрацию наличия химических соединений в опытной среде по его величи20 не, отличающийся тем, что, с целью сокращения времени и повышения точности тестирования, а также расширения функциональных возможностей способа, в качестве параметров
25 фотодвижения водорослей используют скорость их поступательного движения и величину, характеризующую ориентацию направления движения клеток водорослей относительно бокового света, 3р расчет показателя проводят по формуле
>Ик / рк где R — показатель;
v, v — скорость поступательного движения клеток соответственно в опытной и контрольной средах;
Р, P . — величина, характеризующая ориентацию- направления движения клеток в опыте и контроле относительно бокового света, а наличие химических соединений в опытной среде регистрируют в. случае статистически достоверного отклонения от единицы.
173 вещества равен -Г2; при наличии химического вещества в водной среде величина R<, отличается от 42 в зависимости от концентрации химического вещества.
5 формула изобретения
Таким образом, предлагаемый способ содержит следующие операции.
Размещают тест-объекты (водоросли) в опытную, с химическим веществом, и в контрольную, без химического вещества, среды, вносят опытную и контрольную среды в экспериментальные ячейки оптической системы, располагают ячейки последовательно в фокусе микроскопа, сопряженного с системой видеорегистрации, освещают ячейки через конденсор микроскопа и боковым светом. Регистрируют на экране видеомонитора скорости v и v движения клеток в опытном и контрольном образцах соответственно, а также параметры Р и 9<, характеризующие способность клеток ориентироваться относительно; бокового света в опытном и контрольном образцах соответственно и оценивают показатель R=(v/vt,)/
/(Р/У„). Регистрируют наличие химического вещества в водной среде в случае статистически достоверного отклонения показателя R от 1, .т.е, R c 1.
В качестве примера реализации предлагаемого способа приведены зависиMocTb cKopocT v nocT naTen Ho o ps жения и фототопотаксиса Р клеток зе. леной водоросли Dunal iel la salina и Dunaliella viridis от концентрации некоторых химических веществ.
Результаты биотестирования азида натрия с помощью клеток Dunaliella
salina приведены в табл. 1.
Результаты биотестирования поверхностно-активных веществ (анионных) с помощью Dunaliella viridis приве- дены в табл. 2.
1739288
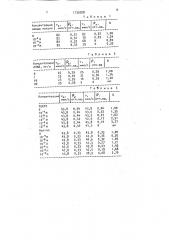
Таблица
Концентрация азида натрия
10 М
10 М
10 Ì
1,00
1,24
0,82
0,35
0,32 82 0,32
0,32 79 0,25
0,32 68 0
0,32 29 0
82
82
82
Таблица 2
Концентрация v
АПАВ, мг/л мкм/с отн.ед. мкм/с отн.ед
25 0,29 1,00
31 0,36 1,24
16 0,35 1,20
5 0 со
25 0,29 . 25 0,29
25 0,29
25 0,29
1
Таблица 3
Концентрация %к, мкм/с отн.ед. мкм/с отн.ед.
43,8 0,44
43,8 0,44
43,8 0,44
43,8 0,44
43,8 0,44
43,8 0,44
43,8 0,44
43,0 0,32
43,5 0,27
42,5 Oil7
45,8 0 14
41,3 0
1,00
1,35
1,62
2,51
3,27
43,8 о,33
43,8 0,33
43,8 0,33
43,8 0,33
433,8 0,33
4,8 0,33
43,8 0,33
43,8 0,33
43,0 0,35
44,6 0 32
43,3 0,27
42,8 0,23
42,5 - 0,19
28,9 0,08
1,00
0,92
1,05
1,21
1,40
1,68
2,70
ТЕКТО
10 М
1 0-8 М
10 М
IO М
10 М
Ацетал
10-9 М
10 М
10 И
10 И
10- М
10 М к Р мкм/с отн.ед. мкм/с отн.ед.
1739288
Составитель Ю.Посудин
РеДактоР А.КозоРиз ТехРеД А,Кравчук Корректор С.Иекмар
Заказ 1999 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-издательский комбинат "Патент", г. Ужгород, ул. Гагарина, 1О!