Способ конструирования рекомбинантной плазмидной днк, кодирующей фермент деацетоксицефалоспорин с синтетазу/деацетилцефалоспорин с синтетазу
Иллюстрации
Показать всеРеферат
Изобретение касается получения плазмид, кодирующих фермент с активностью деаДектосицефалоспорин С синтетазы и деацетилцефалоспориа.С синтетазы. Сконструированы рекомбинантные плазмидные ДНК , рТТ507, pLT511, pPS58, pPS359, pPSbO, pPS61, pPS62, pIL502, обеспечивающие экспрессию DAOCS/DACS в клетках Escherichia co- li, Penicillium chrysogenum и Cepha- losporum acremonium.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (51)5 С 12 М 15/52
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР (21) 4355306/13 (22) 03.03.88 (31) 021836 (32) 04.03.87 (33) US .(46) 07.06.92. Бюл. ¹ 21 (71) Эли Лилли Энд Компани (US) (72), Томас Доминик Инголиа, Стефен
Виатт Квййер, Сьюллен Мэри Сэмсон и
Пол Латер Скэтрад (US) (53) 575.224.2; 577 ° 2(048) (088.8) Изобретение относится к генетической инженерии, касается получения . ппазмидных ДНК, кодирующих фермент с активностью деацетоксицефалоспорин С синтетазы (DAOSC) и деацетилцефалоспорин С синтетазы (DACS).
DAOCS катализирует реакцию, в которой из пенициллина N образуется (DAOS) и является экспандазой; DACS . катализирует образование деацетилцефалоспорина (DAS) и DACS по реакции гидроксилирования. Эти реакции являются основными этапами биосинтеза важных антибиотиков, таких как цефалоспорины из Cephalosporium acremo.nium и 7 g-метоксицефалоспорины из . Streptomyces c1avu1igerus.
Фрагмент ДНК, кодирующий активность DACS/DAÎCS, выделяют из геномной ДНК Cephalosporium acremonium и»
„„ЯЦ„„1739856 АЗ
2 (54) СПОСОБ КОНСТРУИРОВАНИЯ РЕКОМБИНАНТНОЙ ПЛАЗМИДНОЙ ДНК,КОДИРУЮЩЕЙ
ФЕРМЕНТ пЕАЦЕТОКСИЦЕФАЛОСНОРИН С СИН
ТЕТАЗУ/ДЕАЦЕТИЛЦЕФАЛОСПОРИН С СИНТЕТАЗУ (57) Изобретение касается получения плазмид, кодирующих фермент с активностью деацектосицефалоспорин С синтетазы и деацетилцефалоспорин;С синтетазы. Сконструированы рекомбинантные плазмидные ДНК., рТТ507 pI T511, рР$58, pPS359, рРЗЬО, pPS61, рР$62, рП 502, обеспечивающие экспрессию
ВАОС$/DACS в клетках Escherichia coli, Penicillium chrJJsogenum H Cephalosporum acremonium. используют для построения векторов экспрессии, .которыми трансформируют штаммы ЕзсЬегхсЬха со11..
Сырые клеточные экстракты из трансформированных E.coli проявляют активность DAOCS/DACS без .какой-либо предварительной активации. Сконструированные в кторы и трансформанты обеспечивают эффективное получение больших количеств активного фермента DAÎCS/DACS. фермент DAOCS/DÀÑS можно применять для продуцирования рАОСИ и DACS и дли гидроиоилирораииа фр цефалоспоринов для образования новых (ф антибиотиков.
Рекомбинантные плазмидиые ДНК могут быть использованы для создания штаммов Penicillium, "Cephalosporium> продуцирующих пенициллиновые и цефалоспориновые антибиотики.
39856 4 способах построения векторов экспрессии при трансформации широкой разноя видности организмов, продуцирующих пенициллиновые и цефалоспориновые антибиотики.
ДНК, кодирующие DACS/DAOCS, вьщеляют с регуляторными последовательностями, которые контролируют транскрипцию. Описаны новые регуляторные последовательности, которые могут использоваться в новых способах для обеспечения трансляции и транскрипции любого генного продукта в Cephalosporium. Эти регуляторные последовательности особенно эффективны в С.acremo- .
nium.
Описаны регуляторные сигналы гена
DACS/DAOCS, расположенные у 3 -конца 0 кодирующего гена DACS/DAOCS Cephalosporium acremonium. Эти 3 -регуляторные
t последовательности кодируют термийацию транскрипции и полиапенилирование
-PHK, а также сигналы обработки гена
DACS/DAOCS. Помещение этих сигналов в 3 -конце гена усиливает экспрессию
I гена в Cephalosporium.
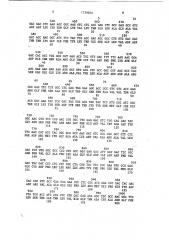
10 20 . 30: 40,, 5 -А АСС TTG TAC GGA GAA TTA AGG СТТ GCA CGA ТТС САТ GGC GGT СТС
50 60 70 80 . 90
GAC.GAT CAG GGA ССА TGC АСС АТА CAT АТТ СТС CTG CGA ACC AAG ААС
100 .. 110 . 120 . 130 140
° GAG AAG AGA АСТ CGA TGG CTT СТТ ATG АТТ CGT TGA САА ААС ТТС ACA
150 . 160 170 180 . 190 .
AGA САС TCG TGG GTT ТАС AAT GCT АСА TTG ACG TGT GCG GCC AAG GCT
GAG GGG
200 210
AAG CAG GGC GTC ACT ТАС GGC ТАА GTA GCA GTT GTC Т
220 230
240 : 250 260 270
60А GTT ССТ СС6
С G CGT AAG СТА CGA GGT GGG GTT TGA GAT ATA ТАТ АТА
270 280
290 300 310
CCG CTT TGA САА С
340 350 360
С Т ТТС GTT СТС ACT. GGG ATC TTG TGA АТС CTT
ТТС CTC TTG CAG AAC ТТТ ССТ ССА CGC ТАС ТСС ТСТ САА GTC АТС GCT
3 17
В предлагаемом описан усовершенствованный способ трансформации Penicillium рекомбинантными ДНК. Эта нова система трансформации использует amds ген Aspergillus nidulans. Используя ацетамид (CH>CONHz как единственный источник углерода или азота на пластинах трансформации, можно отобрать клетки хозяина Реп сд11 шп, трансформированные вектором, содержащим ген
amds, от нетрансформированных, которые не в состоянии расти на данных ппастинах ввиду того, что клетки хозяина Penicillium дикого типа не выражают .активность ацетамидазы.
Предлагаемые рекомбинантные плаз» мидные ДНК могут быть использованы для получения штаммов Paecilomyces s
Streptomyces, в частности S.clavuligerus, которые экспрессируют DAOCS/
/DACS Хотя ДНК, кодирующую DACS/
/ЭАОСБ, выделяют из Cephalosporium асгешопхшв, плазмидная ДНК, содержащая этот ген, может быть использована для построения векторов экспрессии .DACS/DAOCS в широкой разновидности клеток хозяев. Большинство организмов, которые продуцируют пенициллины и цефалоспорины, используют общйй пред- " шествующий пенициллин N, субстрат для
DAOCS. Фрагменты ДНК, кодирующие
DACS/ПАОСЗ, могут использоваться в
Последовательность ДНК штамма Brotsu Cephalosporium acremonium, кодирующая как активность DACS так и активность DAOCS представлена в виде .
400 410 420
390
AAC CAC AGC A7C ААС ATG ACT ТСС ААО
G GTC ССС GTC ТТТ CGT СТС
ИЕТ THR SER LXS VAL PRO VAL РНЕ ARG LEU
1739856
5 10
440 450 460 470
GAC GAC СТС AAG AGC GGC AAG GTC СТС ACC GAG СТС GCC ОАО GCC GTC
ASP ASP LEU LYS SER GIY LYS VAI, LEU THR GLU LEU AIA GLU ALA VAL
15 20 25
480 490 500 . 5 10 520
АСС АСС AAG GGT АТС. ТТС ТАС TTG АСС GAG AGC GGC CTG GTC GAC GAC
THR THR ТУБ GLY ILE PHE TYR LEU THR GLU БЕф GLY LEU VAL АЗР ASP
30 35 40
530 540 550 560 . 570
GAC САС АСС TCG GCG CGT GAG ACG TGC GTT. GAC ТТТ ТТС AAG ААС GGA
ASP HIS THR SER ALA, ARG GLU THR CYS VAL ASP PHE PHE LYS ASN GLY . 45 50 55
580 590 600 610 620
AGC GAG GAG GAG AAG AGG GCC GTG ACG СТС ССС GAC CGT ААС GCC CGC
БЕК GLU GLU GLU LYS ARG ALA,VAL ТНК LEU ALA. ASP ARG ASN ALA ARG
GCC СТС GAG TGG GAG
ALA LEU GLU TRP GLU
АСС GAG JHR GLU
TCG GAC ТАС TCG ACG
SER ASP TYR SER THR
AT.Ñ GGC
ILE GLY
105
720 730 740 750 760
GGC ААС CTG ТТС CCG ААС CGG GGC ТТС GAG GAC GTC TGG CAG GAC. ТАС
GLY ASN LEU PHE PRO ASM ARG GIY PHE GLU ASP VAL TRP GLN ASP TYR
110 115 120
770 780 790 800 . 810
ТТС ОАС CGC ATG ТАС GGC GCA GCC AAG GAT GTC GCG CGC 6СС GTT СТС
PHE ASP ARG ИЕТ TYR И7 АТА АХА LYS ASP VAL ALA ARG ALA VAL LKU
125 130 135
820 830
ААС ТСТ GTG GGC GCC CCG СТС
ASN SER VAL GLY ALA PRO LEU
140 145
870 880
GAG TGC GAT ССС СТС СТС CGC
GLU CYS ASP PRO LKU LEU ARG
155 160
GCC GGG GAG
ALA GLY GLU
890
СТА CGG ТАС
LEU ARG TYR
GAC CGC GTC GCC GAA GAG
ASP ARG VAL ALA GLU GLU
960 970
СТА TCG АСС АТС ACG СТС
LEU SER TER П.Е THR LEU
190
930 940 950
GAA CCC СТС CGC ATG GGA ССС САС ТАС GAC
GLU PRO LEU ARG ЛЕТ ИХ PRO НТБ TYR АБР
180 .:185
980 990 1000
GTG САС CAG АСА GCC TGC GCC ААС GGC ТТС
VAL HIS GLN THR ALA CYS ALA ASN GLY РИЕ
195 200
CGC GGC ТТС ТСТ
ARG GLY PHE SER
ACG GGC AAG ТАС
THR GLY LYS TYR
650 . 660
AGC АСС GCC GTC GTC
SKR THR ALA VAL VAL
700 710
TGC ТАС ТСС ATG GGC
CYS TYR SER ИЕТ 6ТУ
100
850 860
GAC ATT GAT GAC ТТС 6ТС
ASP ILE ASP ASP PHE ЧАХ
900 910
ТТС CCC GAA GTG CCG GAG
РНЕ PRO GLU VAL PRO GLU
165 170
1739856
GAC GGA GAA
ASP GLY GLU
ТТС TGC GGC
PHE CYS GLY
CAG TGC GAG GTG
GLN CYS GLU VAL
GCC ATG GTC GTC
ALA ИЕТ VAL VAL
225
1130 1140 1150
AAG САС CGG GTC AAG ТСТ ССС GGG
LYS HIS ARG VAL LYS SER PRO GLY
245 250
1180 1190
CGC ACG TCG AGC GTC ТТС ТТС CTG
ARG TER SER SER VAL PHE PHE LEU
260 265
1110 1120
ACG GGC GGC AAG GTC.AAG GCG ССС
THR GLY GLY LYS VAL LYS ALA PRO
235 240
1160 . 1170
CGC GAC CAG CGC GTC GGC AGC AGC
ARG ASP GLN ARG VAL GLY SER SER
255
1200 1210 1220 1230 1240
CGG CCG ААС ССС GAC ТТС AGC ТТС AAC GTG CAG CAG TCG AGG GAG TGG
ARG PRO LYS PRO ASP PHE SER PHE ASN VAL GLN GLN SER ARG GLU TRP
270 275 280
1250 1260 1270 1280 1290
GGT ТТС AAC GTC CGC АТС CCG TCG GAG CGC ACG ACG ТТС AGG GAG TGG
QLY PHE ASN VAL ARG 1ЕЕ PRO SER GLU ARG THR THR PHE ARG GLU TRP
285 290 295
1300 1310 1320 1330 1340
СТТ. GGC GGG AAC ТАТ GTC AAC ATG CGG AGG GAT AAG CCG GCG GCA GCG
LEU GLY GLY ASN TYR VAL ASN ИЕТ ARG ARG ASP LYS PRO ALA. ALA ALA
300 .305 310
1350 . 1360 1370 1380 1390
GAG GCG GCT GTC ССС GCG GCT GCC ССТ GTC ТСТ АСС GCA GCT ССТ АТА
GLU ALA ALA VAL PRO ALA АЬА ALA PRO VAL SER THR ALA А1 А PRO ILE
315 320 325 330
1400 1410 1420 1430
GCC АСТ TAG GGA АСС CGC CGA TCG AGT ААТ ААА ТСТ ACG GGA GTT ТАА
ALA THR
1440 1450 1460 1470 1480
GAA GAA AAA TTG ССС ТАТ ААА TTG CTA ААТ ТТТ TAA AAC ACA AAG CAT
1490 1500 1510 GAG TGT САА GAG ТТТ CAA GTT ТСА А-3 . 1010
GTG AGC CTG
VAL SER LEU
CTC ССС GGC
LEU PRO GLY
220
1040 1050
ТТС GTC GAC СТС CCG ACG
PHE VAL ASP LEU PRO THR
1090 1100
GCG GTC GGC ACC CTG GCC
ALA VAL GLY THR LEU ALA
230
39856
10 экспрессии фермента DACS/DAOCS в
E.coli.
Построение плазмиды pIT507 вклю5 чает сшивку Sst I — - Bani.HI фрагмента размером 2,2 кв, кодирующего DACS/
/DA9CS плазмиды pIT503 с 5,8 кв
Nde I — - Ban HI фрагментом плазмиды
pCZR336, и синтезированйым фрагментом "60 п.о. Sst .I — Nde
1О
Плазмида pCZR336 включает образованный от ЯрЬ промотор, последовательность, активирующую трансляцию, оператор гена cI857, первую функциональную единицу наследственности
l5 (Цистрон ), кодирующую небольшой у! пептид, и последовательность ДНК, кодирующую производное hGH. При низкой температуре, составляющей 30 С,.бе0 лок, копированный на плазмидах
pCZR336 и pI507, является активным и способен подавлять активность промотора А рЬ, но при повышении температуры да 42 С белок сХ857 инактивируется и промотор ускоряет транскрипцию большого количества мРНК, кодирующей hGEI (pCZR336) или DACS/DAOCS (pIT507).
Плазмида pIT507 включает тот же первый цистрон, cI857 ген, промотор
30 « .»pL и последовательность, активирующую трансляцию, что и плазмида
;pCZR336, но включает кодирующую последовательность гена РАСЯ/DOACS от плазмиды рХТ503 вместо кодирующей
35 последовательности hGH. Ограничительный фрагмент 2,2 п.о. Sst I — - Ваш 1П плазмиды pIT503 включает большую часть кодирующей последовательности
DACS/DAOCS, остальная часть этой ко1п дирующей последовательности содержится в синтезированном фрагменте 60 п.о. Nde I — Sst I с небольшой модификацией по сравнению с последовательностью ДНК дикого типа, что об 51легчает последующую работу.
Последовательность
5 -CATATG-3, l(libel
3 -GTATAC-5
50 включает
5-ATG-3
11(3-ТАС-5, 9 - 17
Фрагменты ДНК, кодирующие фермент с активностью DACS/DÀÎCS, выделяют из штамма Cephalosporium acremonium; известного как штамм Brotzu который
Ф
Э .содержится в коллекции культур аМе- риканского типа, Роквилл, Иэрилэнд (хранится под номером ATCC 11550).
Геномную библиотеку ДНК штамма Brotzu строят. в бифункциональном космидном векторе рКС462А (существующим в E.coli К12 под номером NRRLB-15973) и исследуют .на наличие последсвательностей, гомологичных ряду 32 различных деоксирибоолигонуклеотидов. Этот ряд деоксирибоолигонуклеотидов был построен на основании информации о частичной аминокислотной последовательности фермента С. acremonium DACS/
/DAOCS и знании генетического кода.
Были отобраны клоны, гомологичные одному или нескольким из 32 различных деоксирибоолигонуклеотидов.
Идентифицируют плазмидные ДНК, кодирующие фермент DACS/DAOCS, из которых выделяют фрагмент 7 кВ Ваш HI,. включающий ген DACS/DAOCS, и встраивают его в коммерчески доступную плазмиду рпС8. Получают лазмиду
pIT503, которой трансформируют Е.coli
К12 JA 221 ° Трансформанты E.coli К12
JA 221/pIT508 депонируют в коллекции культуры Северной региональной науч" но-исследовательской лаборатории .(NRRu) Пеория,,П. 61604, под номером
NRR LB-.18170.
Плазмида pIT503 служит в качестве исходного материала для построения других векторов экспрессии. Эти векторы.пригодны для получения фермента
DACS/DAOCS в рекомбинантной клетке хозяина. Для этого осуществляют трансформацию клеток хозяина рекомбинантной плазмидной ДНК, которая включает: промотор и последовательность, активирующую процесс трансляции; последовательность ДНК, которая кодирует DACS/
/DAOCS и операбельно связана с ука занным промотором; культивирование трансформированной клетки-реципиента, трансформированной в условиях, обеспечивающих синтез фермента.
Плазмиду pIT503 выделяют из Е.coli К12 JA 221, используют для построения векторов экспрессии Е.coli
DACS/DA0CS. Плазмида pIT503 используется в качестве исходного материала для построения плазмиды pIT507, которая обеспечивает высокую степень которая кодирует аиинотерминальную метионильную группу SACS/DAOCS.
Плазмида pIT507 построена так, что промотор рЬ и последовательности, активирующие трансляцию, расположены, 11; 173 обеспечивая экспрессию ДНК, кодирую щей ПАСЯ/DAOCS.
При.температуре 42 "С Е. coli К12 ,Зй 109/pIT507, экспрессируется DACS/
/DA0CS (" 15 от общего клеточного белка). Сырые клеточные экстракты от этих E.coli К12 JM 109/pI507 (трансформант) способны катализировать конверсию пенициллина N в DAOS и РАЯ, в то время как клеточные экстракты от нетрансформированных клеток
Е.со1х К12 JM 109 не могут катализировать эту конверсию.
Многие штаммы V-.coli К1,2;обладают активностью эндогенной цефалоспориназы, кодированной локусом ampG, При этом осуществляют частичную очистку полипептида DAOGS/DACS так, что достигается оптимальная активность
DAOGS/ПАСЯ. Для этой цели достаточна очистка фермента посредством ДЕАЕтривакрила для отделения эндогенной
Е.coli цефалоспориназы от фермента
DA0CS/ПАСЯ. Для исключения вредных влияний цефалоспориназы используют штамм, дефектный по данному ферменту.
Один акой штамм Е.coli К12 А85 892 находится на хранении в Северном региональном научно-исследовательском центре под номером NRRLB-18096.
Плазмиды pIT507 и pIT511 эффективно продуцируют большие количества
DACS/DA0CS в Е. coli. Е. coli pIT507 продуцирует DACS/DAOCS в количестве, приближающемся к 15 от общего клеточного белка. Ввиду moro< что культивирование K.coli менее сложно,,трансформанты Е.coli pIT507 могут быть использованы в способе продуцирования
DACS/DAOCS более эффективно и более экономично, чем естественные продуценты ПАСЯ/DAOCS.
DAOCS может быть использована для продуцирования DAOCS из пенициллина
N в свободной от клеток системе. DAOS является не только полезным антибиотиком, но также может быть использован в качестве исходного материала для продуцирования .таких важных антибиотиков как цефалексин и другие цефалоспорины. DACS/DÀOÑß используют для трансформации пенициллинов иных, чем пенициллин N в новые цефалоспориновые производные.
Свободные от клеток экстракты пенициллина и образующих цефалоспорин организмов могут использоваться для синтеза не имеющих природного происхождения Р-лактамов. Предлагаемые
9856 12
vitro" мутантных генов, создаваемых таким образом, позволяет продуцировать белки с комбинациями мутаций.
Такой мутант ПАСЯ/ПАОСЯ получен с помощью pIT513.
40. Изменение количества генетической информации (вызывающее таким образом вставку или делецию аминокислот в полученном белке) в кодирующей последовательности DACS/DAOCS ДНК изменяет
55 соответственно кодированную аминокислотную последовательность.
Существует целый ряд плазмид, который увеличивает внутриклеточную концентрацию фермента DACS/DAOCS трансформированной клетки., содержащих:
ДНК, кодирующую фермент DACS/DAOCS; промотор и последовательность, активирующую трансляцию, оперативно связанную с геном DAOC/ПАОЯ ° Стойкие трансформанты могут быть получены лишь, если .данный вектор воспроизводится либо как внехромосомный элемент, либо как интегрированный в геномную
ДНК в клетке хозяина. Описанные плазвекторы экспрессии E coli могут быть использованы в способе получения
DACS/DAOCS для трансформации пенициллинов, которые в естественном виде в природе не встречаются, для образования новых антибиотиков или структур с антибиотическим ядром.
Плазмида pIT507 пригодна для получения ПАСЯ/DAOCS в Е.coli не только из-за высоких уровней экспрессии фермента в этих клетках и из-за наличия маркера, присутствующего на данной плазмиде. Многие векторы кодируют Рлактамаэу и клетки, содержащие этот
I5 вектор, и могут расти в присутствии некоторых Р-лактамовых антибиотиков, таких как ампициллин. Однако, если желательно использовать свободный от клеток экстракт, содержащий ПАСЯ/
/DAOCS для целей построения Р-лакта-. мов, то нежелателен экстракт, который содержат активность /3-лактамазы. Так, плазмида pIT507 не кодирует 8-лактамазу, а использует стойкий к тетрациклину ген, который кодирует белок, не реагирующий с 8-лактамами. Осуществляют замену цистеиновой группы в положении 100 на серии в кодирующей зоне DACS/DAOGS плазмиды pIT513 данного вектора экспрессии. Этот обычный способ может использоваться для замены любой группы на любую из других 19 естественно кодированных аминокислот. Сращивание в условиях "in
173 миды включают также ген, придающий стойкость к антибиотику, либо какойлибо другой элемент, который обеспечивает средство отбора клеток хозяев, которые содержат данный вектор, но такие отбираемые элементы могут отсутствовать, когда вектор интегрируется в хромосомную ДНК клетки хозяина.
Векторы экспрессии в Penicillium u
Cephalosporium описаны следующим образом.
Плазмида pPS56 представляет собой вектор экспрессии Cephalosporium.
Плазмида рРБ55 представляет собой промежуточный продукт в построении плазмиды рРБ56. Плазмида рРЯ55 построена ns Hind III фрагмента плазмиды
pMLC12 и 2,3 т.п.о. Hind III фрагмента плазмиды рРБ34, который включает промотор С.acremonium IPR, слитый с кодирующей последовательностью гидромицин В фосфотрансферазы. Фрагмент
8am HI 7 кв, содержащий ген DACS/
/DAOCS плазмиды pIT503, слит с частично обработанной Bam HI плазмидои
pP$ 55, образуя плазмиду рРБ 56.
Промотор Cephalosporium acremonium и последовательность, активирующая трансляцию на плазмиде pIT503, расположены так, чо вызывают экспрессию
ДНК, кодирующей фермент с активностью синтетазы DACS/DAOCS, ввиду того, что при построении плазмиды pIT503 никаких делеций или вставок, действующих на промотор и последовательность, активирующую трансляцию не вводится в
ДНК, гранйчащую с 5 -концом.
Ген Penicillium IPS может быть встроен в высоко продуцирующие штаммы Penicillium с целью увеличения титра пенициллинов, продуцируемых при ферментации.
Плазмиды рЗБК2, pPS51, pPS52, pPS54 и pPS61 содержат ген amds u клетки Penicillium, заключающие эти плазмиды, и могут быть отобраны с использованием ацетамида. Плазмиды
pPS57 и pPS62 содержат гибридный ген, придающий стойкость к гидромицину, который использует плазмиды рР$59, в результате чего получают плазмиду рРБ61. Плазмида pPS61 предназначена для экспрессии фермента DACS/DAOCS
РепхсП1 шп, особенно P.chrysogenum.
Плазмиду pPS51 используют в качестве источника ацетамидного гена в других плазмидных построениях. Плаэмида pPS52 содержит ген DACS/DAOCS
9856 14 на фрагменте 7 т.п.о. Bam HI (от плазмиды pPS51) и синтезированную связывающую молекулу. Плазмида рРБ52 г обеспечивает экспрессию фермента
5 DACS/DAOCS. Плазмиду pPS52 используют для экспрессии фермента Cephalosporium либо в Penicillium.
Отбираемый маркер amds может быть введен в любой вектор экспрессии.
Вектор pPS54 включает ген amds от плазмиды рРЯ51 и ген Penicillium IPS.
Штаммы Penicillium обладают некоторой стойкостью к гидромицину. Оптимальные условия трансформации для использования НшК как отбираемого маркера требуют добавления чувствительных к гидромицину агентов. Способ отбора трансформантов Penicillium предлагает трансформацию рекомбинантной ДНК, включающей ацетамидный ген, клетки хозяина Penicj.ilium, а также культивирование трансформированной клетки в среде роста., которая содержит.ацетамид как единственный источник углерода или азота.
Источником ацетамидазного гена (amdS) от Aspergillus nidulans может быть плазмида рЗЯЕ (НИИ В-18182).
Создан промежуточный вектор, обозначенный как плазмида pPS51 который состоит из гена amds от плазмиды p3S2, слитой с плазмидой рЖС12. Плазмиду
pPS5i гидролизуют рестриктазой Hind
III„ обрабатывают фрагментом Кленова
35 и сшивают с фрагментом 2, 13 т.п.о., предварительно с затупленными концами, содержащим гибридный ген DACS/
/DAOCS, в результате чего получают плазмиду рРЯ60. Плазмида pPS60 содер40 жит промотор Penicillium IPS, расположенный рядом, для экспрессии коди- рующей последовательности DACS/DAOCS.
Осуществляют делацию двух небольших ограничительных фрагментов ХЬа1 из ф5 плазмиды рРБ60 создающей плазмиду рРБ58. Синтезированный связывающий фрагмент встраивают в ХЬа1; что обеспе- чивает операбельное связывание промото-, ра Penici 11ium I ХРЯ и кодирующей после"
50 довательности DACS/DÀOÑS, в. результате получая плазмиду pPS59. Плазмиду
pPS59 используют для выражения активности DACSfDAOCS в клетках в Penicillium и других клетках, в которых функционирует промотор Репхсд11 пш
IPS.
Плазмида pPS59 является промежуточным продуктом для построения векторов экспрессии: PenicØium. DACS/DAOCS
1739856
pPS 62 и pFS61. В обоих случаях фрагмент 2,1 т.п.о. Bam HI — Nru I плазмиды рРБ59 с затупленными концами посредством фермента Кленова используется как источник кадирующей последовательности DACS/DAOCS, слитой с промотором Penicillium IPS. Плазмиды
pPS61 и pPS62 содержат отбираемые маркеры rya Penicillium. Осуществляют слияние фрагмента 2,13 кв ллазмиды
pPS59 с расщепленной Hind III и обработанной фрагментом Кленова плазмидой рРБ57 и получают нлазмиду pES62.
Плазмида pPS62 является вектором экспрессии.
Промотор BAGS/DAOCS Cephalosporium acremonium также может функционировать в Penicillium (обсуждение плазмида pPS52 приведено), но оптимальные векторы выражения Penicillium используют проматор от гена Penicillin@a. Промотор Penicil lium IPS от плазмиды pLC1 {NRRI В-18181) связан со скелетом плазмиды рЯ С12 с помощью синтезированной связующей молекулы, в результате чего продуцируется плазмида рРБ53. Плазмида pPS53 является промежуточным продуктом в построении некоторых других кланирующих векторов и плазмид экспрессии. Содержащий промотор фрагмент Ваш НХ 1,0 кв плазмиды рРБ53 слит с фрагментом, кодирующим последовательность HmR 4, 3 т. п. о. Bam HI плаэмиды рРБ55, в результате чего образуется плазмида pPS57.
Плазмида pPS57 является промежуточным продуктам в построении вектора экспрессии Penicillium pPS62. Плазмида pPS62 содержит отбираемйй маркер (HmR) и гибридный DACS/DAOCS ген с кодирующими последовательностями как
ЭАСБ/DAOCS, так и HmR под контролем прамотора (2 копии) гена Penicillium
IPS.
Вектор экспрессии Penicillium
DACS/DAOCS без атбираемога маркера построен путем вставки содержащего промотар фрагмента 1,0 т.п.о. Bam HI плазмиды рР$53 в точку Bgl IT вектора выражения рХТ511 E,coli ДНК, кодирующей фермент DACS/DAOCS. Плазмида
pIT503 и производные, которые содержа целый ген DACS/DAOCS, используются для повышения способности к продуцированию антибиотика Cephalospor. inn ь родственных им клеток реципиентов, в которых функционируют промотор С .асщей DACS/DÀOÑÁ в геноме Cephalosðorium acremonium. Плазмида pIT503 включает промотор и последователь-" ность, активирующую трансляцию гена
DACS/DA0CS.
Плазмиды pIT503, pPS52 и pPS56 включают. промотор Cephalosporium
4р, acremonium и последовательность, активирующую трансляцию гена DACS/
/DAOCS. Промотор С.acremonium è последовательность,. активирующая трансляцию, расположенные на плазмидах
pIT503, pPS52 и pPS56, могут быть использованы для экспрессии целого ряда последовательностей ДНК. После45 довательность промотора C..acremonium и последовательность, .активирующая
5Q трансляцию, закодирована на фрагмен" тел 440 вр Sst I — Hind ХХЕ, расположены непосредственно над и в непосредственном соседстве с кодирующей последовательностью ВАСБ/DAOCS. Фрагмент, который включает указанный ограничительный фрагмент л440 п.о.
Sst Х - Н пй ХХХ, включает промотор
С.acremonium и последовательность, активирующую трансляцию.
remonium и последовательность, акти вирующая трансляцию. Плазмида рРБ56 включает также придающий стойкость к
5 гидромицину ген который функциониt рует в C.acremonium и .позволяет осу-. ществлять отбор трансформантов С.acremonium pPS56.
После отбора трансформант:Cephalosporium acremonium pPS56 нет необходимости в поддержании давления отбора гидромицина В в среде роста. Отборочное давление не требуется, поскольку трансформанты С.acremonium l5
pPS56 очень стойки. Эта стабильность является результатом трансформации плазмидюй pPS56. С.acremonium через хромосомную интеграцию.
Трансформированные клетки Penicil-.
lium могут быть отобраны с использованием гидромицина В.
Предлагается способ конверсии пе-. нициллина С и пенициллина V в соответствующие цефалоспорины с использованием DACS/DAOCS в Penicillium, который включает трансформацию клетки хозяина.Penicillium вектором рекомбинантной ДНК, который содержит ген, кодирующий выражение активности
DAOCS.
30 Плазмида pIT503 включает геномную
ДНК, составляющую более чем 3 кв, которая расположена ниже ДНК, кодирую17. 173
Последовательность промотора Cep halosporium acremonium è последова.тельность, активирующая трансляцию, е закодированы на плазмиде pIT503. Плаз" мида рЕТ503 содержит фрагмент 440 п.о. Sst I †-. . gind III, Промотор Cephalosporium acremonium и последовательность, активирующая трансляцию, могут быть использованы для экспрессии гетерологичной последовательности ДНК, Влияние промотора ВАСЯ/DAOCS с геном, стойким к бактериальному гидромицину В, позволяет использовать отбор с использованием гидромицина В в Cephalosporium, Описана последовательность окончания транскрипции и другие регуляторные сигналы в 3 -конце гена
DACS/DAOCS. Плазмида pIT503 и ее производные, такие как плазмида
pPS56, содержат дополнительно ДНК более чем 1 т.п.о. ниже точки начала транскрипции гена DACS/DAOCS в геноие Cephalosporium acremonium.
Часть этой 3 -регуляторной ДНК последовательности известна и описана следующим образом.
3 -TAG-3; является трансляционной
I .концевой последовательностью:
5>-ТAG GGA АСС CGC CCA ТСГ AGT ААТ
ААА ТСТ ACG GGA GTT TAA GAA GAA
ААА TTG ССС ТАТ ААА TTG СТА ААТ.
ТТТ ТАА AAC АСА AAG САТ GAG TGT
CAA GAG ТТТ CAA GTT ТСА А-3
Данная последовательность и последовательности, включающие 3 -регу> ляторные последовательности гена
DACS/DAOCS, могут быть введены в векторы экспрессии рекомбинантной ДНК.
Осуществлено впервые клонирование последовательности, которая кодирует фермент DAOCS. Кроме того, как аминокислотная, так и ДНК последовательность фермента экспандазы, особенно
DAOCS синтетазы Cephalosporium асгетоФ, a>urn> могут быть использованы для отделения ДНК, кодирующей экспандазу от про" дуцирующих -лактам организмов, Данная последовательность ДНК может быть использована для приготовления меченых проб, предназначенных для обнаружения кодирующих экспандазу последовательностей ДНК в продуцирующих лактаи организмах. Содержание G и С в кодирующих DAOCS ДНК, составляющие примерно 63Х приводит к тому, что данные ДНК пригодны для выделения
ДНК Shreptomyces, кодирующей DAOCS, s основном S. clavaligerus. ДНК
9856 18.
В обработанные лизоцимом клетки
50 вводят 3 мл лизирующего раствора (приготовленного смешиванием 3 мл
1ОХ-ного тритон-Х. 100 75 мл 0,25 М
ЕДТА, рН 8 0, 15 мл 1: M трис-НС1, рН 8,0 и 7 мл воды), перемешивают и
55 ют, 5
Streptomyces имеет высокое содержание G и С и достигает 70Х. Такое высокое содержание G и С в ДНК позволяет использовать их для выделения гамологичных Я.slavaligerus или других последовательностей ДНК, кодирую-щих DAOCS.
Пример 1, Культура Е,coli
К12 JA 221/pIT508 и выделение плазмиды pIT503.
1 л питательного бульона L (10 и триптона, 10 г NaC1 и 5 r дрожжевого экстракта на 1 л), содержащего
50 мкг/мл ампициллина, инокулируют культурой Е.coli К12 JA 221/pIT503 о и инкубируют в инкубаторе при 37 С до тех пор, пока оптическая плотность при 590 нм не составит 1 ед. поглощения. В течение этого времени в культуру вводят 150 мг хлорамфеникола. Инкубацию продолжают в течение
16 ч. Введение хлорамфеникола ингибирует .синтез белка и, таким образом, ингибирует дальнейшее деление клеток, но обеспечивает дальнейшую репликацию плазмиды.
Данную культуру центрифугируют при скорости вращения 6000 об/мин в течение 5 мин при 4 С. Полученный поо
/ верхностный слой удаляют и клеточную гранулу промывают в 40 мл TES буферного раствора (10 мИ трис-НС1- рН
7,5; 10 NaC1 и 1 мМ этилендиаиинтетрауксусная кислота (ЕДТА) и затем снова гранулируют. Поверхностный слой удаляют и клеточную гранулу замораживают в баке со смесью сухой лед— этанол, а затем оттаивают. Оттаянную клеточную гранулу снова суспендируют в 10 мл раствора 25Х-ной сахарозы и 50 мМ ЕДТА. В данный раствор вводят и перемешивают с ним 1 мл лизоцимного раствора концентрацией
5 мг/мл; 3 мл 0,25 И ЕДТА, рН 8,0 и 100 мкл рибонуклеазы А концентрацией 10 мг/мл. Затем эту смесь инкубируют на льду в течение 15 мин. полученный раствор инкубируют на льду в течение еще 15 иин. Лизированные клетки замораживают в бане со смесью сухой лед — этанол, а затеи оттаива19
1739856,. 20:
Клеточные осколки удаляют из раствора путем центрифугирования при вращении центрифуги со скоростью
25000 об/мин в течение 40 мин. Поверхностный слой экстрагируют буферным фенолом. В этот раствор вводят
30,44 СзС1 и 1 мл раствора этилбромида концентрацией 5 мг/мл. Затем .этот раствор доводят до объема 40 мл к декантируют в ультрацентробежную трубку. Эту трубку герметически эапаивают и раствор центрифугируют в роторной центрифуге при скорости центрифуги 42000 об/мин в течение 16 ч.
Полученную плазмиду, визуализированную ультрафиолетовым светом, выделяют, а затем помещают в трубку и роторную центрифугу, где осуществляют центрифугирование:со скоростью 50000 об/мин в течение 16 ч.. Любое необходимое регулирование объема осуществляют с использованием раствора TES содержащего 0,761 мг/мл CsC1. Затем плазмидную полосу выделяют, экстрагируют насыщенной солью изопропанолом с целью удаления этилбромида, и разбавляют (1:3) буферным раствором TES. В раствор вводят два объема этанола и затем его инкубируют при -20 С в течение ночи. Плазмидную ДНК гранулируют путем центрифугирования данного раствора в роторной центрифуге в течение 15 мин при скорости центрифуги 10000 об/мин.
ДНК плазмиды рХТ503, полученную таким путем (1 мг), суспендируют в
1 мл буферного раствора TES (10 мМ трис-НС1, рН 8,0, 1 мМ ЕДТА) и хранят при -20 С.
Последовательности концевого кодона, кодирующеи последовательности
Г
lрр, замещают íà Bam HI путем ввода синтезированной связующей молекулы
ДНК (5 -CCGGATCCGG-3 ) . Кодирующая последовательность последних тридцати пяти аминокислот липопротеина, трансляционный концевой сигнал и последовательность; соответствующая
3 -нетранслированной зоне информационной РНК, .следует за точкой Bam HI.
Плазмида рКЕ N021 включает также некоторые независимые последователвности на 850 т.п.о., расположенные ниже гена lрр в хромосоме E.co3i.
Примерно 50 мкг плазмиды: pKENIII обрабатывают с 25 рестриктаэами HpaII в 300 мкл буферного раствора IX Нраl
50 те. Фрагмент 950 п.о. HpaII изолируют и извлекают из геля путем электроэлюирования в диализный мешок. После экстракции смесью фенол/СНС1> и осаж55 дения этанолом, ДНК ("2,5 мкг) растворяют в 25 мкл TEN (10.мМ NaC1;
10 мМ трис-НС1, рН 7,4, 1 мИ ЭДТА).
Примерно 2 мкг фрагмента 950 п.о. .HpaII обрабатывают ферментом Alu I
25 (10 мИ трис-НС1, рН 7,4, 10 мИ NgC1<, 1 мМ КС1; и 6 мИ р-меркаптоэтанола) при 3? С в течение 2 ч. Смесь экстрагируют двукратно 300 мл смеси фенола с хлороформом в соотношении 50:50 и извлеченную водную фазу повторно осаждают 2,5 об. этанола и О, 1 об 3 M
Na0Ac Гранулу ДНК растворяют в
100 мкл электрофорезного буферного раствора и фракционируют íà 57. -ном полиакриламидном геле.
Пример 2. Построение плазмиды
pIT5O7.
Построение плазмиды pKEN021 и выделение фрагмента 5 1 т. и. о. Xba I —Bam HI осуществляют следующим образом.
Плазмиду рКЕМ021 получают из плазмиды pKENIII. Плазмиду pKENIII получают из Северного регионального научно-исследовательского центра (NRRL)., служба исследований в области сельского хозяйства, Перория, Иллинойс, 61604, Е.coli CC620, порядковый номер NRRL 15011.
Плазмида рКЕНХХХ имеет фрагмент 2,8 к EcoRI, который включает ген
Е.coli lрр.
В плазмиде pKEN021 фрагментл 650
Ьр EcoRI — Sal I плазмиды pBR322 замещают генной последовательностью
Е.coli lрр..Эти генные последовательности lрр включают фрагмент 462 п.о.
Alu I, расположенный кверху от первого триплета кодирующей последовательности lрр. Этот фрагмент 462 Ьр содержит промотор 5 -нетранслированную зону и точку рибосомного связывания.
Уникальный сайт рестрикции XbaI расположен в пределах точки рибосомного связывания 16 lI,o. перед метионином, инициирующим трансляции. Сайт рест-. рикции Pvu, находящийся вьппе бис, составляет 29: 1 во всех полиакриламидных гелях, за исключением особых случаев. Этот гель окрашивают в раст".. воре, содержащем 0,5 мкг/мл этилбромида., и визуалиэируют полосу ДНК в длинноволновом ультрафиолетовом све39856 22
2!
17 в 200 мкл раствора IXAlu I (50 мИ
NaC1, б мМ трис-НС1, рН 7,6, 6 мМ
NgC1< и 6 мИ Р-меркаптоэтанол) в течение 2 ч при 37 С. ДНК фракционируют в б -ном полиакриламидном геле, фрагмент 462 п.о. Alu Х.извлекают, (1 мкг).растворяют в 10 мл раствора (66 мИ трис-НС1, рН 7„6, 10 мИ ИяС1, 10 мМ дитиотреитол, 0,4 мИ АТР),.сoдержащего 150 пмоль фосфорилированного связующего звена EcoRI (5 -GGAATTCC-3 ) и 2 ед. Т4 ДНК-лига,.эы. После инкубации при 4 С в течение о
16 ч смесь прогревают при 65 С в течение 10 мин и разбавляют до состава раствора: 100 мИ трис-НС1, рН 7,2, 50 мМ NaCl, 10 MgC1 и 6 мМ / -мер-: каптоэтанол, содержащего 40 ед. фермента EcoRI. Через 2 ч выдержки при о
37 С образец экстрагируют смесь фенол/СНС1 и осаждают этанолом. Затем
ДНК растворяют в 20 мкл буферного раствора Т4 ДНК-лигазы, содержащего
Т4 ДНК-лигазу и О, 1 мкг обрабстанной щелочной фосфатазой и ферментом .EcoRI плазмиды pBR322. После сшйвки о при 4 С в течение 16 ч ДНК используют для трансформации Е.coli К1 2 НВ101 (КЗЗП В-15626). Трансформанты отбирают на агаровых пластинах, содержащих
12 мкг/мл тетрациклина и плазмид, выделенных из стойких колоний путем быстрой щелочной экстракции. Плазми дя, содержащая фрагмент 466 п.о.
Xba I — Ваш НХ, использована в качестве исходного материала для следующего этапа.
Примерно 2 мкг этой.плазмиды, обработанной 2 ед. фермента Hind III . в 50 мкл буферного раствора IX Hind
ХХХ (6О мИ NaC1; 1О мИ трис-HCl, рН 7,4, 10 мМ MgC1 и б мИ /З-меркап-. тоэтанол) в течение 1 ч при 37 С, экстрагируют смесью фенол/СНС1>, осаждают этанолом, растворяют в .200 мкл буферного .раствора нуклеазы
ХХ SI (300 мИ NaC1; 30 мИ NaOAc, рН 4,25, 3 мИ ЕпС1 ) и обрабатывают
200 ед, нуклеазы S 1 в течение ч при 15 С. Реакцию прекращают путем о экстракции смесью фенол/СНС1, ДНК .осаждают этанолом. Обрабатывают ферментом Hind III растворяют в 10 мл буферного раствора Т4 ДНК-лигазы, содержащего 20 пмоль фосфорилирован"
I ных связующих звеньев Ваш HI (51 -CCGGATCCGG-3 ) и 2 ед. Т4 ДНКлигазы. После 16 ч инкубации при о ..4 С реакционную смесь нагревают при -
65оС в течение 10 мин и затем разбавляют до 100 мл до получения буферного раствора IX Bam HI (150 мМ
NaC1 20 мИ трис-НС1, рН 8,0, 10 мИ
МяС1 и 6 мМ f5-меркаптоэтанол), содержащего 20 ед. фермента Bam HI.
После 2 ч инкубации при 37 С смесь подвергают очистке в 1 -ном агарозном геле. Этот гель окрашиваются этилбромидом, и более крупный фрагмент (4,5 т.п.о.) извлекают из геля.
Фрагмент имеет когезионно связанные концы Bam HI, Его растворяют в
20 мкл буферного раствора Т4 ДНКлигазы, содержащего лигазу Т4,.ДНК.
Через 16 ч вццержки при 4 С ДНК используют для трансформации Е.coli
20 К12 НВ!Oi (NRRLB-15626). Трансформанты отбирают на устойчивость к ампициллину при 100 мг/мл и на чувствительность к тетрациклину при 10 мкг/
/мл. Плазмиды отобранных колоний исследуют на отсутствие точки Hind ХХХ и на присутствие единственной точки
Bam HI. Последовательный гидролиз
EcoRI, SalI приводит к образованию двух фрагментов размером 466 и 305 п.о. и значительно более длинного фрагмента. Плазмиду. с такими характеристиками модифицируют для превращения точки EcoRI расположенной выше промотора lрр, в ограничительную точку Hind III.
Модификацию проводят путем частичного гидролиза 2 мкл плазмиды в
100 мкл буферного раствора IX EcoRI с ограничительным .ферментом EpoRI..
Реакцию прекращают нагреванием при
"0 65 "С. ДНК экстрагируют смесью фенол/
/СНС1 и осаждают этанолом. ДНК растворяют в 200 мл буферного раствора -. нуклеазы IX S1 содержащего 1000 ед/
/мл нуклеазы Я1, и инкубируют при
12 С в течение 1 ч. Реакцию прекращают экстракцией смесью фенол/СНС1э.
ДНК осаждают этанолом и суспендируют в 10 мкл буферного раствора Т4 ДНКлигазы, содержащего 20 цмоль фосфо50 рилированного связующего звена Hind
III (5 -CCAAGCTTGG-3 )и 2 ед. Т4 ДНКлигазы. После 16 ч инкубации при 4 С смесь нагревают в течение 10 мин при
65©С, разбавляют до 150 мкл с полу
55 чением композиции буфера IX Hind III, содержащего 1О ед. ограничительного ,фермента Жпй ХХХ, инкубируют в те чение 2 ч при ЭУ С и затем фракциони. :руют в Я-ном агарозном гела. ДНК
23; 17 ,извлекают, очищают, растворяют в
20 мкл буферного раствора Т4-лигазы, содержащего Т4-лигазу, инкубируют в течение 16 ч при 4 С и используют для о трансформации Е.coli HB101 (МНИ В-15626). Плаэмиду ДНК трансформант
ApR анализируют. Отбирают плазмиду с фрагментом 500.п.о. EcoRI — Hind ХХХ. Эту плазмиду затем используют как вектор для клонирования 3 -зоны гена lрр. 2 мкг этой плазмиды гидролизуют в 50 мкл буферного раствора
ХХ Яа1 I (150 мИ ИаС1, 6 мИ трис-НС1, рН 7,9, 6 .мИ MgClz 6 мИ Р-меркаптоэтанола) с 2 ед. фермента Sal I в тече- . ние 1 ч при 37 С. Реакционную смесь разбавляют до 150 мкл с получением композиции буферного раствора Bam HI, содержащего 2 ед. фермента Bam HI.
После инкубации ч при 37 С добаво ляют примерно 2,5 ед. щелочной фос. фатазы и инкубируют при 65 С в течение 1 ч..ДНК экстрагируют смесью фенол/CHCl, осаждают этанолом, растворяют в TEN