Фрагмент дезоксирибонуклиновой кислоты, кодирующий промотор sp6 рнк-полимеразы
Иллюстрации
Показать всеРеферат
Использование: молекулярная биология , генетическая инженерия и биотехнология . Сущность изобретения: с помощью химического синтеза получен фрагмент ДНК, кодирующий промотор SP6 РНК-полимеразы.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУбЛИК (st>s С 12 N 15/11
ГОСУДАРСТВЕННЫИ КОМИТЕТ
ПО ИЗОбРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4859449/.1.3 (22) .1 4.08.90 (46) 07.09.92. Бюл. РВЗЗ (71) Новосибирский государственный университет им. Ленинского комсомола (72) И,А. Назаренко, В.В. Горн и Т.П. Артамонова (56) Nucl. Acids Res, 1984. ч.12, М 18, р.7035.
Изобретение относится к молекулярной биологии, генетической инженерии и биотехнологии, и может быть использовано в указанных областях науки для получения
PHK в качестве субстрата для изучения и моделирования основных биологических процессов, протекающих в клетке, а функциональные РНК и олигорибонуклеотиды крайне необходимы также для решения целого ряда задач прикладного характера, таких как медицинская диагностика и искусственный синтез белка.
Известны природные промоторы для
PHK-полимеразы SP6 со следующей структурой: -15 -1О 5, -1+1 . АТТТА66Т6АСАСТАТА6АА666, @ ф t q. Ct. где А — аденин; Т вЂ” тимин; G — гуанин; С— цитидин, à, t, g, с — возможные замены, обнаруженные ь промоторах SP6, Синтез
PHK. начинается с +1 позиции-сайта иници ации транскрипции.
Один из природных промоторов (SP6 4) был,использован для создания вектора, обеспечивающего эффективную транскрипцию в системе In vitro. Для этого фрагмент
Я2,, 1759873 А1 (54) ФРАГМЕНТ ДЕЗОКСИРИБОНУКЛЕИНОВОЙ КИСЛОТЫ, КОДИРУЮЩИЙ ПРОМОТОР ЯРб РНК-ПОЛИМЕРАЗЫ (57) Использование: молекулярная биология, генетическая инженерия и биотехнология. Сущность изобретения: с помощью химического синтеза получен фрагмент
ДНК, кодирующий промотор SP6 РНК-полимеразы.
ДНК фага SP6, содержащий промотор, был клонирован в высокоскопийной плазмиде (риС12 или риС 13), которая содержит полилинкер, узнаваемый рядом эндонуклеаз () рестрикции. Полученные векторы получили название pSP6 4 и pSP6 5. Схема получения
PHK с помощью этих векторов состоит в клонировании заданного фрагмента ДНК по полилинкеру, расщеплении плазмиды рестриктазой для обеспечения терминации а транскрипции и синтеза РНК в присутствии
PH К-полимеразы.SP6, Ql
Недостатки прототипа заключаются в том, что при синтезе PHK невозможно пол-. учить молекулу, строго соответствующую заданной структуре, так как она всегда будет содержать от 5 до 10 "избыточных" нуклеотидов на 5 -конце. Это происходит из-за того, что клонирование ДН К-матрицы происходит по полилинкеру, удаленному от сайта инициации промотора, Поэтому транскрибируется +1 +6-фрагмент и ромотора и последовательность сайта рестрикции, по которому шла встройка.
Цель изобретения — получение фрагмента дезоксирибонуклеиновой кислоты, кодирующего промотор SP6, который по1759873
15
30
50 зволял бы встраивать фрагмент ДНК непосредственно к сзйту инициации транскрипции, синтезировать РНК, не содержащие избыточной последовательности ма 5 -конце, что позволило бы получить молекулу, строго соответствующую заданной структуре, при сохранении высокой промоторной активности.
Свойствами, обеспечивающими достижение цели мог бы обладать олигодезоксинуклеотид, содержащий сайт рестрикции, позволяющий расщепить ДНК с образованием "тупого" конца непосредственмо перед сайтом инициации транскрипции.
Очевидно, что РНК, синтезируемая под таким промотором будет строго соответствовать ДНК-матрице, т.е. не будет. содержать
"избыточных" 5 -нуклеотидных остатков.
Синтезированный олигодезоксинуклеотид (искусственный промотор), где N — нуклеотидные остатки, были подобраны так, что стала возможной рестрикция с образованием "тупого" конца в непосредственной близости от сайта инициации, с одновременной высокой транскрипционной активностью олигодезоксинуклеотида. Синтезированный двухцепочечный олигодезоксинуклеотид имеет следующую структуру:
+1
ААТТСОАТТТАСОТбАСАСТАТ GCT (Ban Н Ц (BcoR1) GCTAAATCCACTGTGATA TCG CCTAG-$, где в скобках указаны "липкие" концы для клонирования олигонуклеотида по указанным сайтам рестрикции, а в рамку взят сайт узнавания рестриктазой Alui, которая при расщеплении дает "тупой конец: АО СТ. ЕсТС16А ли сравнивать синтезированный олигонуклеотид со структурой природного SP6-ïðîмотора, то видно, что для получения
Alul-сайта необходимо ввести замены в+2 и
+3: позиции. Для доказательства того, что такой измененный олигонуклеотидсохрзняет промоторную активность, химически синтезированный олигонуклеотид встраивали в плазмиду pTTQ 19 no EcoR 1 — Вав НЬсайтзм. Полученную плазмиду назвали pTTQ
19-SP6 и испытывали на способность инициировать синтез РНК.в системе in vitro a присутствии РНК-полимераэы SP6. Эффективность сравнивали с эффективностью транскрипции на природном промоторе в плазмиде pSP6 4.
Пример. Получение SP6-лромотора, содержащего Alu 1-сзйт в-1+2 позиции и проверка его промоторной активности.
Синтез олигодезоксирибонуклеотидов .проводили на серийном Отечественном синтезаторе "Виктория-,5M" производства
СКТБ спецэлектроники и аналитического приборостроения СО АН СССР с использованием фосфитамидного метода по стандартным программам. В реактор синтезатора помещали 30 мг полимера
CPG-500, Fluca, с присоединенными через остаток янтарной кислоты первым звеном—
5-диметокситритилнуклеозидом. Диметокситритильную группу удаляли 1,5 трифторуксусной кислотой в абс. CH2CIz в течение
30 с. После промывки реактора абсолютным ацетонитрилом в реактор подавали смесь мономера — 5 -0-диметокситритил-N-ацилдезоксинуклеозид-3 (P-метил, диизопропиламидо)-фосфита (200 мкл 0,1 M раствора в абсолютном ацетонитриле) и активирующего агента — тетразола (200 мкл 0,45 М раствора в абсолютном ацетонитриле). Времяконденсации 80 с. Остаток непрореагировавшего гидрокомпонента ацилировали 2 мин смесью: уксусный ангидрид-триэтиламин-N-метилимидазол-ацетонитрил. (4,5:4.5:1:30). Затем фосфидную группу окисляли 0,1 М йодом в смеси: пиридим-уксусная кислота (9:1) и промывали полимер . ацетонитрилом.
После завершения синтеза олигонуклеотиды, присоединенные к полимерному носителю, обрабатывали смесью диоксан-три- . этиламим-тиофенол (2:1;1) в течение 1 ч для удаления межнуклеотидных метильных групп, затем — концентрированным аммиаком в течение 1 ч при 20 С для удаления нуклеотидного материала с полимера и в течение 15-16 ч при 50 С для деблокирования гетероциклических оснований. Аммиач- . ный раствор упаривали, остаток растворили в 0,1 М трис-буфере (рй 9,0) и выделяли олигонуклеотид с 5 -концевой диметокситритильной группой, обращенно-фазовой хроматографией на колонке с Lichrosorb RP18("Мегск". ФРГ) в градиенте концентраций ацетонитрила 0-30 (, в 0,05 М i i:О04. Нужный пик, элюирующийся при 12-15 (ацетомитрила, собирали, упаривали, удаляли диметокситритильную группу 80 уксусмой кислотой (15 мин при 20 С); раствор ynapwвали и остаток рехроматографировали на той же колонке в приведенных выше условиях.
Клонирование двухцепо ечного олигонуклеотида в pTTQ 19. Данный плазмидный вектор содержит уникальные сайты для рестриктаз BamHf и EcoRl, 10 мг плазмиды в
500 мкл 10 мМ трис-НО-буфера (pH 7,5), содержащего 10 мМ MgO2, 10 MMP меркаптоэтанола и 50 мМ йаО (буфер А), обрабатывали 10 ед. акт. ВаеН! и EcoRI в течение
1 ч при 37 С. Больший ВааН1 u EcoRl фрагмент выделяли препаративным гель-элект1759873 о -ЗРЮ
° èåêóããòÌíüâ лрвмааар(рТМ!9- ЗРЯ рофорезом в 4 полиакриламиде (ПААГ) в трис-боратном буфере (рН 8.3) при напряжении 100 В. Фрагмент из геля извлекали методом электроэлюции.
2 мкг полученного вектора смешивали со 100 пмолями химически синтезированных олигодезоксинуклеотидов, осаждали этанолом, растворяли в 25 мкл 10 М трисHCI-буфера рН 7.5-1 мМ ЭДТА (TE-буфер), добавляли 3 мкл 10-кратного буфера А и 3-5 ед. акт. ДНК-лигазы Т4. Инкубировали 1214ч при10 С. Реакционную смесь осаждали этэнолом, растворяли в стерильном ТЕ-буфере и трансформировали в EcoLIC600. Наличие встройки в выросших клонах подтверждали рестрикционным анализом.
ДНК выделяли методом щелочного лизиса.
Первичную структуру клонированного промотора анализировали методом Максамэ-Гилбертэ. Из анализа пяти клонов видно, что 2-й и 5-м клоны имеют искомую первичную структуру
-t5 -гО 25
AATTCGATTAGGGGACACTATAGCTG 6А.
Проверка промоторной активности (синтез РНК в системе IA YI9o). 0,2 мкг плазмиды, содержащей промотор. инкубировали в 50 мкл реакционной смеси, содержащей 40 мМ трис-HCI. рН 7,5. 6 мМ
MgClz, 2 мМ спермидинэ, 10 мМ дитиотрептол, 0,4 мМ ЧТР, GTP и СТР, 0,4 мМ 3Н-АТР(1
КЮ/ммоль) при 37 С в присутствии 1-2 ед. акт, PHK-полимеразы SP6. Синтезированную РНК определяли в 10 мкл смеси по
5 радиоактивному кислотонерастворимому продукту нэ счетчике "Магк-I I I".
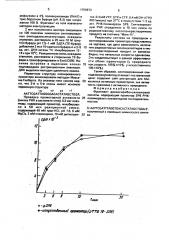
Результаты синтеза на природном и синтезированном промоторе представлены на чертеже, где дана зависимость включе10 ния радиоактивных мононуклеотидов в кислотонерастворимый продукт от времени.
Видно, что начальные скорости одинаковы.
Это свидетельствует о равной эффективности обоих промоторов (у природного
15 нач,скорость 100$+10$, у искусственного
105+" 10 ).
Таким образом, синтезированный олигодезоксинуклеотид отвечает поставленной цели: содержит сайт рестрикции для Aful, 20 является истинным промотором, чья активность сравнима с активность природного.
Формула изобретения
Фрагмент дезоксирибонуклеиновой кислоты, кодирующий промотор SP6 PHK25 полимеразы с нуклеотидной последовательностью,5 -ААТТСОАТТТАООТОАСАСТАТАОСТООА-3, полученный с помощью химического синте30 за.