Средство для определения неспецифической реактивности овец
Иллюстрации
Показать всеРеферат
Использование: экспериментальная и ветеринарная иммунология. Сущность определение неспецифической реактивности овец с помощью гемолизина, который используют в разведении 1:8-1:16. Гемолизин смешивают с периферической кровью исследуемого животного, инкубируют 18ч при 20-24°С в капиллярах и учитывают результаты реакции по скорости оседания эритроцитов и степени гемолиза в опытной и контрольной пробах. По результатам реакции определяют индекс неспецифической реактивности животных. 3 табл.
CO)03 СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
1 (21) 4920201/13 (22) 19.03.91 (46) 07.11.92. Бюл. N. 41 (71) Ставропольский сельскохозяйственный институт и Целиноградский сельскохозяйственный институт (72) А.Ф.Дмитриев, Т.У.Сыздыков, М.А.Никишова, А.К.Булашев и В.П.Мингилев (56) 1. Иммунологическая диагностика вирусных инфекций. M.: Медицина, 1985, с.
81 — 82. (54) СРЕДСТВО ДЛЯ ОПРЕДЕЛЕНИЯ НЕСПЕЦИФИЧЕСКОЙ РЕАКТИВНОСТИ
ОВЕЦ
Изобретение относится к иммунологии и может быть использовано для определения физиологического состояния организма.
Гемолизин — инактивированная сыворотка крови кролика, иммунизированного эритроцитами барана, известен в качестве средства, которое широко используется в лабораторной практике как диагностикум.
Специфическая гемолитическая сыворотка, лизирующая эритроциты барана в высоком титре, применяется в реакции связывания комплемента (Справочник по микробиологическим и вирусологическим методам исследования. /Под ред. М.О.Биргера.— M.:
Медицина. 1982, с. 464).
Известно также применение гемолизина при титровании комплемента. Его активность определяют в той же гемолитической системе, которую используют для реакции связывания комплемента (стандартные эритроциты барана и антисыворотка). Об ак„„«Ы„„1773409А1 (ы)з А 61 К 39/00, G 01 N 33/555 (57) Использование: экспериментальная и ветеринарная иммунология. Сущность! определение неспецифической реактивности овец с помощью гемолизина, который используют в разведении 1:8 — 1:16. Гемолизин смешивают с периферической кровью исследуемого животного, инкубируют 18 ч при
20 — 24 С в капиллярах и учитывают результаты реакции по скорости оседания эритроцитов и степени гемолиза в опытной и контрольной пробах. По результатам реакции определяют индекс неспецифической реактивности животных. 3 табл, тивности комплемента судят по наименьшему количеству исследуемой сыворотки, которое способствует полному или 507; гемолизу сенсибилизированных эритооцитов (1) .
Известен способ определения иммунологической реактивности особей, включающий инкубирование проб крови с тестирующей биологической жидкостью, причем в качестве тестирующей биологической жидкости используют видоспецифическую антисыворотку, которую в соотношении 1:2 смешивают с периферической кровью исследуемого, инкубируют 18 ч при 20-24 С в капиллярах, а результаты реакции учитывают по скорости оседания эритроцитов и степени цитолиза в опытной и контрольной пробах.
Недостатком этого способа является то, что для его осуществления в условиях лаборатории необходимо приготовление видоспецифической сыворотки, что сопряжено с 1773409
10 большими трудностями (наличием лабораторных животных, затратой средств и времени). Кроме того, сыворотки, полученные в условиях раэличн ых лабораторий и в разное время, не отличаются стабильностью. Качество полученных антисывороток зависит от многих факторов, связанных с технологией их получения, в том числе: от степени очистки антигена, уровня иммунного ответа лабораторных животных и других.
Целью изобретения является расширение арсенала средств для определения неспецифической реактивности организма и повышение возможности их практического применения.
Эта цель достигается применением гемолизина в качестве средства для определения неспецифической реактивности у овец. Определение реактивности поголовья овец осуществляется in vitro путем смешивания гемолитической сыворотки с периферической кровью исследуемого животного, инкубирования смеси в капиллярах с последующим учетом результатов реакции через
18 ч по степени цитолиза в опытной и контрольной пробах.
Существо технического решения заключается в следующем.
Гемолитическую сыворотку в соотношении 1:2 смешивают с периферической кровью исследуемого животного, инкубируют 18 ч при 20 — 24 С в капиллярах, а результаты реакции учитывают по скорости оседания эритроцитов и степени гемолиза в опытной и контрольной пробах.
Бидоспецифические антитела гемолитической сыворотки под влиянием комплемента исследуемого животного вступают в реакцию с эритроцитарными антигенами, что приводит к их агглютинации и гемолизу.
Цитотоксические действие гемолизина зависит ат содержания комплемента в крови исследуемого животного, а также от функциональной активности клеток крови и генотипических особенностей организма, Предлагаемое средство испытано на овцематках, новорожденных ягнятах и поясняется примерами.
Пример 1. Готовили различные разведения гемолизина на физиологическом растворе и ставили реакцию капельной гемагглютинации с кровью исследуемого животного, Гемолитическую сыворотку для реакции связывания комплемента использовали в разведении 1/8, 1/ 16, 1/32, 1/64, 1/128.
Одну каплю крови исследуемого животного наносили на предметное стекло, затем добавляли одну каплю гемолизина, быстро перемешивали стеклянной палоч15
55 кой и через 3 — 5 мин учитывали результаты реакции в крестах, Как видно из приведенных данных s табл, 1, наибольшее разведение гемолизина, с которым набл одается агглютинация эритроцитов исследуемых проб крови, составило 1/128, Однако у некоторых >кивотных (K 35; 9586; 4570 и др.) реакция была отрицательной. Наиболее выраженная реакция, интенсивностью не менее двух крестов, отмечалась в разведении гемолитической сыворотки, равном 1/16. Б связи с этим для определения иммунологической реактивности животных была взята гемолитическая сыворотка 1:16.
Пример 2. В капиллярную пипетку аппарата Панченкова 1/2 обьема 50 мм набирали гемолизина и выливали в лунку предметного стекла. Затем этой же пипеткой набирали кровь (1,00 мм) и тоже выливали в лунку. Кровь исследуемого животного тщательно перемешивали с антисывороткой и полученную смесь набирали в пипетку и ставили в штатив. В связи с тем, что гемолизин смешивался с кровью исследуемого животного в разведении 1:2 его рабочее разведение было 1;8.
Ставили также контрольную пробу для каждого животного отдельно, В ко)<трол ь ном капилляре вместо гемолитической сыворотки использовали физиологический раствор.
Учет реакции (контроль и опыт) проводили через 18 ч по скорости оседания зритроцитов (высота столба осевших эритроцитов), а также степени цитолиэа.
Индекс неспецифической реактивности определяли по формуле
ИНР = (А — Б) . А+ (С вЂ” D): С, где ИНР— индекс неспецифической реакТИВНОСТИ;
А —. высота столба осевших эритроцитов в опытном капилляре;
 — BblcoTB столба осевших зритроцитов в контрольном капилляре;
С вЂ” степень гемолиза в крестах в опытном капилляре;
D — степень гемолиза в крестах в контрольном капилляре.
Результаты учета реакции по отдельным животным представлены в табл. 2.
KGK видно из приведенных данных п табл. 2, высота столба осевших эритроцитов в опытном и контрольном капиллярах у животных была различной. Наиболее существенная разница отмечена у животного N.
4027 (7 мм в контроле и 67 мм в опыте), что соответствовало самому высокому индексу реактивности. У животного N. 10С4 разница была менее существенной т.е, 1 мм, а ии1773409 декс неспецифической реактивности составил 0,07.
Пример 3. По изложенной методике была проведена оценка неспецифической реактивности 92 овцематок и ро.кденных 5 ими 97 ягнятах. В результате исследований (табл. 3) установлено, что средние значения индекса неспецифической реактивности у . овцематок были значительно выше, чем у 10 я гнят.
Как видно, различия между группами животных не олько по средним величинам, 15 но и характеру распределения величин статистически достоверны. Дисперсия показателя реактивности у ягнят была более выраженной, чем у маток. Коэффициент vaриации индекса неспецифической реактив- 20 ности у ягнят составил 98,6;ь, а у маток
65 10/
При сопоставлении результатов реакции у овцематок и рожденных от них ягнят усгановлено, что у ягнят случаев гемолиза 25 эритроцитов при добавлении гемолитиче ской сыворотки не наблюдалось, У овцематок наоборот такие случаи регистрировались Goner чаще. Видимо это следует объяснить отсутствием комплемен- 30 та в крови у новоро>кденных ягнят.
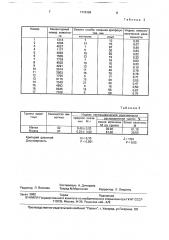
Поскольку система комплемента играет важную роль в поддержании гомеостаза поТаблица 1
Инвентарныи номер животного
Номер
2
4
6
8
11
12
13
14
16
17
18
19
09661
Б/35
1294
04033
9586
2177
07941
02966
2464
2257
07276
4593
1644
0706
1971
9981 казатели этой реакции отражают особенности реактивности организма, Таким образом, предлагаемое средство при использовании его с целью определения неспецифической реактивности позволяет значительно расширить возможности практического применения, особенно при массовом обследовании поголовья.
Использование известного диагностикума в качестве средства для определения неспецифической реактивности имеет преимущества, так как он выпускается биологической промышленностью, стандартизирован и имеется в любой районной лаборатории.
Поскольку гемолитическая сыворотка проявляет своедействие в присутствии комплемента, стало быть от реактивности комплемента, содержащегося в крови исследуемого животного, зависит проявление агглютинации и гемолиза, обусловленного действием антител, С другой стороны результаты реакции зависят также от специфики антигенов, адсорбированных на поверхности эритроцитов.
Формула изобретения
Применение гемолизина в качестве средства для определения неспецифической реактивности овец.
1773409
Таблица 2
Таблица 3
Составитель А. Дмитриев
Техред M.Ìoðãåíòàë Корректор Л. Ливринц
Редактор Л. Волкова
Заказ 3882 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5
Производственно-издательский комбинат "Патент", г. Ужгород, ул.Гагарина, 101
Критерий различий
Достоверность
td = 6,70
Р < 0,001
Х 1:54
Р < 005