Способ определения микроколичеств рения
Иллюстрации
Показать всеРеферат
Сущность: для определения рения в щелочной среде. Сущность: Для определения рения в щелочной среде переводят рений (VII) в анализируемой пробе в форму рения (IV). Для этого к пробе добавляют раствор SnCIa в NaOH до концентрации хлорида олова 0,05 М и NaOH - не менее 2.5 М. Раствор выдерживают в течение 15-20 мин. Затем добавляют реагент - раствор бензолазобензолазороданида в 0,01 М NaOH до концентрации реагента 2,7 10 М и NaOH не менее 1,5-2,5 М. Измеряют начальную оптическую плотность раствора при 570 нм и время t, в течение которого величина оптической плотности уменьшится в 1,5-2 раза. Содержание Re определяют по калибровочному графику, построенному в координатах 1 /t - концентрация Re или стандартному раствору Re. 1 табл. w Ё
союз советских
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (я)5 G 01 N 21/78
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР!
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4863152/25 (22) 31.08,90 (46) 30.11.92. Бюл. М 44 (71) Институт геохимии и аналитической химии им. В.И.Вернадского (72) Е,И.Пластинина, P.Ô.Ãóðüåâà и Л.В.Борисова
i56) Авторское свидетельство СССР
М 735975, кл. G 01 N21/24,,1977.
Bozhkov О.D. et a!. — Talanta, 1988, ч. 35, N1,,р, 62.
Борисова Л.А. Аналитическая химия рения. М.: Наука, 1974; с. 142. (54) СПОСОБ ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ РЕНИЯ (57) Сущность: для определения рения в щелочной среде. Сущность: Для определения
Изобретение относится к аналитической химии и может быть использовано для. количественного определения рения в щелочных растворах, получаемых при анализе ренийсодержащих природных и технологических материалов. Например, в природных материалах после разложения их щелочным сплавлением, в щелочных растворах после вымывания рения, сорбированного на ионитах, в щелочных растворах после анодного разложения отходов производства сплавов и переработки отработанных катализаторов 0Ð
Известны спектрофотометрические способы определения рения в щелочных средах. Способы основаны на реакциях комплексообразования восстановленных форм рения с органическими реагентами: гидро„„Ы2„„1778646 Al рения в щелочной среде переводят рений (Ч!!) в анализируемой пробе в форму рения (IV). Для этого к пробе добавляют раствор
$пС!2 в NaOH до концентрации хлорида олова 0,05 М и NaOH — не менее 2,5 М, Раствор выдерживают в течение 15-20 мин. Затем добавляют реагент — раствор бензолазобензолазороданида в 0,01 M NaOH до концентрации реагента 2,7 10 М и NaOH не менее
1,5-2,5 М. Измеряют начальную оптическую плотность раствора при 570 нм и время т, в течение которого величина оптической плотности уменьши1ся в 1,5 — 2 раза. Содержание Re определяют по калибровочному графику, построенному в координатах 1/t— концентрация Re или стандартному раствору Re. 1 табл. ксиламином (ГАМ), дитиооксамидом (ДТО).
Эти способы характеризуются высокими значениями пределов обнаружения (ПО).
Определяемый минимум рения (мкн/мл) с помощью ГАМ вЂ” 1,4, ДТΠ— 4, 5.
Наиболее близким по технике проведения и достигаемым результатам является способ. основанный на каталитическом действии рения (Н!!) на реакцию восстановления теллурат-ионов хлоридом олова (!!) в среде соляной кислоты. Реакцию проводят следующим образом: В три пробирки вносят 0,1-1,0 мл испытуемого раствора с содержанием 0,1-0,001 мкг рения. Во вторую пробирку добавляют стандартный раствор рения с содержанием 0,02-0,1 мкг рения, в третью пробирку — стандартный раствор с содержанием 0,002-0,01 мкг рения. Все три
1778646
10
20
45
50 разом
55 раствора разбавля от до 1,5 мл и пипеткой в каждую пробирку вносят по 1 мл реактивной смеси и 1,5 мл раствора SnClz (100 r олова растворяют в 250 мл концентрированной соляной кислоты), Реактивную смесь готовят перед смешиванием 5 мл 5 -ного раствора теллурата натрия, 2 мл 45 (>-ного раствора винной кислоты, 1,5 мл 0,5 -ного раствора желатина, После этого тщательно перемешивают содержимое пробирок и оставляют стоять на 1-2 ч. Одновременно проводят холостой опыт, смешивая 1,5 мл воды и 1 мл реактивной смеси. Если ээ это время в анализируемом растворе не появится окраска, то растворы оставляют до следующего дня. Измеряют оптическую плотность растворов при 436-470 нм, сравнивая со вторым раствором (если измерения проводят через 1-2 часа) или с третьим раствором (если измерения проводят на следующий день). Количество рения х в анализируемом растворе рассчитывают по формуле х = а Ах —, где а — количество рения, Аа+х Ах добавленное к тому раствору, с которым сравнивался анализируемый раствор. Ах и
<+x — оптическая плотность анализируемого и стандартного раствора (с которым сравнивался анализируемый раствор) растворов соответственно, ПО рения по этому методу достаточно низкий (0,0004 мкгlмл), однако, скорость каталитической реакции не высока, что увеличивает время анализа до суток. Существенным недостатком этого метода является также низкая избирательность. Определению мешают молибден, вольфрам и др. сопутствующие элементы.
Более того, укаэанный способ осуществляется в сильнокислых растворах, поэтому его применение для анализа щелочных производственных ренийсодержащих растворов затруднено, так как требует трудоемкой и не всегда осуществимой (иэ-за высокой минералиэации) операции перевода щелочных растворов в кислые.
Целью изобретения является увеличение экспрессности и селективности, возможности определения рения в щелочной среде.
Для этого в способе определения микроколичеств рения, основанном на каталитическом действии ионов рения на реакцию восстановления спектрофотометрического реагента оловом (!!) и последующим спектрофотометрическом измерении изменения оптической плотности анализируемого раствора во времени, в качестве спектрофотометрического реэгента использовано соединение бензолазобензолазороданин (БАБАР), э оеакцию восстановления спектрофотометрического реатента проводят в щелочной среде в присутствии рения (IV), предварительно полученного восстановлением рения (Н !), При этом восстановление рения(Н!!) проводят оединениями олова (II) в среде не менее 2,5 М гидроксида натрия, а реакцию восстановления реагента (БАБАР) ведут в среде 1,5-2,5 М гидроксида натрия.
БАБАР получали по известной методике: аэосочетанием р-аминоазобензола с роданином в слабощелочной среде, и имеет следующую структурную формулу:
Оптимальным условиям образования рения (IV) по реакции восстановления перенат-ионов соответствуют концентрация гидроксидэ натрия в растворе не менее 2,5 М, концентрация олова (П) не менее 0,05 М, время максимального выхода рения (IV)—
15-20 мин. Далее к раствору рения (IV) добавляют раствор БАБАР в 0,01 NaOH до концентрации реагента 2,7 10 M и гидро-5 ксида натрия 1,5-2,5 М, измеряют оптическую плотность раствора при il. = 570 нм (! =
1 см) и время, в течение которого оптическая плотность раствора уменьшается в е (1,5 — 2) раза.
Минимальная концентрация рения для данных оптимальных условий равна 0,005 мкг/мл рения. Градуировочный график, построенный в координатах 1/te-f(CRe). где te — время. мин, в течение которого оптическая плотность раствора уменьшилась в е раз.
CRe — концентрация рения в растворе, мкг/мл, линеен в диапазоне 0,01-0,1 мкг/мл рения. Определению 0,02 мкг/мл рения не мешают,100-кратные количества Мо, W, 40кратные Cd, Ni, равные — Cu. Мешают определению окисл ители и элементы, образующие комплексы с БАБАР в щелочных средах. Способ осуществляется следующим обПример 1. Построение градуировочного графика.
К аликвотной части раствора, содержащей 0,05-0,5 мкг рения, приливают 1 мл 5 М
NaOH и 1 мл 0,5 М раствора ЯпС!2в 5 M
NaOH, так, чтобы концентрация NaOH в конечном объеме была равна 2,0 М. а концентрация олова (П) — 0,1 М.. Через 20 мин к раствору приливают 0.5 мл 2,7 10 M раствора БАБАР в 0,01 М NaOH тэк. чтобы кон1778646 центрация БАБАР в конечном обьеме (5 мл) была бы равна 2,7 10 М, Раствор разбавляют до 5 мл, перемешивают и одновременно включает секундомер. Раствор помещают в кюветуc I 1 см и регистрируют оптическую плотность (А) при 570 нм, отмечая время, в течение которого А уменьшится в 2 раза. 3а точку отсчета принимают значение оптической плотности Ао холостого раствора, измеренную сразу после сливания реагирующих компонентов. Далее по полученным данным строят градуировочный гРафик В кооРдинатах 1/te f(CRe). KOTOP A используют для определения концентрации рения в анализируемых растворах.
Пример 2. Определение рения в государственных стандартных образцах медистого песчаника ГСО 2887 — 84 и 2888 — 84.
Элементный состав образцов следующий: Cu, Pb, Zn, S, Ag, Fi, P. Приводим полное описание подготовки образца к анализу: В железном тигле навеску образца смешивают с 6,5 r NazOz и 1,5 r йа2СОз, поверхность смеси засыпают тонким слоем йа2СОз, тигель помещают в муфельную печь, нагревают до 600 в течение 1 ч. Затем охлажденный плав выщелачивают водой и кипятят до реализации пероксида водорода. Затем для отделения рения от следов окислителей и сопутствующих элементов проводят экстракцию рения ацетоном. Для этого раствор с осадком упаривают до 50 мл, охлаждают, создают концентрацию
NaOH в растворе 5 М, проводят экстракцию рения порциями ацетона по 20 мл дважды по 5 мин. Время расслаивания фаз — 10 мин, Экстракты объединяют, промывают 6 мл 5
М NaOH в течение 1 — 2 мин. Экстракт упаривают досуха на водяной бане, остаток растворяют в 10 мл воды. Далее проводят приготовление измеряемых растворов, как указано в предыдущем примере 1.
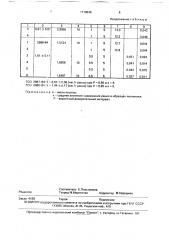
Исходные данные и результаты определения рения представлены в таблице. Расчет концентрации рения в измеряемом растворе проводили по градуировочному графику или ро сравнению со стандартным раствором, по формуле: ст
Сяе = из,1 ст с
te где CRe — и Сст — концентрации рения в измеряемом и стандартном растворах, соответственно, tc u te " (мин) — времена уменьшения оптической плотности измеря10 емого и стандартного растворов в 2 раза.
Содержание рения в образце onðåäåãÿли по формуле
Ч н.р < изм.
Re
V алл. Р где Х вЂ” содержание рения в образце, мкгlг;
CRe — концентрация рения в измеряемом
РаСтВОРЕ, МКГ/MR, Чан.p., Чизм., Van.v. — ОбЪЕмы анализируемого, измеряемого и аликвотной части раствора, мл; P. — навеска
20 образца.г
Формула изобретения
Способ определения микроколичеств рения, заключающийся в добавлении к про25 бе раствора хлорида олова, раствора реагента и измерении оптической плотности раствора, отличающийся тем. что, с целью увеличения селективности, экспресс ности и обеспечения возможности опредеЗ0 ления рения в щелочной среде, добавляют к пробе раствор хлорида олова в NaOH до концентрации в полученном растворе хлорида олова не менее 0,05 М, à NaOH — не менее 2,5 М, выдерживают полученный расЗ5 твор в течение 15-20 мин, добавляют в него в качестве реагента раствор бенэолаэобензолазороданида в 0,1 M NaOH до концентрации реагента 2,7 10- M u NaOH 1,5 — 2,5
М, измеряют начальную оптическую плот40 ность раствора при 570 нм и время т. в течение которого величина оптической плотности уменьшится в 1,5-2 раза, а содержание рения определяют по калибровочно- му графику, построенному в координатах
45 1/t — концентрация рения или по стандартному раствору рения.
1778646
Продолжение т а б л и ц ы
ГСО 2887 — 84: Х = 0,63 + 0,08 (мкгlг рения) при P = 0,95 и n = 4;
ГСО 2888 — 84: X = 1,44+ 0.17(мкгlг рения) при Р =0,95 и n = 6, П р и м е ч а н и е. и — число опытов; х — среднее значение содержания рения в образцах песчаника;
P — вероятный доверительный интервал.
Составитель Е.Пластинина
Техред M.Ìoðråíòàë Корректор М,Керецман
Редактор
Производственно-издательский комбинат "Патент", г. Ужгород, ул,Гагарина, 101
Заказ 4188 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5