Ингибитор рнк-геномных бактериофагов
Иллюстрации
Показать всеРеферат
Использование: биотехнология, микробиологическая промышленность. Сущность изобретения: для борьбы с РНК-геномными бактериофагами в микробиологической промышленности и биотехнологических экспериментах предложены нуклеазы, обладающие ДНК-полимеразной активностью, в качестве последних могут быть использованы как панкреатические дезоксирибонуклеазы и рибонуклеазы, а также эндонуклеазы и рибонуклеазы бактериального происхождения. 4 табл.
,,ÄÖ,, 1781295 А1
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (я)ю С 12 N 9/14
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР) с < „ " 7 )
-; "-"?.г-, 1
К:АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4832453/13 (22) 31.05.90 (46) 15.12.92. Бюл. N. 46 (71) Казанский государственный университет им. B. И. Ульянова-Ленина (SU) и Лейпцигский университет им. Карла Маркса (DD) (72) И, Б. Лещинская, Ф, Р. Шарийова, М; Н.
Филимонова (SU), Э. Штенц, А. Рокштро и
3. Клуге (Р0) (56) Адамс M., Бактериофаги, М,. Иностранная литература, 1961, с. 57.
Авторское свидетельство СССР
М 1314670, С 12 N 9/14, 1989.
Изобретение относится к области микробиологической промышленности и биотехнологии и может быть использовано для защиты бактериальных штаммов, используемых в производственных процессах от.бактериофагов, вызывающих лиэис культур.
До сих пор не существует надежного способа борьбы с бактериофагами в микробиологическом производстве. Стерилизация производственных биореакторов . является дорогостоящей, сложно реализуется и не обеспечивает полной гибели бактериофагов, Целью изобретения является повышейие эффективности борьбы с PHK-содержащими бактериофагами в микробиологическом производстве.
Поставленная цель достигается прйменением в качестве ингибиторов PHK-геномных бактериофагов препаратов нуклеаз, обладающих PHK-деполимеразной актив, 2 (54) ИНГИБИТОР PHK-ГЕНОМНЫХ БАКТЕРИОФАГОВ (57) Использование: биотехнология, микробиологическая промышленность. Сущность изобретения; для борьбы с
РНК-геномными бактериофагами в микробиологической промышленности и биотехнологических экспериментах предложены нуклеазы, обладающие ДНК-полимеразной активностью, в качестве последних могут быть использованы как панкреатические дезоксирибонуклеаэы и рибонуклеазы, а также зндонуклеазы и рибонуклеазы бактериального происхождения. 4 табл, ностью. Принципиально новые биогенные ингибиторы обладают широким спектром действия по отношению к различным группам бактериофагов и представляют собой нетоксичные экологически чистые вещества, безвредные для производственных штаммов бактерий.
Нуклеазы — белковые ферментные препараты с высокой каталитической активностью и способностью к неспецифическому расщеплению РНК по эндонуклеолитическому механизму до олиго-, три-, ди- и манонуклеотидов, в связи с чем эти ферменты способны ингибировать различные РН К-геномные бактериофаги, например фаги М 12, f 2 и QB Е соИ, а также фаг PP 7 Pseudomonas aeruginosa.
Добавление ферментов в питательную среду в количестве 2-12 мкг/мл (4000 — 5000 ед/мл) практически полностью подавляет развитие фаговой инфекции, не влияет на
1781295 рост и размножение бактерий и, следовательно, на количество и качество целевых микробных продуктов и является экологически безопасным.
Использовали следующие нуклеазы:
Рибонуклеаза Bacillus !меггпесИоз(Биназа, РН Каза Bi, ЕС 3,1.27,2) представляет собой термостабильйый фермент — эндонуклеазу, препарат которой имеет удельную активность — 1,3 х 10 ед/мг белка.
Ферментный препарат выпускается на
Экспериментальном биотехнологическом производстве ЙОС АН Латв, CCP по разра ботанному нами способу.
Рибонуклеаза Bacillus amyloliquefaciens (Барназа, РЙКаэа Ва, ЕС 3.1.27.2) представляет аналог РЙКазы Bi и производится на том же заводе. Удельная активность препарата барназы составляет 2,6 х 10 ед/мг
6 бел ка.
Эндонуклеаза Serratia marcescens (Эн"донуклеаза Sm, ЕС 3.1,30.2) представляет собой теомолабильный фермент — эндонуклеазу, атакующую ДНК и РНК, Удельная активность препарата составляет 0,35 х 10
6 ед/мг белка. Препарат производится на Вышнеполоцком заводе ферментных препаратов Миймедбйопрома СССР.
Рибонуклеаза панкреатическая (РНКаза А; ЕС 3. t.27.5), коммерческий препарат, йройзводимйй на Ленинградском фармзаводе, Представляет собой фермент, расщепляюший РНК с удельной активностью
0,35 х 10 ед/мг белка.
Дезоксирибонуклеаза панкреатическая (ДН Каза 1, ЕС 3.1.21.1), коммерческий препарат, производимый на Ленинградском фармэаводе. Представляет собой белковый ферментный препарат, расщепляющий только ДХК с удельной активностью 0,5х х10 ед/мг белка.
Все исследуемые ферменты — белки, которые быстро разлагаются"в природе, поэтому экологически безопасйы, нетоксичны для человека, животных, растений.
ПрЬтивофаговое действие препаратов было испытано в отношении РНК-содержащих бактериофагов Е, coll u Ps. aeruglnosa o èt:noëüéîààíèåì ñëåäóþùé3< сйстем:
М 12 / Е.coll W 1665 F
f 2/ Е,coll К1046
QB / Е.coll АВ 301
PP 7 / Ps.aeruginosa
Ингибиторная активность нуклеаэ в.отношении бактериофагов ойределялась с помощью луночного метода и методом определения минимальной концентрации ингибированйя в чашках Петри с двухслойным агаром.
При луночном методе в верхний питательный слой вносились бактерии и соответствующие бактериофаги, а в лунки (Д=10 мм) добавляли 0,05 мл ферментного раствора.
Чашки инкубировали 24 ч при 37 или 28 С (Е.coll и Ps,aeruginosa соответственно). В направлении градиента диффузии ферментов образовывались радиальные зоны ингибирования фагов, в которых отсутствовали зоны фаголизиса бактерий (негативные ко10 лонии или "бляшки" ), Средние значения зон ингибирования получали не менее чем из 9 повторностей.
Для определения оптимальных доэ препаратов нуклеаз методом минимальных концентраций ингибирования (МКИ) в верхний агаровый слой вносили бактериофаги, бактерии и ферментные препараты в разных концентрациях. После инкубирования в течение 24 ч при 37 (28ОC) определяли про15
20 цент ингибирования путем сравнения числа образованных негативных колоний с числом таких колоний в контрольных чашках, в которые фермент не вносили, Конечная кон25 центрация фермента в агаре, при которой еще происходит образование негативных колоний, считается минимальной концентрацией ингибирования.
Результаты показали, что предлагаемые в качестве ингибиторов препараты нуклеаз
30 действуют на все изучаемые бактериофаги, а именно препятствуют процессу образования негативных колоний, Были получены широкие зоны ингибиро35 вания, свидетельствующие о том, что препараты действуют в очень низких концентрациях, которые образуются в зонах диффузии ферментов.
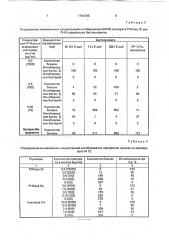
Действие РНКаэы Bi на РНК-содержа40 щие бактериофаги(метод лунок) показаны в табл. 1.
Изучение фагоингибирования препаратов нуклеаз в концентрациях, соответствующих одинаковой каталитической активности
45 показало (табл. 2), что РНКазы В, А Ва и нуклеаза Sm в условиях, когда ферменты диффундируют из лунок в агаре, образуют зоны ингибирования 7,4. Антифаговое дейСтвие нуклеаз на примере системы М
50 12/Е,coll W 1665 F+ (метод лунок) показано в табл. 2.
7,1, 6,2 и 4,7 мм соответственно, тогда как ДНКаза 1, неспособная к разрушениям
РНК, не влйяет на РНК-геномные бактерио55 фаги, Пример 2 свидетельствует, что для фагоингибирования ферменты должны обладать PEК-деполимеразной активностью.
В табл. 3 представлены результаты определения МКИ для РНКазы Bl с использованием четырех фаговых систем. Показано, 1781295
Таблица 1
Таблица 2 что МКИ РНКазы Bl в отношение бактериофагов М 12, f 2 и PP 7 приблизительно составляет 0,6 мкг/мл агаризованной среды, что соответствует 800-1000 ед/мл. Фаг QB более устойчив к действию РНКазы, поскольку фермент в концентрации, соответствующей 780 ед/мл способен ингибировать его только на 37 .
Поэтому МКИ для этого фага выше и соответствует активности РНКазы около 7800 ед/мл.
Для сравнительной характеристики препаратов использовали такие их концентрации, при которых РНК-деполимеразная активность, рассчитанная на 1 мл агаризованной среды была одинаковой. Результаты представлены в табл, 4, Установлено, что разные препараты нуклеаз в концентрациях, соответствующих одинаковой РНКазной активности, оказывают приблизительно одинаковое противофаговое действие. МКИ препаратов РНКазы
Bi, РНКазы Ва, РНКазы А и нуклеазы Sm соответственно составляют: 3,0, 2,0, 12,0 и
12,0 мкг/мл.
Как следует из табл. 1-3, ни в одном из случаев препараты нуклеаз не оказывали вредного влияния на размножение, рост и развитие бактерий-хозяев.
Проведенные эксперименты с нуклеазами, выделенными из разных штаммов В.
InterrnedIus (4 штамма) и S. marcescens (3 штамма), а также РНКазой А, свидетельству5 ют, что источник получения фермента не оказывает влияния на его ингибирующую активность. Вероятно, любые РНКазы обладают ингибирующим действием в отношение РНК-содержащих фагов, причем
10 степень ингибирования зависит от ферментативной актибности препаратов, а также в определенной степени от сложности строения фага. Так, к примеру, наиболее устойчивым к действию нуклеаз оказался фаг ОВ
15 Е.соИ, для полного ингибирования роста i
20 Проведено также изучение действия перечисленных нуклеаз, включая панкреатическую ДНКазу, на 4НК-геномные фаги Е.coll, В.subtiils, Ps.aeruginosa, Ps.fiuorescens. Ингибирующего действия не проявил ни один
25 из исследуемых ферментных препаратов.
Формула изобретения . Применение нуклеаз. обладающих
РНК-диполимеразной активностью, в качестве ингибитора РНК-геномных бактерио.30 фагов.
Таблица 3
Определение минимальных концентраций ингибирования (МКИ) препарата РНКазы Bl для
РНК-содержащих бактериофагов. с
Данные опытов (обозначения) Бакте ио аги
М 12/ Е.coll f 2/ Е.соИ
PP 7/Ps, aeruginosa
QB/ Е.coll
6,0 (7800) 0
100
100
100
100
0,6 (780) 429
89
86
0
0,06 (78) 653
309
37
Контроль без фермента
Количество бляшек
311
683
113
Таблица 4
Определение минимальных концентраций ингибирования препаратов нуклеаз на примере фага M 12, Концентрация РНКазы в агэризованной среде, мкг/мл (ед/мл) Количество бляшек
Ингибирование фагов, %
Ингибирование бактерий
Количество бляшек
Ингибирование фагов, %
Ингибирование бактерий
Количество бляшек
Ингибирование фагов, %
Ингибироваwe бактерий
1781295
Продолжение табл. 4
Составитель Ф. Шарипова
Техред М.Моргентал Корректор С. Патрушева
Редактор
Производственно-издательский комбинат "Патент", r. Ужгород, ул.Гагарина, 101
Заказ 4256 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5